C'est quoi un ATG ?
L'analyse thermogravimétrique (ATG) est une technique d'analyse thermique qui consiste en la mesure de la variation de masse d'un échantillon en fonction du temps, pour une température ou un profil de température donné.
Une telle analyse suppose une bonne précision pour les trois mesures : masse, temps et température.Quels sont les conditions d'analyse thermique ?
La vitesse de chauffe peut être comprise entre 0,01 et 100°C/min.
La Setsys Evolution fonctionne entre 25°C et 1600°C sous balayage de gaz (argon, azote, air…).
La capacité de la balance est de 40g avec une résolution de 0,04µg.Quelles techniques d'analyse thermique Peut-on utiliser pour identifier une transition vitreuse ?
La température de transition vitreuse d'un matériau peut être mesurée par l'analyse thermique différentielle, ou méthode DSC (Differential Scanning Calorimetry), qui est la technique statique la plus couramment employée à cet effet.
- La température au point visé par le curseur au centre de l'image est affichée en haut à gauche.
A l'intérieur les défauts d'isolation apparaissent en bleu, à l'extérieur c'est l'inverse, ils apparaissent en rouge.
Sur cet exemple, les deux thermogrammes sont identiques mais ont une échelle de température différente.
Analyse thermique par ATD DSC ou ATG
Memoire
Analyse Thermique ATD/ATG/DSC
Climatologie : Notions & Applications / Pr L NASSIRI
Manuel de climatologiepdf
Climatologie
CLIMATOLOGIE FONDAMENTALE Rappels généraux Eléments
CHAPITRE I : ELEMENTS DE CLIMATOLOGIE
Manuel du cours de CLIMATOLOGIE

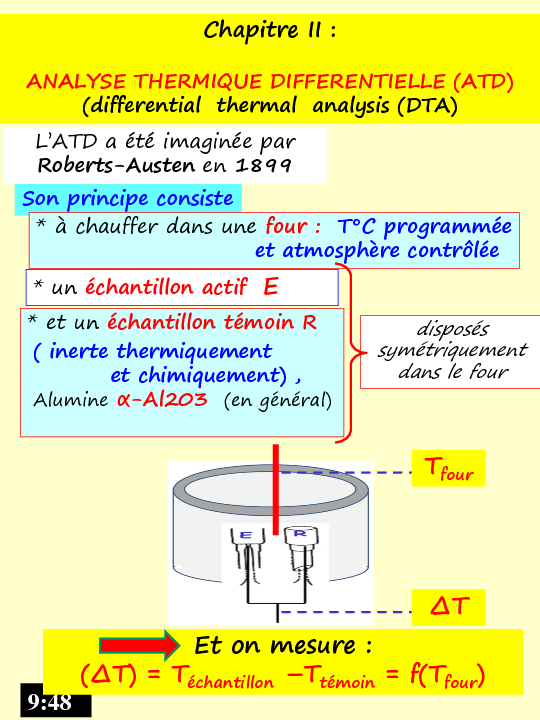
disposéssymétriquementdans le fourChapitre II :ANALYSE THERMIQUE DIFFERENTIELLE (ATD)(differentialthermal analysis(DTA)Roberts-Austenen 1899Son principe consiste*àchaufferdansunefour:T°Cprogramméeetatmosphèrecontrôlée*unéchantillonactifE9:48*etunéchantillontémoinR( inerte thermiquementet chimiquement) ,AlumineŴ-Al203 (en général)Et on mesure :(
7) = Téchantillon±Ttémoin= f(Tfour)Tfour 7Et on mesure :( 7) = Téchantillon±Ttémoin= f(Tfour)Tfour 7T°CtempsEt on mesure :( 7) = Téchantillon±Ttémoin= f(Tfour)Tfour7TéchantillonABPente de la droite AB= Vitesse de chauffage9:48Tfour~TtémoinTmàT=Tm,lematériau:-réagit(sedécompose)-ou se transforme(changement de structure)9:48
7TTmdupicquinousrenseignesurlachaleur(proportionnelleàS)libéréeouabsorbéeparlamatièreaucoursdestransformationsdumatériauEnl'absencedetoutetransformationouréaction,Téchantillonvarieàlamêmevitessequecelledelaréférence:NJ3ƽ0,ĺlesignalresteranul.(lignedebase)9:48échangedelachaleuravecsonenvironnementqueEndo.
7 0Courbe type obtenue par ATD 7TExo 7 ! 0Endo. 7 0Courbe type obtenue par ATD9:48 7TExo.7 ! 0Ondistingue5principalesclassesdetransformationsimpliquantdeschangementsénergétiquesetapparaissantsurlescourbesd'ATD:-fusion/solidification-réactionsàl'étatsolide,-décompositions (généralement endo),-réactions avec un gaz actif (endo. ou exo.)-Polymorphisme/Allotropisme,-transitionvitreuse,"etcLescourbesATDsontinfluencéesparlesmêmesfacteursquiinfluençentlescourbesATG:-Atmosphère(gazetdébit),pulvérulent)-dzdzetc-VitessedechauffagePourcomparerdescourbesATD,Ilestconseillédeseplacersanslesmêmesconditionsexpérimentales:souventpratiquéssimultanément-débit et nature gazeux-vitesse de montée en température,-matériau du creuset (nacelle),"etc9:489:48ATDdelakaoliniteAl2Si2O5(OH)4ou Al2O3, 2SiO2, 2H2OExothermique (sans perte de masse)2(Al2O3,2SiO2)ܽspinelle+siliceHumiditéĺ-H2OաEndothermiqueAl2O3,2SiO2,2H2OܽkaolinitemétakaolinitemAmorphe(DRX)9:48TransitionvitreusePic decristallisationfusionCuSO4, 5H20CuSO4, H20CuSO49:48perte des 4 H20se fait en deux étapesplus sensible quepentahydraté-4 H2O28,8%-H2O7,2%CuSO4C9:48(faux plafond)* Plâtre hydraté = gypse : CaSO4, 2H2ODéshydratation en 2 étapes : -puis -1/2 moleCourbes d'ATD-ATG du plâtre hydraté-80-60-40-2002040608080180280380480580680780880980Température (°C)Flux de chaleur (µV)-20-15-10-505?m (%)mWPic 1Pic 2Pic 3Pic 4ATD du gypse purExovers150°C,unpicendoth.relatifàlapertede3/2molesdeH2OetàlaformationduHemihydrateCaSO412H2O.(plâtre)autour de 220°C, unsecond pic Bendoth.relatif à :* la perte de ½H2Orestante* et la formationLepicCexoth.représenteCaSO4IIICaSO4II9:48(faux plafond)* Plâtre hydraté = gypse : CaSO4, 2H2ODéshydratation en 2 étapes : -puis -1/2 moleCourbes d'ATD-ATG du plâtre hydraté-80-60-40-2002040608080180280380480580680780880980Température (°C)Flux de chaleur (µV)-20-15-10-505?m (%)mWPic 1Pic 2Pic 3Pic 4* Impuretés : CaCO3, CaSO4endoCaCO3CaOexo.AnhydriteCaSO4IIICaSO4IIdestructuresdifférentes(DRX)Courbe d'ATDinfluencés par la nature du gazCaC2O4.H2OAtmosphère:Sous Argon9:48-10010203040506070020040060080010001200% perte de masseT°CCaC2O4,H2O12,31% ȁH2Oա19,16% ȁCOա19,16% ȁCO2ա9:48Courbe d'ATDinfluencés par la nature du gazCaC2O4.H2OAtmosphère:Sous ArgonCaC2O4.H2OCaOCaC2O4.H2Oĺ2O4+ H2OEndoth.CaC2ĺ3+ CO EndothCaCO3ĺCaO+ CO2Endoth9:489:48Atmosphère:Sous une pression oxygèneLeMonoxydedecarboneCOseraoxydépardesuivantlaréaction:(4)CO+ ½ O2ĺ2ExothermiqueRéaction fortement exothermiquela courbe, àLa réaction (4) étant beaucoup plus énergétiqueque la réaction (2).T°C200400600800NiI2Action chimique du gaz sur une réactionVers 220°C: NiI2 +1/2 O2 ĺI2 +NiOExoVers 500°C: NiI2 +1/2 H2 ĺ2 HI+NiEndoExo.O2H2T°CSous N2Sous CO2MgCO3CaCO3MgCO3 ĺMgO+ CO2CaCO3 ĺCaO+ CO2CO2DanslecasdeCaCO3laréactionestdéplacéeverslagaucheExo.etladécompositionnepeutsefairequeparunapportsuppleméntaireuneTdedécompositionplusélevée5006007007008009001000T°C700900Influence de la pression partielle de CO2sur ladécomposition de la dolomite MgCa(CO3)2P.
CO2 = 20 mmHg100 mmHg300 mmHg760 mmHgQuelque soit P ĺLe 1erpic est tjsà la même TMgCa(CO3)2 ĺMgO+ CO2 + CaCO3T°CLorsque la vitesse de chauffe augmenteĺLe pic est plus marquéPlus la vitesse de chauffe augmenteĺLes pics sont décalés vers les hautes TV1 °C/hV2 > V1V3 > V2V4 > V3Courbes d'ATDinfluencées par la vitesse de chauffage9:48T°CdTExoles courbes ATD de la kaolinite avecdifférentes vitesses de chauffe.Tous les phénomènes thermiques (endoet exo)sont décalésvers les hautes températureset ˔lorsque la nitesseaugmente de 3 à 8C3°C/min5°C/min8°C/minKaolinite, Al2O3, 2SiO2, 2H2OMontmorillonite, Al2O3, 4SiO2, H2O. nH2OIllite, KAl2(OH)2, AlSi(O,OH)10Calcaire, CaCO3Chlorite,Mg5( Al, Fe )(OH)8(Al,Si)4O10DéshydroxylationEndo exo100 200 500 1000 °CDéshydratation9:48Hydroxyde OH-ܽCarbonate CO32-ܽOxalate C2O42-ܽSulfate SO42-ܽEau de crisatallisationH2Oܽ9:48T°CdTSous airExo˔(endoet exo)Déshydratation en uneou plusieurs étapesDécompositionde(1)ܽCOա,endoܽ(2)ܽCO2ա,endoܽ(1)(2)9:48T°CdTSous airExoDécomposition de sulfate hydrateDéshydratation en uneH2Oա, endoDécompositiondeܽSO3ա,endoܽ