 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Un ion est un atome ou groupe d'atomes qui a perdu ou gagné un ou plusieurs électrons. Il y a donc des : • Ions positifs appelés CATIONS : Atome ou groupe d'
 Devoir Surveillé n°:3
Devoir Surveillé n°:3
On sait que c'est la proportion d'ion H+ par rapport aux ions OH- qui caractérise le pH de la solution. S'il y a autant d'ions H+ que d'ions OH- alors la
 Fiche dexercices sur les acides bases et pH (fiche n°11)
Fiche dexercices sur les acides bases et pH (fiche n°11)
4) Indique quels sont les ions du pH majoritaires dans ce soda. Exercice 2. Range les éléments suivants du plus acide au plus basique : pH(lait) = 6
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Un ion est un atome ou groupe d'atomes qui a perdu ou gagné un ou plusieurs électrons. Il y a donc des : • Ions positifs appélés CATIONS : Atome ou groupe d'
 Evaluation de chimie n°1 : De latome à lion.
Evaluation de chimie n°1 : De latome à lion.
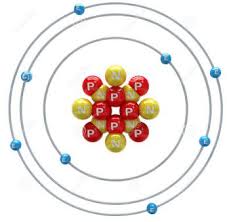
Légendez le schéma de l'atome de carbone suivant. 2. Remplissez le tableau suivant en cochant les réponses correctes : Atome Ion Electron Proton Neutron.
 CORRIGÉ - PHYSIQUE – CHIMIE
CORRIGÉ - PHYSIQUE – CHIMIE
CLASSES DE 3ÈME - DURÉE 1H30. CORRIGÉ - PHYSIQUE – CHIMIE. CALCULATRICES AUTORISÉES Pourquoi ? Il y a des ions chlorure et des ions sodium mais pas d'ions H.
 Test sur les ions classe 3ème A Q.C.M. (6 points):
Test sur les ions classe 3ème A Q.C.M. (6 points):
Test sur les ions classe 3ème A. Q.C.M. (6 points):. Entoure la (ou les) bonnes réponses. 1. Un atome qui a perdu un ou plusieurs électrons est un : a. Ion
 CONTROLE n°1 : CHIMIE
CONTROLE n°1 : CHIMIE
Exercice n° 1 : (3 points). Indique VRAI ou FAUX pour chaque affirmation: 1- Le diamètre d'un atome est égal à celui de son noyau.
 CONTROLE DE CHIMIE SUR LES IONS
CONTROLE DE CHIMIE SUR LES IONS
CONTROLE DE CHIMIE SUR LES IONS. Exercice n°1 : ions à connaître : 4pts. Remplissez le tableau suivant : Exercice n°2 : tests caractéristiques : complétez les
 CONTROLE DE CHIMIE SUR LES IONS
CONTROLE DE CHIMIE SUR LES IONS
CONTROLE DE CHIMIE SUR LES IONS. Exercice n°1 : ions à connaître : Ion. Symbole de l'atome dont l'ion est issu. Nombre d'électrons perdus ou.
 CONTROLE n°1 : CHIMIE
CONTROLE n°1 : CHIMIE
Exercice n° 1 : (3 points). Indique VRAI ou FAUX pour chaque affirmation: 1- Le diamètre d'un atome est égal à celui de son noyau.
 CH.4 IDENTIFICATION DIONS – évaluation
CH.4 IDENTIFICATION DIONS – évaluation
Je sais que l'ion qui forme un précipité orange avec la soude est l'ion fer III CH.4 IDENTIFICATION D'IONS – évaluation. Ra / 4 Ré / 2. Ion. Chlorure.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Un ion est un atome ou groupe d'atomes qui a perdu ou gagné un ou plusieurs électrons. Il y a donc des : • Ions positifs appélés CATIONS : Atome ou groupe d'
 Évaluation du troisième plan national Santé-Environnement
Évaluation du troisième plan national Santé-Environnement
31 déc. 2018 Elle porte sur l'évaluation du troisième plan santé environnement (PNSE 3) qui couvre ... ions. GT1: Santé et biodiversité.
 Niveau : 3ème
Niveau : 3ème
b) Tests de reconnaissance des ions chlorure et des ions métalliques. Le professeur remplit une grille d'évaluation du TP et des exercices diagnostiques ...
 Correction CONTROLE BILAN 3 sujet B
Correction CONTROLE BILAN 3 sujet B
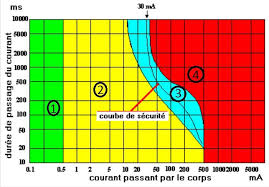
6- Un CATION est un ion positif c'est donc un atome qui a perdu des électrons. 7- Ce sont les ions responsables du passage du courant dans les solutions.
 Fiche dexercices sur les acides bases et pH (fiche n°11)
Fiche dexercices sur les acides bases et pH (fiche n°11)
4) Indique quels sont les ions du pH majoritaires dans ce soda. Exercice 2. Range les éléments suivants du plus acide au plus basique : pH(lait) = 672.
 EXERCICE DE REMÉDIATION - CHIMIE - 3ÈME 3C3.D1.I4.1.CH9
EXERCICE DE REMÉDIATION - CHIMIE - 3ÈME 3C3.D1.I4.1.CH9
Le test au nitrate d'argent permet d'identifier l'ion chlorure : il apparaît un précipité blanc. Le test à la soude permet d'identifier les ions cuivre II
 DS Chapitre I et II Chimie
DS Chapitre I et II Chimie
3ème …… NOM - Prénom : DEVOIR DE SCIENCES PHYSIQUES – ATOMES ET IONS. Vous devez rédiger chacune de vos réponses sans faute d'orthographe.
SUJET A - CORRECTION
Aide pour les exercices 1 et 2 :
Le professeur a donné à Gertrude une solution inconnue X, deux tubes à essai, de la soude (Na+ HO-)
et du nitrate d'argent (Ag + NO3). Elle réalise des expériences et obtient les résultats suivants : Un précipité orange dans le tube où elle a versé la solution X et la soude,Un précipité blanc qui noircit à la lumière où elle a versé la solution X et le nitrate d'argent.
a) Quel est l'ion positif contenu dans la solution ? Justifier. I / 2
Je sais que l"ion qui forme un précipité orange avec la soude est l"ion fer III, Fe3+. J"en déduis qu"il y a des
ions fer III dans la solution X.b) Quel est l'autre ion contenu dans la solution ? Justifier I / 2
Je sais que l"ion qui forme un précipité blanc qui noircit à la lumière avec le nitrate d"argent est l"ion
Chlorure Cl
- . J"en déduis qu"il y a des ions Chlorure Cl- dans la solution X. c) Trouvez le nom de la solution X : c'est du chlorure de fer III. Ra / 1Jean-Edouard a devant lui deux tubes à essai : l'un contient du chlorure d'aluminium et l'autre du
chlorure de fer II. Schématiser et légender les expériences qu'il doit réaliser pour distinguer ces deux
solutions ainsi que ses observations.CH.4 IDENTIFICATION D'IONS - évaluation
Ra / 4 Ré / 2
Ion Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn 2+Aluminium
Al3+Réactif
Solution de nitrate
d"argent (Ag+ et NO3)Précipité
Hydroxyde de sodium (soude)
(Na+ HO-) Blanc qui noircit à la lumière Blanc Blanc Bleu Vert Orangé SoudeSolution
à tester
Je sais que la soude forme un précipité blanc avec les ions aluminium et un précipité vert avec les ions fer II. Si Jean-Edouard observe un précipité blanc, il pourra conclure qu'il y a des ions aluminium dans la solution testée ; ce sera donc la solution de chlorure d'aluminium. S'il observe un précipité vert, il pourra conclure qu'il y a des ions fer II dans la solution testée ; ce sera donc la solution de chlorure de fer II. Il est inutile de réaliser le test au nitrate d'argent puisque dans les deux solutions il y a des ions chlorure ; dans les deux cas, il se formera un précipité blanc qui ne nous permettra pas de différencier les deux solutions. Aide pour les exercices 3 et 4 :On veut déterminer le pH de l'eau de Javel. On sait que lorsque l'on verse quelques gouttes de
phénolphtaléine dans une solution d'eau de Javel, cette dernière prend une couleur fushia.a) Quelle information pouvez-vous en déduire à propos de son pH ? Justifiez ? I / 1
D'après le tableau ci-dessus, je sais que la phénolphtaléine vire au fushia lorsque le pH de la
solution testée est supérieur à 10. J'en déduis que le pH de l'eau de Javel est supérieur à 10.
b) Cette solution est-elle acide, basique ou neutre ? Justifiez ? MCo / 2
Je sais qu'une solution est basique lorsque son pH est supérieur à 7 ; j'en déduis que l'eau de
javel qui a un pH supérieur à 10 est une solution basique.c) Que faudrait-il utiliser pour déterminer précisément la valeur du pH ? MCo / 1
Pour plus de précision, il faudrait utiliser un pH-mètre.On veut déterminer le pH l'eau de Perrier. On sait que lorsque l'on verse quelques gouttes de vert de
bromocrésol dans cette eau de Perrier, elle prend une couleur bleue et que l'on y verse
quelques gouttes de rouge de phénol , elle prend alors une couleur jaune. a) Quelle information pouvez-vous en déduire à propos de son pH ? Justifiez ? Ra / 3D'après le tableau ci-dessus, je sais que le vert de bromocrésol vire au bleu lorsque le pH de la
solution testée est supérieur à 5,4. J'en déduis que le pH de l'eau Perrier est supérieur à 5,4.
D'après le tableau ci-dessus, je sais que le rouge de phénol vire au jaune lorsque le pH de lasolution testée est inférieur à 6,8. J'en déduis que le pH de l'eau Perrier est inférieur à 6,8.
D'après ces deux observations, j'en déduis que le pH de l'eau de Perrier est compris entre 5,4 et 6,8.b) Cette solution est-elle acide, basique ou neutre ? MCo / 0,5
Je sais qu'une solution est acide lorsque son pH est inférieur à 7 ; j'en déduis que l'eau de
Perrier qui a un pH inférieur à 6,8 est une solution acide. Le pH d'un jus de pomme vaut 4,2. On y ajoute une grande quantité d'eau pour le diluer. a)Comment va évoluer son pH ? MCo / 1,5
Lorsqu'on dilue une solution, son pH se rapproche de 7 ; le pH du jus de pomme va donc augmenter. b) Question bonus : si on verse quelques gouttes de bleu de bromothymol dans le jus avant et après dilution, comment va évoluer la couleur de l'indicateur coloré.Ra / 2
D'après le tableau ci-dessus, je sais que le bleu de bromothymol vire au jaune lorsque le pH dela solution testée est inférieur à 6. Le pH du jus de pomme est de 4.2 avant la dilution; j'en
déduis que le bleu de bromothymol sera jaune. Après une grande dilution, le pH du jus de pomme sera de 7 ce qui correspond à la zone de virage du bleu de bromothymol qui sera alors entre le bleu et le jaune c'est-à-dire vert. Indicateur coloré Couleur Intervalle de pH de la zone de virage CouleurHélianthine rouge 3,10 - 4,40 jaune
Vert de bromocrésol jaune 3,80 - 5,40 bleu
Bleu de bromothymol jaune 6,00 - 7,60 bleu
Rouge de phénol jaune 6,80 - 8,40 rouge
Phénolphtaléine incolore 8,30 - 10,00 fuchsiaSUJET B - CORRECTION
Aide pour les exercices 1 et 2 :
Le professeur a donné à Berthe une solution inconnue Y, deux tubes à essai, de la soude (Na+
HO - ) et du nitrate d'argent (Ag+ NO3). Elle réalise des expériences et obtient les résultats suivants : Un précipité vert dans le tube où elle a versé la solution Y et la soude,Un précipité blanc qui noircit à la lumière où elle a versé la solution Y et le nitrate d'argent.
a)Quel est l'ion négatif contenu dans la solution ? Justifier. I / 2
Je sais que l"ion qui forme un précipité blanc qui noircit à la lumière avec le nitrate d"argent est
l"ion Chlorure Cl - . J"en déduis qu"il y a des ions Chlorure Cl- dans la solution Y.b) Quel est l'autre ion contenu dans la solution ? Justifier I / 2
Je sais que l"ion qui forme un précipité vert avec la soude est l"ion fer II, Fe2+. J"en déduis qu"il y a
des ions fer II dans la solution Y. c) Trouvez le nom de la solution Y : c'est du chlorure de fer II. Ra / 1Alfred a devant lui deux tubes à essai : l'un contient du chlorure de cuivre et l'autre du
chlorure de fer III. Schématiser et légender les expériences qu'il doit réaliser pour différencier
ces deux solutions ainsi que ses observations.Ra / 4 Ré / 2
CH.4 IDENTIFICATION D'IONS - évaluation
Ion Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn 2+Aluminium
Al3+Réactif
Solution de nitrate
d"argent (Ag+ et NO3)Précipité
Hydroxyde de sodium (soude)
(Na+ HO-) Blanc qui noircit à la lumière Blanc Blanc Bleu Vert Orangé SoudeSolution
à tester
Je sais que la soude forme un précipité bleu avec les ions cuivre et un précipité orange avec les ions fer III. Si Alfred observe un précipité bleu, il pourra conclure qu'il y a des ions cuivre dans la solution testée ; ce sera donc la solution de chlorure de cuivre. S'il observe un précipité orange, il pourra conclure qu'il y a des ions fer III dans la solution testée ; ce sera donc la solution de chlorure de fer III. Il est inutile de réaliser le test au nitrate d'argent puisque dans les deux solutions il y a des ions chlorure ; dans les deux cas, il se formera un précipité blanc qui ne nous permettra pas de différencier les deux solutions.Aide pour les exercices 3 et 4 :
On veut déterminer le pH du Schweppes. On sait que lorsque l'on verse quelques gouttes d'Héliantine
dans du Schweppes, cette dernière prend une couleur rouge.a) Quelle information pouvez-vous en déduire à propos de son pH ? Justifiez ? I / 1
D'après le tableau ci-dessus, je sais que l'hélianthine vire au rouge lorsque le pH de lasolution testée est inférieur à 3,1. J'en déduis que le pH du Schweppes est inférieur à 3,1.
b) Cette solution est-elle acide, basique ou neutre ? Justifiez ? MCo / 2
Je sais qu'une solution est acide lorsque son pH est inférieur à 7 ; j'en déduis que le
Schweppes qui a un pH inférieur à 3,1 est une solution acide. c) On veut connaître précisément la valeur du pH du Schweppes ; de quoi avons-nous besoin pour y parvenir ?MCo / 2
Pour plus de précision, il faudrait utiliser un pH-mètre. On veut déterminer le pH de l'eau de mer. On sait que lorsque l'on verse quelques gouttes de rouge phénol dans cette eau de mer, elle prend une couleur rouge et que l'on y verse quelques gouttes de thymolphtaléine , elle reste incolore.a) Quelle information pouvez-vous en déduire à propos de son pH ? Justifiez ? Ra / 3
D'après le tableau ci-dessus, je sais que le rouge de phénol vire au rouge lorsque le pH de lasolution testée est supérieur à 8,4. J'en déduis que le pH de l'eau de mer est supérieur à 8,4.
D'après le tableau ci-dessus, je sais que le thymolphtaleine devient incolore lorsque le pHde la solution testée est inférieur 9,4. J'en déduis que le pH de l'eau de mer est inférieur à
9,4. D'après ces deux observations, j'en déduis que le pH de l'eau de mer est compris entre 8,4 et 9,4.c) Cette solution est-elle acide, basique ou neutre ? MCo / 0,5
Je sais qu'une solution est basique lorsque son pH est supérieur à 7 ; j'en déduis que l'eau
de mer qui a un pH supérieur à 8,4 est une solution basique. Le pH d'un détergent vaut 9,1. On y ajoute une grande quantité d'eau pour le diluer.a) Comment va évoluer son pH ? Mco / 1,5
Lorsqu'on dilue une solution, son pH se rapproche de 7 ; le pH du détergent va donc
diminuer. b) Question bonus : si on verse quelques gouttes de bleu de bromothymol dans le détergent avant et après dilution, comment va évoluer la couleur de l'indicateur coloré.Ra / 2
D'après le tableau ci-dessus, je sais que le bleu de bromothymol vire au bleu lorsque le pHde la solution testée est supérieur 7,6. Le pH du détergent est de 9,1 avant la dilution; j'en
déduis que le bleu de bromothymol sera bleu. Après une grande dilution, le pH du détergent sera de 7 ce qui correspond à la zone de virage du bleu de bromothymol qui sera alors entre le bleu et le jaune c'est-à-dire vert. Indicateur coloré Couleur Intervalle de pH de la zone de virage CouleurHélianthine rouge 3,10 - 4,40 jaune
Vert de bromocrésol jaune 3,80 - 5,40 bleu
Bleu de bromothymol jaune 6,00 - 7,60 bleu
Rouge de phénol jaune 6,80 - 8,40 rouge
Thymolphtaléine incolore 9,40 - 10,60 bleu
quotesdbs_dbs13.pdfusesText_19[PDF] controle svt 1ere s cycle cellulaire
[PDF] controle svt 1ere s procréation
[PDF] controle svt 1ere s replication de l'adn
[PDF] controle svt 3eme caryotype
[PDF] controle svt 3eme defense de l'organisme
[PDF] controle svt 3eme diversite unite etres humains
[PDF] controle svt 3eme division cellulaire
[PDF] controle svt 3eme immunologie
[PDF] controle svt 3eme l'information génétique
[PDF] controle svt 3eme micro organisme
[PDF] controle svt 3eme systeme immunitaire
[PDF] controle svt 4eme plaques lithosphériques
[PDF] controle svt 4eme seisme
[PDF] controle svt 5eme fonctionnement de l'organisme et besoin en energie pdf

