 Tableau périodique de Mendeleı̈ev
Tableau périodique de Mendeleı̈ev
Plus l'électron est éloigné du noyau plus il est facile de l'arracher (première énergie d'ionisation diminue). Page 2. Evolution de l'électronégativité dans le
 lélectronégativité
lélectronégativité
Le localiser dans le tableau périodique. Combien possède-t-il d'électrons de Sens d'évolution de l'électronégativité dans la classification périodique : ...
 ANNEXE POTENTIEL ET POUVOIR OXYDANT ECHELLE DE
ANNEXE POTENTIEL ET POUVOIR OXYDANT ECHELLE DE
Evolution de l'électronégativité dans le tableau périodique des éléments. La colonne située la plus à droite colonne 8
 Chap. V : Propriétés physiques et chimiques et tableau périodique
Chap. V : Propriétés physiques et chimiques et tableau périodique
Plus la différence d'électronégativité entre 2 atomes est grande plus le nuage électronique qui relie les 2 atomes est déformé… plus la liaison est dite
 3_Atomes et molécules
3_Atomes et molécules
Document 4 : Évolution de l'électronégativité dans le tableau Schématiser les cinq premières lignes du tableau périodique sous la forme d'un tableau vierge.
 Architecture de la matière
Architecture de la matière
DEFINITION ET EVOLUTION DE L'ELECTRONEGATIVITE NOTEE χ. 26 α -‐ définition. 26 β -‐ l III UTILISATION DE LA CLASSIFICATION PERIODIQUE : EVOLUTION DE QUELQUES.
 Untitled
Untitled
tableau périodique celui-ci rendant bien compte de l'évolution de la structure des Variation de l'électronégativité dans le tableau périodique: L ...
 lélectronégativité
lélectronégativité
Illustration de l'évolution des propriétés chimiques des éléments de la classification périodique. Cette séance a pour objectifs : d'observer différents corps
 LES ELEMENTS DU GROUPE 13
LES ELEMENTS DU GROUPE 13
remarque une évolution anormale (voir tableau ci-dessus). Cette évolution s Electronégativité : l'évolution de l'électronégativité dans le groupe est ...
 Tableau périodique de Mendele??ev
Tableau périodique de Mendele??ev
Plus l'électron est éloigné du noyau plus il est facile de l'arracher (première énergie d'ionisation diminue). Page 2. Evolution de l'électronégativité dans le
 lélectronégativité
lélectronégativité
Illustration de l'évolution des propriétés chimiques des éléments de la classification périodique. Éléments de correction. Une grandeur centrale en chimie :.
 ANNEXE POTENTIEL ET POUVOIR OXYDANT ECHELLE DE
ANNEXE POTENTIEL ET POUVOIR OXYDANT ECHELLE DE
Rien qu'en observant attentivement la classification périodique on peut tirer Evolution de l'électronégativité dans le tableau périodique des éléments.
 Architecture de la matière
Architecture de la matière
A. DEFINITION ET EVOLUTION DE L'ELECTRONEGATIVITE NOTEE ?. éléments chimiques tous regroupés dans un tableau périodique parfaitement ordonné.
 TP-cours n° : Périodicité des propriétés physico-chimique des
TP-cours n° : Périodicité des propriétés physico-chimique des
But : Étudier l'évolution de plusieurs propriétés dans le tableau périodique. Durée : h. Introduction : l'électronégativité. L' électronégativité d'un
 Untitled
Untitled
tableau périodique celui-ci rendant bien compte de l'évolution de la L'électronégativité ? d'un élément est la grandeur représentant la capacité.
 CH.CI.2:L
CH.CI.2:L
Historiquement le tableau périodique a été créé de manière à mettre en la notion d'électronégativité
 lélectronégativité
lélectronégativité
Illustration de l'évolution des propriétés chimiques des éléments de la classification périodique. Cette séance a pour objectifs : d'observer différents corps
 Architecture de la matière
Architecture de la matière
A. DEFINITION ET EVOLUTION DE L'ELECTRONEGATIVITE NOTEE ?. éléments chimiques tous regroupés dans un tableau périodique parfaitement ordonné.
 Illustration de lévolution des propriétés chimiques des éléments de
Illustration de lévolution des propriétés chimiques des éléments de
Comparer l'électronégativité de deux éléments selon leur position dans le tableau périodique. Interpréter l'évolution du rayon atomique dans la
 Tableau périodique de Mendele??ev - sorbonne-universitefr
Tableau périodique de Mendele??ev - sorbonne-universitefr
Evolution de l’électronégativité dans le tableau L’électronégativité notée traduit la capacité d'un élément à attirer les électrons lors de la formation d'une liaison chimique avec un autre élément Elle est Il existe plusieurs définitions et par conséquent plusieurs échelles
 Tableau périodique imprimable des éléments - Électronégativité
Tableau périodique imprimable des éléments - Électronégativité
Tableau périodique des éléments Numéro atomique Principaux nombres d’oxydation (le plus fréquent en gras) Configuration électronique (en rouge : exception à la règle de Klechkowski) Masse atomique basée sur 12C Électronégativité (échelle de Pauling) [ ] : nombre de masse de l’isotope le plus stable *
 Le tableau périodique - University of Ottawa
Le tableau périodique - University of Ottawa
Le développement du tableau périodique • à l’époque de Mendeleïev on n’avait même pas encore découvert l’électron • Mendeleïev était convaincu que les propriétés des éléments avaient une périodicité si l’on classait les éléments en ordre de masse atomique croissant
 Searches related to evolution de l+electronegativité dans le tableau periodique PDF
Searches related to evolution de l+electronegativité dans le tableau periodique PDF
Le tableau périodique a connu de nombreux réajustements depuis lors jusqu'à prendre la forme que nous connaissons aujourd'hui et est devenu un référentiel universel auquel peuvent être rapportés tous les types de comportement physique et chimique des éléments
Comment télécharger un tableau périodique avec l'électronégativité indiquée ?
Ce tableau périodique avec l'électronégativité indiquée peut être téléchargé au format PDF ici . Le format PDF nécessite Adobe Acrobat Reader, qui peut être téléchargé gratuitement. L'électronégativité est utilisée pour prédire si deux atomes formeront des liaisons ioniques ou covalentes .
Qu'est-ce que la classification périodique des éléments?
La classification périodique des éléments • chaque colonne (groupe) du tableau périodique moderne partage la même configuration électronique pour ses électrons de valence • il y a quelques exceptions pour les métaux de transition, les lanthanides, et les actinides La classification périodique des éléments
Qu'est-ce que le tableau périodique des couleurs ?
Ce tableau périodique des couleurs indique le symbole, le numéro atomique et l'électronégativité de chaque élément. Ce tableau périodique avec l'électronégativité indiquée peut être téléchargé au format PDF ici . Le format PDF nécessite Adobe Acrobat Reader, qui peut être téléchargé gratuitement.
Quels sont les éléments de l’électronégativité de Pauling ?
Valeurs de l’électronégativité de Pauling des éléments des blocs s-, p-, d- et f-. Les valeurs pour la plupart des actinides sont approximatives. Les éléments pour lesquels aucune donnée n’est disponible sont représentés en gris. Source : Données tirées de L. Pauling, The Nature of the Chemical Bond, 3e éd. (1960). Figure 8.7.10.
CI. : Structure de la matière Chapitre 2 : La classification périodique Sonia Najid ʹ Lycée Corneille MPSI 2018-2019 1
CH. CI.2 : LA CLASSIFICATION PERIODIQUE
Historiquement, le tableau périodique a été créé de manière à mettre en évidence la périodicité des propriétés de la
Nous allons dans ce chapitre montrer le lien entre la structure de cette classification périodique et les configurations
périodique ainsi que le lien avec le caractère oxydant ou réducteur de différents corps simples.
I) STRUCTURE DE LA CLASSIFICATION PERIODIQUE A 18 COLONNESA) Principe
Classement des éléments connus (118) dans le tableau périodique : de gauche à droite / numéro
atomique Z croissant, avec 7 lignes ou périodes et 18 colonnes demanière à placer dans la même colonne des éléments de propriétés physico-chimiques voisines, et rendant compte de la
structure électronique fondamentale des éléments.CI. : Structure de la matière Chapitre 2 : La classification périodique Sonia Najid ʹ Lycée Corneille MPSI 2018-2019 2
B) Lignes (ou périodes)
1) Définition et caractéristiques
quantique n dans leur couche de valence.Les différentes lignes ou périodes identifiées par leur rang n ont les caractéristiques suivantes, tenant compte des règles
de Klechkowski (on commence la période n en remplissant la sous couche ns puis éventuellement les sous-couches (n-2)f et (n-1)d et
on la termine en remplissant la sous-couche np). Rang de la ligne (ou période) 1er 2e 3e 4e 5e 6e 7e Sous-couches disponibles 1s 2s, 2p 3s, 3p 4s, 3d, 4p 5s, 4d, 5p 6s, 4f, 5d, 6p 7s, 5f, 6d, 7p Couches : désignées par leur nombre quantique principal, autrefois symbolisée par des lettres. n 1 2 3 4Symbole des couches K L M N
2) Ecriture de la configuration électronique à partir de Z = 19 (4ème ligne)
gaz rare de la période (n-1). des électrons de valence. n = 2 : 8 éléments. n = 3 : 8 éléments.Na Mg Al Si P S Cl Ar
1s22s22p63s1 [Ne]3s2 [Ne]3s23p1 [Ne]3s23p2 [Ne]3s23p3 [Ne]3s23p4 [Ne]3s23p5 [Ne]3s23p6
n = 4 : 18 éléments.C) Colonnes
les mêmes propriétés physico-chimiques.Colonne 1 2 16 17 18
Nom de la famille Alcalins Alcalinoterreux Chalcogènes Halogènes Gaz nobles Exemple : Famille des halogènes : F : [He]2s22p5Cl : [Ne]3s23p5
Br : [Ar]3d104s24p5
I : [Kr]4d105s25p5
Li Be B C N O F Ne
1s22s1 1s22s2 1s22s22p1 1s22s22p2 1s22s22p3 1s22s22p4 1s22s22p5 1s22s22p6
Chapitre CI.2 : Classification périodique des éléments S.N. MPSI 2018-2019 3couche de valence lui confère des propriétés similaires à celles des éléments de la 18ème colonne.
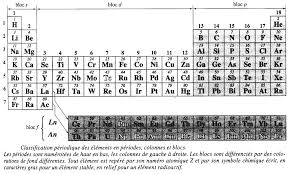
D) Organisation en blocs de la classification périodiqueBlocs : éléments de colonnes voisines manifestant des propriétés voisines (caractères réducteur et métallique prononcé
couche en cours de remplissage pour leurs e- de valence.Remarque : Pour des raisons pratiques, la classification actuelle ne comporte que 18 colonnes : les lanthanides (bloc
4f) et les actinides (bloc 5f) sont regroupés dans un tableau annexe au bas de la classification périodique (cf ci-dessous)2.
II) ELECTRONEGATIVITE
A) Présentation et évolution
1) Définition
Remarques :
sous forme monoatomique. Elément le plus électronégatif de la classification périodique : Fluor. Il existe des diagonales " iso-électronégativité » dans le tableau.dû " commencer » les blocs 5d et 6d ; La et Ac sont placés dans la colonne 3 afin de respecter la cohérence du classement en colonnes
Bloc s (2
colonnes)Bloc d (10 colonnes)
Bloc p (6 colonnes)
Bloc f (14 colonnes)
Chapitre CI.2 : Classification périodique des éléments S.N. MPSI 2018-2019 4Diagonale = 2,1 (cf. tableau ci-dessous) : limite entre les métaux et les non-métaux, correspondant aux métalloïdes,
généralement semi-conducteurs.B) Métaux et non métaux
a) MétalLes métaux occupent une place prépondérante (environ 80%) parmi les éléments chimiques existants).
Caractéristiques macroscopiques :
Pouvoir réflecteur élevé : " éclat » métallique Bon conducteur thermique et électrique ; la résistivité augmente avec la température. Propriétés mécaniques : malléabilité ; ductilitéSolide à température ordinaire à part le mercure. Ces propriétés sont liées à la structure des atomes.
Réducteur : Ils peuvent tous donner un oxyde en se combinant avec de l'oxygène (exemple : l'oxydation du fer produit la rouille
Fe2O3) ; quand ils sont solubles, les oxydes métalliques forment des solutions basiques. Ils réagissent avec les acides (gravure sur cuivre) b) Non métalCaractéristiques macroscopiques :
Isolant
Souvent liquide ou gazeux à température ordinaire.Ils se comportent comme des oxydants au cours des réactions chimiques en captant des électrons.
Ils ne réagissent pas avec les acides.
2) Définition et propriétés microscopiques
a) Non métalCaractéristiques électroniques
Non-métal : possède de nombreux électrons de valence et est électronégatif ; a tendance à en gagner pour saturer sa
b) MétalMétal : Alcalins et alcalino-terreux ; métaux de transition (y compris la dernière colonne du bloc d) ; certains éléments
du début du bloc p (métaux du bloc p : ex : Al). Chapitre CI.2 : Classification périodique des éléments S.N. MPSI 2018-2019 5Caractéristiques électroniques
pour donner un cation et former des liaisons ioniques avec des non-métaux, et il est électropositif ( faible).
Interprétation des propriétés macroscopiques : Les atomes du métal se dépouillent de leurs électrons pour donner des
c) Evolution du caractère métallique ů'électronégativité qui croît en diagonale). conductivité faible augmentant avec la température.C) Caractère oxydant ou réducteur
Exemple : Cu2++ 2e- = Cu.
Exemple : Fe = Fe2++ 2e-.
Composés électronégatifs (halogènes et chalcogènes) : comportement oxydant (formation de F-, O2-, etc.)
Composés électropositifs (alcalins, alcalino-terreux et métaux en général) : comportement réducteur (formation de Na+,
Mg2+, etc.).
Le caractère réducteur des alcalins et des alcalinoterreux augmente quand on descend la colonne (et que ࣑ diminue) ;
Pour une même ligne, les alcalinoterreux réagissent moins violemment que les alcalins.Le caractère oxydant du corps pur X2 diminue quand on descend la colonne : plus un halogène est électronégatif, plus
le dihalogène correspondant est oxydant. il est électronégatif et plus il lui est facile de perdre un électron). Chapitre CI.2 : Classification périodique des éléments S.N. MPSI 2018-2019 6quotesdbs_dbs35.pdfusesText_40[PDF] effondrement jeu de paume beauvais
[PDF] rayon ionique tableau périodique
[PDF] questionnaire sur le sommeil des étudiants
[PDF] énergie de première ionisation calcul
[PDF] l'ancien régime et la révolution résumé
[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale