Chapitre 1 : Atomistique
Chapitre 1 : Atomistique
La chimie est la science de la matière et de sa transformation. Au cours de ce chapitre nous étudierons les « briques élémentaires » de la matière : les atomes.
 COURS DE CHIMIE ATOMISTIQUE
COURS DE CHIMIE ATOMISTIQUE
Celle-ci est caractérisée par sa masse et son énergie qui mesure sa capacité à produire du travail. I-1 Structure de la matière. La matière est formée à partir
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
4 orbitales moléculaires (liaisons chimiques) de type σ entre
 SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
[1] J. Mesplède J.-L. Queyrel
 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
carbone. ➢ Unité de masse atomique : uma. Par définitionl'uma est le 1/12 de la masse d'un atome de carbone 12
 COURS DE CHIMIE ATOMISTIQUE
COURS DE CHIMIE ATOMISTIQUE
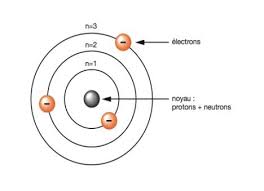
masse qui contient Z protons et (A-Z) neutrons et de Z e- qui assurent la neutralité de l'atome. Comment se situe les e- par rapport à ce noyau ? III-1
 COURS Atomistique 1er Semestre
COURS Atomistique 1er Semestre
CHAPITRE STRUCTURE DE L'ATOME. I.1 Historique. • Découvert il y'a 2500 ans par les Grecs. • « Atomos » = indivisible. • Expériences menées entre 1875 – 1910
 COURS DATOMISTIQUE
COURS DATOMISTIQUE
Conclusion : Toute la masse de l'atome est concentrée dans le noyau. III- IDENTIFICATION DES ELEMENTS. 1- Représentation. A chaque élément chimique on a
 Cours dAtomistique
Cours dAtomistique
- Chimie Générale Cours 1 – Atomistique : Structure de l'atome (1/2)
 Chapitre 1 : Atomistique
Chapitre 1 : Atomistique
La chimie est la science de la matière et de sa transformation. Au cours de ce chapitre nous étudierons les « briques élémentaires » de la matière : les atomes.
 Chapitre 1 : Atomistique
Chapitre 1 : Atomistique
La chimie est la science de la matière et de sa transformation. Au cours de ce chapitre nous étudierons les « briques élémentaires » de la matière : les atomes.
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
1. Chapitre 1: Structure de l'atome ; Constituants de la matière. Avant propos: Ce cours de Structure de l'atome Constituants de la matière est.
 COURS Atomistique 1er Semestre
COURS Atomistique 1er Semestre
CHAPITRE STRUCTURE DE L'ATOME. I.1 Historique. • Découvert il y'a 2500 ans par les Grecs. • « Atomos » = indivisible. • Expériences menées entre 1875 – 1910
 SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
[1] J. Mesplède J.-L. Queyrel
 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
COURS. ATOMISTIQUE/LIAISON CHIMIQUE. Réalisé par : Pr. Hamid MAGHAT Par définitionl'uma est le 1/12 de la masse d'un atome de carbone 12 (.
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
4 orbitales moléculaires (liaisons chimiques) de type ? entre
 COURS DATOMISTIQUE
COURS DATOMISTIQUE
Conclusion : Toute la masse de l'atome est concentrée dans le noyau. III- IDENTIFICATION DES ELEMENTS. 1- Représentation. A chaque élément chimique on a
 COURS DE CHIMIE N°1 ATOMISTIQUE ET LIAISON CHIMIQUE L
COURS DE CHIMIE N°1 ATOMISTIQUE ET LIAISON CHIMIQUE L
Définition : 1 uma = m12c / 12. 1 mole d'atome de l'isotope de 12C = 12000000 g. La masse d'un atome de C est donnée par mC = 12/N g avec N=6
 COURS DE CHIMIE N°1 ATOMISTIQUE ET LIAISON CHIMIQUE L
COURS DE CHIMIE N°1 ATOMISTIQUE ET LIAISON CHIMIQUE L
Définition : 1 uma = m12c / 12. 1 mole d'atome de l'isotope de 12C = 12000000 g. La masse d'un atome de C est donnée par mC = 12/N g avec N=6
UNIVERSIT MENTOURI 1 INSTITUT DES SCIENCES VTRINAIRES DPARTEMENT PRCLINIC CHIMIE 2018-2019 Dr Chahra BOUCHAMENI P MENHANE $���123 45���$-/6/,'-/%$#5���7#*+*8���$-7#1.3.1 Reprsentation A chaque lment chimique, on a associ un symbole. Il s'crit toujours avec une majuscule, ventuellement suivie d'une minuscule : Z est appel numro atomique ou nombre de charge, il dsigne le nombre de protons (c'est aussi le nombre d'lectrons pour un atome neutre). Pour un lment quelconque, la charge du noyau (protons) est +Ze. De mme la charge des lectrons sera -Ze. A est appel nombre de masse, il dsigne le nombre de nuclons (protons + neutrons). Si N reprsente le nombre de neutrons, on aura la relation : A = Z + N 1.3.2 Isotopes Ce sont des atomes de mme numro atomique Z et de nombre de masse A diffrent. Un lment peut avoir un ou plusieurs isotopes. Il n'est pas possible de les sparer par des ractions chimiques, par contre cela peut tre ralis en utilisant des techniques physiques notamment la spectroscopie de masse.
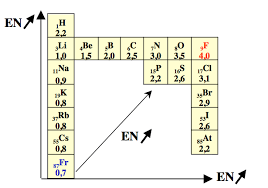
UNIVERSIT MENTOURI 1 INSTITUT DES SCIENCES VTRINAIRES DPARTEMENT PRCLINIC CHIMIE 2018-2019 Dr Chahra BOUCHAMENI P MENHANE #+���6.2 P.%A./*-*7#5���7#*+*8���$-7 6.2.1 Rayon atomique ra On peut dfinir le rayon atomique comme tant la moiti de la distance entre les centres des deux atomes lis par une liaison simple. ¥ Sur une priode : si Z augmente alors ra diminue ¥ Sur une colonne : si Z augmente alors ra augmente 6.2.2 Electrongativit (���) LÕlectrongativit : c'est le pouvoir d'attirer un lectron par un lment. Un lment qui perd facilement un ou plusieurs lectrons est dit lectropositif. ¥ Sur une mme priode : si Z augmente alors ��� augmente ¥ Sur un mme groupe : si Z augmente alors ��� diminue 6.2.3 Valence C'est la capacit de chaque atome former une liaison. Sa valeur est gale au nombre d'lectrons non apparis (clibataires).
quotesdbs_dbs50.pdfusesText_50[PDF] cours audiovisuel gratuit pdf
[PDF] cours audit des systèmes d'information pdf
[PDF] cours audit et controle de gestion pdf
[PDF] cours audit externe pdf
[PDF] cours audit interne pdf
[PDF] cours autocad 2010 pdf gratuit
[PDF] cours autocad 2013 francais pdf
[PDF] cours autocad 2014 pdf
[PDF] cours autocad 2015 pdf
[PDF] cours autocad 3d pdf gratuit
[PDF] cours autocad pdf gratuit télécharger
[PDF] cours automatique asservissement
[PDF] cours automatique et informatique industrielle pdf
[PDF] cours automatique linéaire pdf