 Titrage avec suivi colorimétrique
Titrage avec suivi colorimétrique
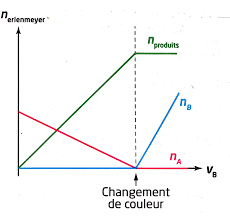
L'équation support de la réaction du dosage est du type : aA aq. ( )+ bB aq Un changement de couleur de la solution contenue dans l'erlenmeyer est observé d' ...
 Pas à pas Réaliser un dosage colorimétrique en 8 étapes
Pas à pas Réaliser un dosage colorimétrique en 8 étapes
Si c'est le cas diminuez la vitesse d'agitation et/ou déplacez le bécher sur l'agitateur. En théorie
 Les dosages par titrage colorimétrique
Les dosages par titrage colorimétrique
Les dosages par titrage colorimétrique. 1/ Le principe du dosage par titrage. ➔ On cherche à déterminer la concentration (ou la quantité de matière) d'une
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Interpréter qualitativement un changement de pente dans un titrage conductimétrique. Les sujets sur les titrages se prêtent à des questions sur la précision des
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Dans un titrage conductimétrique la valeur de la conductance est relevée pour chaque mL du réactif dosages. Exemple : Solution de permanganate de potassium.
 Réalisation dun dosage colorimétrique
Réalisation dun dosage colorimétrique
Verser rapidement la solution titrante jusqu'au changement de couleur. Noter le volume V versé. Recommencer le titrage depuis le début.
 nom : ts - chimie 6 tp dosage colorimetrique
nom : ts - chimie 6 tp dosage colorimetrique
de dosage un erlenmeyer. Page 2. Contrôle de la qualité par dosage – titrage de la Bétadine®. On souhaite doser (= connaître la concentration) le diiode I2(aq)
 Chapitre 5 : Dosage par titrage
Chapitre 5 : Dosage par titrage
Elle s'exprime en siemens (S). La figure 5.1 présente le schéma d'une cellule conductimétrique. Conductance d'une solution. La conductance G
 TP 7 : Titrage de leau oxygénée par dosage colorimétrique
TP 7 : Titrage de leau oxygénée par dosage colorimétrique
Chapitre 4 : Les titrages colorimétriques. TP 7 : Titrage de l'eau oxygénée par dosage colorimétrique. I-. Principe du dosage. 1- On souhaite doser l'eau
 Titrage avec suivi colorimétrique
Titrage avec suivi colorimétrique
Titrage avec suivi colorimétrique. 1. Titrage a. Définitions. Un titrage est une technique L'équation support de la réaction du dosage est du type :.
 Les dosages par titrage colorimétrique
Les dosages par titrage colorimétrique
Les dosages par titrage colorimétrique. 1/ Le principe du dosage par titrage. ? On cherche à déterminer la concentration (ou la quantité de matière) d'une
 Dosage-colorimetrique.pdf
Dosage-colorimetrique.pdf
Verser rapidement la solution titrante jusqu'au changement de couleur. Noter le volume V versé. Recommencer le titrage depuis le début.
 Pas à pas Réaliser un dosage colorimétrique en 8 étapes
Pas à pas Réaliser un dosage colorimétrique en 8 étapes
Si c'est le cas diminuez la vitesse d'agitation et/ou déplacez le bécher sur l'agitateur. En théorie
 titrage colorimetrique dune eau oxygenee
titrage colorimetrique dune eau oxygenee
Capacités exigibles : Réaliser un titrage direct avec repérage colorimétrique de l'équivalence pour déterminer la quantité de matière d'une espèce dans un
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Interpréter qualitativement un changement de pente dans un titrage conductimétrique. Les sujets sur les titrages se prêtent à des questions sur la précision des
 Chapitre 5 : Dosage par titrage
Chapitre 5 : Dosage par titrage
Elle s'exprime en siemens (S). La figure 5.1 présente le schéma d'une cellule conductimétrique. Conductance d'une solution. La conductance G
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Dans un titrage colorimétrique l'équivalence est repérée par un changement une pissette d'eau distillée pour rincer le bécher entre les deux dosages.
 Réaliser un titrage colorimétrique : dosage rapide (selon lénoncé) +
Réaliser un titrage colorimétrique : dosage rapide (selon lénoncé) +
Soit à titrer un volume VA = 100 mL d'eau oxygénée par une solution aqueuse de permanganate de potassium de concentration c0. Réaliser un titrage
Les dosages par titrage colorimétrique
1/ Le principe du dosage par titrage
➔On cherche à déterminer la concentration (ou la quantité de matière) d'une espèce chimique A en solution.
Pour cela, on provoque une réaction chimique entre l'espèce A et l'espèce B qu'on verse. Au cours de cette
réaction, une grandeur physique varie, comme le pH, la conductivité σ, etc...➔C'est le suivi de cette grandeur physique qui permet de déterminer la concentration de A en la calculant
d'après l'équation de la réaction chimique entre A et B.2/ La réaction support
➔Quand le titrage met en jeu 1 seule réaction, on parle de " titrage direct ».➔L'espèce chimique A à doser (dont on cherche la concentration) est appelée " espèce titrée »
et la solution contenant cette espèce A est la " solution titrée » (ou " solution à titrer »).
➔L'espèce chimique B (dont on connaît la concentration) est appelée " espèce titrante »
et la solution contenant cette espèce B est la " solution titrante ».➔La réaction chimique (entre A et B) qu'on utilise pour le titrage est appelée " réaction-support »
Cette réaction doit être quantitative c'est-à-dire rapide, totale et unique.3/ L'équivalence d'un titrage
➔1 ère phase : ➔à l'équivalence :➔2 nde phase : (A)on verse progressivement la solution titrante l'espèce A est encore en excès
donc l'espèce B disparaît au fur et à mesure qu'on la verse : A + B C alors que l'espèce A se trouve encore dans la solution.(B) la dernière goutte versée de l'espèce B a fait disparaître totalement l'espèce A donc il ne reste plus ni A ni B dans la solution. À cet instant, le volume total versé de solution titrante est appelé le volume équivalent Véquivalent. on continue de verser progressivement la solution titrante donc l'espèce B s'accumule et il n'y a plus de A.4/ La stoechiométrie
➔À l'équivalence, les 2 réactifs A et B ont totalement réagi l'un avec l'autre :➢connaissant la quantité de matière de B ayant été versée dans la solution titrée
➢connaissant l'équation de la réaction support entre A et B➢on en déduit la quantité de matière (en mol) de A présente dans la solution titrée et ayant été
consommée, puis on en déduit la concentration molaire de A en (mol.L-1).➔Exemple : titrage de l'eau oxygénée H2O2 (concentration inconnue) par les ions permanganate MnO4-
équation de la réaction support : 2 MnO4- + 5 H2O2 + 6 H3O+ 2 Mn2+ + 5 O2 + 14 H2O
➢Méthode du tableau d'avancement :réaction 2 MnO4- + 5 H2O2 + 6 H3O+ 2 Mn2+ + 5 O2 + 14 H2O
étatavancementquantités de matière
état initialx = 0nBnAexcès00solvant
état intermédiairexnB - 2xnA - 5xexcès2x5xsolvant état finalxmax = xéquivalencenB - 2xéquivnA - 5xéquivexcès2xéquiv5xéquivsolvantFinalement, à l'équivalence :
On connaît nB car on sait que nB = cMnO4- x Véquivalent donc on en déduit : ➢Méthode des proportions stoechiométriques : plus rapideéquation de la réaction : 2 MnO4- + 5 H2O2 + 6 H3O+ 2 Mn2+ + 5 O2 + 14 H2O
réactif B réactif Aà l'équivalence, les 2 réactifs A et B ont été mélangés dans les proportions stoechiométriques donc les coefficients
stoechiométriques nous donnent directement :nB / 2 = nA / 5 nA = (5/2) nB nB = nA nA = 5 nB2 5 2A titréeB titrantemilieu acide
nA = (5/2) x cMnO4- x Véquivalent nA nB coeffA coeffB=pour notre exemple : à l'équivalencenB - 2xéquiv = 0 xéquiv = nB / 2 nA - 5xéquiv = 0 xéquiv = nA / 5quotesdbs_dbs50.pdfusesText_50[PDF] dosage par titrage conductimétrique destop correction
[PDF] dosage par titrage protocole
[PDF] dosage permanganate de potassium par acide oxalique
[PDF] dosage permanganate de potassium par sel de mohr
[PDF] dosage ph métrique definition
[PDF] dosage ph métrique tp
[PDF] dosage potentiométrique d'une solution de sel de mohr
[PDF] dosage potentiometrique equivalence
[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
[PDF] dossier a fournir campus france guinee
[PDF] dossier a fournir pour le crem
[PDF] dossier a fournir visa france en cote d'ivoire
