 Méthode des ajouts dosés
Méthode des ajouts dosés
12 avr. 2023 Cette méthode constitue une alternative intéressante à la méthode de la droite de calibration afin de déterminer la concentration d'un analyte.
 Méthodes détalonnage pour la quantification des polluants
Méthodes détalonnage pour la quantification des polluants
1 oct. 2015 Figure 3 : représentation graphique de l'étalonnage par ajouts dosés. MISE EN ŒUVRE PRATIQUE DES ETALONNAGES. Les gammes d'étalonnage sont ...
 Diapositive 1
Diapositive 1
Étalonnage (Calibration). ▻ 3 types d'étalonnage: ▻ Étalonnage externe. ▻ Étalonnage interne. ▻ Méthode des ajouts dosés (Standard addition method) si:.
 Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
11 avr. 2023 Pour cela il est proposé d'analyser les résultats du dosage de plusieurs boissons Tonic par les méthodes de la droite d'étalonnage externe et ...
 Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
26 avr. 2023 Pour cela il est proposé d'analyser les résultats du dosage de plusieurs boissons Tonic par les méthodes de la droite d'étalonnage externe et ...
 Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
26 avr. 2023 d'étalonnage externe et des ajouts dosés. 1. MÉTHODE DES AJOUTS DOSÉS. 1.1 Généralités. Les méthodes de la droite d'étalonnage et des ajouts ...
 Intérêt de la méthode des ajouts dosés en spectroscopie UV- Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV- Visible
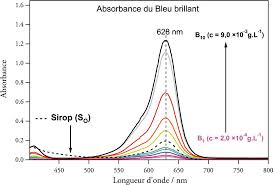
Figure 3: Droite d'étalonnage en absorbance pour le sulfate de quinine dans H2SO4 à 1 mol.L-1. Les courbes en pointillés correspondent aux meilleurs
 Untitled
Untitled
QUESTION N° 2: Quelles sont les conditions nécessaires à l'utilisation de la méthode des ajouts dosés? Pour avoir un étalonnage linéaire il faudrait avoir ...
 Diapositive 1
Diapositive 1
11 févr. 2020 Étalonnage par ajouts dosés. Principe : Ajouter à une concentration inconnue mais constante de notre composé des ajouts successifs de ...
 Théorie des Ajouts dosés
Théorie des Ajouts dosés
Si la courbe d'étalonnage n'est pas une droite la sensibilité à une concentration donnée sera définie comme la pente de la tangente à la courbe à cette
 Méthodes détalonnage pour la quantification des polluants
Méthodes détalonnage pour la quantification des polluants
1 oct. 2015 matrice est trop important il peut être utile de recourir à l'étalonnage par la méthode des ajouts dosés dont le détail est expliqué dans ...
 Diapositive 1
Diapositive 1
Etalonnage (calibration) = relation entre le Étalonnage interne. ? Méthode des ajouts dosés (Standard addition method) si: ? effets de matrice.
 Untitled
Untitled
QUESTION N° 4: Dans quelle mesure pourrait-on avoir un étalonnage linéaire dans le cas La méthode des ajouts dosés ne peut être appliquée que :.
 1. INTRODUCTION 2. MÉTHODES 2.1 Détermination de la
1. INTRODUCTION 2. MÉTHODES 2.1 Détermination de la
28 janv. 2010 L'analyse est ensuite répétée avec ajouts dosés de solutions ... La méthode est linéaire sur toute la gamme d'étalonnage de 1 à 2 640 µg/l ...
 MANIPULATION N° 2-S2
MANIPULATION N° 2-S2
16 août 2016 la concentration des échantillons à partir de la courbe d'étalonnage. ? Dosage par ajouts dosés : On effectue la mesure du potentiel de ...
 Untitled
Untitled
On procède au dosage de l'éthanol par la méthode d'étalonnage interne. Spectrométrie d'absorption atomique (flamme) et méthode des ajouts dosés.
 Choix et Validation Méthode
Choix et Validation Méthode
S'affranchir des effets de matrice : méthode des ajouts dosés et des dilutions courbe d'étalonnage n'est pas une droite la sensibilité à une ...
 Dosage de la caféine dans un soda-cola par HPLC
Dosage de la caféine dans un soda-cola par HPLC
est possible par la méthode de l'étalonnage externe par la méthode des ajouts dosés
 Vidéo « Etalonnage – Tracé de la droite détalonnage » Temps
Vidéo « Etalonnage – Tracé de la droite détalonnage » Temps
00 :09 On va voir comment en pratique
 [PDF] Théorie des Ajouts dosés
[PDF] Théorie des Ajouts dosés
La méthode des ajouts dosés aussi appelé méthode des additions connues consiste en une méthode de dosage d'une espèce chimique en solution
 Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
7 déc 2022 · PDF Cette étude a pour but de mettre en exergue la pertinence de l'utilisation de la méthode des ajouts dans le cas du dosage de la
 Théorie des Ajouts dosés - PDF Téléchargement Gratuit - DocPlayerfr
Théorie des Ajouts dosés - PDF Téléchargement Gratuit - DocPlayerfr
La méthode des ajouts dosés reste néanmoins plus pertinente que la méthode de la droite d'étalonnage 3 MISE EN OEUVRE DE LA MÉTHODE DES AJOUTS DOSÉS 3 1
 [PDF] Méthodes détalonnage pour la quantification des polluants - INRS
[PDF] Méthodes détalonnage pour la quantification des polluants - INRS
1 oct 2015 · Lorsque l'effet matrice est trop important il peut être utile de recourir à l'étalonnage par la méthode des ajouts dosés dont le détail est
 Principe de létalonnage par ajouts dosés - Chimactiv - AgroParisTech
Principe de létalonnage par ajouts dosés - Chimactiv - AgroParisTech
Dans l'étalonnage par ajouts dosés on réalise la gamme d'étalonnage directement dans l'échantillon à doser - on procède donc par analyses successives du
 [PDF] Plan du cours
[PDF] Plan du cours
3 types d'étalonnage: ? Étalonnage externe ? Si effet de matrice dérive de l'appareil : ? Étalonnage interne ? Méthode des ajouts dosés
 Méthode de laddition standard - JoVE
Méthode de laddition standard - JoVE
La méthode des ajouts dosés est une méthode d'analyse quantitative qui est souvent utilisée lorsque l'échantillon comporte des éléments multiples qui
 [PDF] 2015-technicien-PTS-externe-chimie-analytiquepdf
[PDF] 2015-technicien-PTS-externe-chimie-analytiquepdf
Quel est l'intérêt de cette méthode dite des ajouts dosés par rapport à un étalonnage externe ? Quelle critique peut-on faire du protocole proposé précédemment
 [PDF] CLHP quantitative - Free
[PDF] CLHP quantitative - Free
Méthode de la gamme d'étalonnage Méthode des ajouts dosés ? Intérêt : technique analytique validée par une linéarisation sur plusieurs mesures
 [PDF] Intérêt de la méthode des ajouts dosés en spectroscopie UV - HAL
[PDF] Intérêt de la méthode des ajouts dosés en spectroscopie UV - HAL
Figure 12: Droite d'étalonnage en émission (?exc = 390 nm ; fente 25 nm /25 nm ; Détecteur 650 V) pour le sulfate de quinine dans l'eau du distillée (pH 63)
Qu'est-ce que la méthode des ajouts doses ?
La méthode des ajouts dosés est une méthode d'analyse quantitative, qui est souvent utilisée lorsque l'échantillon comporte des éléments multiples qui donnent lieu à des effets de matrice, où les composants supplémentaires peuvent réduire ou augmenter le signal d'absorbance analyte.Pourquoi utiliser la méthode des ajouts doses ?
La méthode de titrage dite des ajouts dosés est une technique d'analyse éprouvée qui présente de nombreux avantages : aucun étalonnage de sonde n'est requis, la préparation des échantillons est simple et les mesures particulièrement performantes – sans compter qu'une automatisation complète est possible.Quelle est la différence entre l'étalonnage interne et externe ?
Alors que pour l'étalonnage interne, le poids d'étalonnage est intégré dans la balance, pour l'étalonnage externe, vous placez un poids d'étalonnage (également appelé poids de contrôle, poids de test ou masses de contrôle) sur la balance.- Lors d'analyses multi-résidus ou nécessitant des étapes de préparations, l'utilisation d'étalons internes, est recommandé pour diagnostiquer et corriger des effets potentiels liés à la préparation d'échantillon, mais également des effets liés à sa matrice sur la détection et la quantification de l'analyte.
I.U.T. - Département Chimie - Travaux Pratiques de Chimie Analytique de deuxième année (Electrochimie)
L. Lavauzelle, J. Molinet, P. Vanloot, M. Antoni. Document original R. Frèzes - août/16MANIPULATION N° 2-S3
DOSAGE DES IONS FLUORURE PAR POTENTIOMÉTRIE
AVEC UNE ÉLECTRODE SPÉCIFIQUE
2.1- INTRODUCTION.
Les dosages potentiométriques sont basés sur l'étude de la variation du potentiel d'une électrode
indicatrice, en fonction de la concentration d'une espèce chimique. Le dosage peut se faire de plusieurs manières :9 Dosage par étalonnage : On effectue un étalonnage de la réponse de l'électrode (potentiel) avec des
solutions contenant la substance à doser à des concentrations connues puis on détermine directement
la concentration des échantillons à partir de la courbe d'étalonnage.9 Dosage par ajouts dosés : On effectue la mesure du potentiel de l'électrode indicatrice dans la
solution d'échantillon seule, puis après l'ajout d'un volume déterminé d'une solution étalon de la
substance à doser. Un calcul permet alors de connaître la concentration en espèce active dans
l'échantillon.9 Dosage avec réaction : On ajoute un réactif titré à l'échantillon et on enregistre la courbe donnant la
variation du potentiel. L'exploitation de cette courbe permet la détermination de la concentration de
la substance active. Cette méthode s'applique à toute réaction pour laquelle il existe une électrode
indicatrice pour suivre la concentration d'au moins une des substances mises en jeu. Les principaux avantages de la potentiométrie sont : La possibilité de travailler avec des solutions troubles, opaques, colorées ou fluorescentes. Dosage possible même s'il n'existe pas d'indicateur coloré approprié.Une bonne répétabilité.
Dans cette manipulation, on se propose de déterminer la concentration en ions fluorure dans divers
échantillons liquides ou solides, par la méthode avec étalonnage et la méthode des ajouts dosés, en utilisant
une électrode spécifique.2.2- PRINCIPE DES DOSAGES POTENTIOMÉTRIQUES.
2.2.1- Généralités.
Pour réaliser un dosage potentiométrique il faut disposer :9 D'une électrode indicatrice dont le potentiel est fonction de la concentration de l'espèce
active. En fait le potentiel est fonction de l'activité de l'espèce, mais moyennant certaines précautions il est possible de le relier directement à la concentration.9 D'une électrode de référence dont le potentiel est constant.
- 15 -I.U.T. - Département Chimie - Travaux Pratiques de Chimie Analytique de deuxième année (Electrochimie)
L. Lavauzelle, J. Molinet, P. Vanloot, M. Antoni. Document original R. Frèzes - août/169 D'un appareil de mesure, appelé potentiomètre, couplé ou non avec une burette automatique
et un enregistreur. Dans le cas du dosage d'ions avec une électrode spécifique, le potentiel doit être mesuré avec une précision de 0,1 mV.Lorsqu'on effectue un dosage avec réaction chimique, la mesure du potentiel peut être effectuée à
courant nul ou à courant imposé. Dans le cas d'un dosage par étalonnage ou par ajouts dosés, la mesure est
toujours faite à courant nul (l'électrode indicatrice n'est parcourue par aucun courant lors de la mesure).
2.2.2- Électrode spécifique.
Une électrode spécifique est une électrode qui est sensible uniquement aux variations de
concentration d'une espèce chimique donnée. Dans la pratique l'électrode peut être également sensible, dans
une moindre mesure, à d'autres espèces.Dans le cas des ions fluorure, l'électrode spécifique est une électrode à membrane solide constituée
par un cristal de trifluorure de lanthane dopé à l'europium. Cette électrode est environ 1000 fois plus sensible
aux ions F- qu'aux autres ions (sauf pour les ions OH-).La seule espèce pouvant interférer est l'ion hydroxyde, OH-, pour lequel l'électrode est environ 10
fois plus sensible. Par contre en milieu acide les ions F- sont transformés en HF pour lequel l'électrode est
insensible. Pour doser les ions fluorure il est donc nécessaire de travailler en milieu tamponné légèrement
acide, à un pH compris entre 5 et 6.La différence de potentiel, U, d'une telle électrode par rapport à une électrode de référence, est
donnée par la relation de Nernst (voir détail dans l'appendice A2.1; équations A2.1-11 et A2.1-12) :
)]Flog([eSKU (2-1) avec :U : différence de potentiel mesurée (V).
log : logarithme décimal. K : constante qui dépend de l'électrode de référence et de la température (V). (cette constante est représentée par K'' ou K''' dans l'appendice A2.1)S : pente de la droite ( = -R.T/F ).
(= -0,05777 V à 18 °C; -0,05817 V à 20 °C; -0,05856 V à 22 °C; -0,05916 V à 25 °C)
[F-]e : concentration des ions fluorure (mol/l) à l'extérieur de l'électrode.L'électrode de référence utilisée est soit une électrode au calomel, soit une électrode Ag/AgCl.
L'équation (2-1) s'applique pour des concentrations comprises entre 10-6 et 1 mol/l.2.2.3- Méthode par étalonnage.
Dans cette méthode on effectue d'abord un étalonnage de l'électrode à l'aide de solutions de
concentration connue en l'espèce à doser. Il est important que la composition ionique des solutions soit
semblable de façon à obtenir une même force ionique. Ceci est réalisé en partie en ajoutant un électrolyte
tampon de concentration plus importante n'interférant pas avec l'électrode de mesure. Ces électrolytes
tampons sont appelés TISAB (Total Ionic Strength Adjustement Buffer). Pour le dosage de l'ion fluorure on
utilise une solution contenant de l'acide acétique (57 ml/l), du chlorure de sodium (58 g/l) du CDTA (5 g/l;
Complexon IV; acide trans-1,2 diaminocyclohexane-N,N,N',N' tétraacétique monohydrate; C14H22N2O8,H2O)
et qui a été neutralisée par de l'hydroxyde de sodium jusqu'à un pH de 5-5,5. Cette solution tampon
maintient le pH entre 5 et 6 au cours du dosage, donne une force ionique totale élevée et le CDTA
complexe les cations pouvant interférer avec les ions F- (par exemple Al3+ ou Fe3+).Le tracé de la courbe U = f{log(concentration)}, une droite en théorie, permet ensuite la
détermination de la concentration des échantillons. - 16 -I.U.T. - Département Chimie - Travaux Pratiques de Chimie Analytique de deuxième année (Electrochimie)
L. Lavauzelle, J. Molinet, P. Vanloot, M. Antoni. Document original R. Frèzes - août/162.2.4- Méthode des ajouts dosés.
Cette méthode permet de tenir compte de l'effet de "matrice", c'est à dire de la présence éventuelle
d'autres ions ayant une influence sur la réponse de l'électrode. En effet, toutes les mesures sont faites dans la
solution échantillon. Dans la méthode précédente, les solutions étalons ne contiennent que l'ion fluorure et
sont donc différentes des échantillons qui le plus souvent contiennent de nombreux autres ions.
On effectue tout d'abord une mesure de la différence de potentiel sur la solution d'échantillon seule
en présence de l'électrolyte tampon. On obtient : @1tx xx VV VCF u (2-2) uu 11log0586,0
tx xx VV VCKU (à 22 °C) (2-3) avec :U1 : différence de potentiel mesurée (V).
Cx : concentration de l'échantillon (mol/l).
Vx : volume d'échantillon (ml).
Vt1 : volume de tampon (ml).
Ensuite on ajoute un volume Ve de solution étalon à un volume Vx d'échantillon. On obtient :
2 F tex eexx VVV VCVC uu (2-4) uuu 22log0586,0
tex eexx VVVVCVCKU
(2-5) avec :U2 : différence de potentiel mesurée (V).
Ce : concentration de la solution étalon (mol/l).Ve : volume de solution étalon (ml).
Vt2 : volume total de solution tampon (ml).
En combinant les équations (2-5) et (2-3) on obtient la valeur de la concentration de l'échantillon :
uuquotesdbs_dbs42.pdfusesText_42[PDF] role de l'étalon interne
[PDF] étalonnage interne et externe
[PDF] normalisation interne
[PDF] méthode d'étalonnage interne et externe
[PDF] gamme d'étalonnage définition
[PDF] subjonctif présent collège
[PDF] palpeur dynamique
[PDF] go gap barclays bank graduates and starting work 2006
[PDF] texte synonymes cycle 3
[PDF] elle n'était pas grande mais elle le semblait
[PDF] étalonnage externe chromatographie gazeuse
[PDF] nous avons le cou brisé
[PDF] ce matin je sens que je vais travailler travailler vraiment
[PDF] sujet concours accompagnant educatif et social
