![[PDF] ANNALES SCIENCES PHYSIQUES 3ème [PDF] ANNALES SCIENCES PHYSIQUES 3ème](https://pdfprof.com/PDFV2/GoBo/Images37/26_22958_2_.png) [PDF] ANNALES SCIENCES PHYSIQUES 3ème
[PDF] ANNALES SCIENCES PHYSIQUES 3ème
Conseils pour la résolution d'un exercice de Sciences physiques en classe de troisième CORRIGES. CORRIGES. Page 47. 46. CORRIGE 2000. I/ CHIMIE. A) Questions ...
 Exercice physique chimie 3eme corrige pdf
Exercice physique chimie 3eme corrige pdf
Exercice corrige physique chimie 3eme pdf. programme de physique-chimie au cycle Exercices Corrigés de Physique Chimie 3ème PDF.Les atomes sont beaucoup trop.
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
6 févr. 2010 Problèmes corrigés de physique (CAPES de sciences physiques). © Bréal ... Physique-Chimie ainsi que sur la correction des exercices n'hésitez ...
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Sciences-Mathématiques-Physique (SMP) Sciences-Mathématiques-Chimie. (SMC) et Sciences de la Vie (SVI) des facultés des sciences. Il comporte des exercices
 PHYSIQUE-CHIMIE- TECHNOLOGIE
PHYSIQUE-CHIMIE- TECHNOLOGIE
TOMASINO et al. ➢ Sciences physiques. Rappels de Cours et exercices corrigés. la 3ème pupille vaut 4 π etc… puisque les pupilles sont régulièrement ...
 Exercices corrigés sur les forces en physique 3eme pdf
Exercices corrigés sur les forces en physique 3eme pdf
Lorsque la chaussure du joueur de foot touche le ballon celui-ci se met en mouvement : une action mécanique exercée par la chaussure du joueur sur le
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB. 1/ Chimie : organisation Exercice : Sachant qu'un 1 kWh coûte environ 012 €
 CONTROLE n°1 : CHIMIE
CONTROLE n°1 : CHIMIE
Exercice n° 1 : (3 points). Indique VRAI ou FAUX pour chaque affirmation: 1- Le diamètre d'un atome est égal à celui de son noyau.
 Physique Chimie
Physique Chimie
8 févr. 2017 Physique Chimie Nathan pour le Cycle 4 ... notions et léchés selon la compétence travaillée. ○ Un exercice corrigé et commenté suivi d'un ...
 Couverture Cours dété_sans devoirs_générique_18-séparées.indd
Couverture Cours dété_sans devoirs_générique_18-séparées.indd
itions de pa de. Cours • Méthode • Exercices • Corrigés. Grand jeu concours. 300 BD à gagner ! *. Troisième mon année. Physique Chimie. 3e. Physique. Chimie.
 ANNALES SCIENCES PHYSIQUES 3ème
ANNALES SCIENCES PHYSIQUES 3ème
Eél = Pél × t = 705882 × 30 ; Eél = 21
 Exercices corrigés physique chimie 3eme pdf
Exercices corrigés physique chimie 3eme pdf
Cours de chimie physique 3ème gratuit Physique Chimie Exercice 3ème PDF
 Exercices corrigés – Chimie I niveau 3ème
Exercices corrigés – Chimie I niveau 3ème
Exercices corrigés – Chimie I niveau 3ème. Impression : Imprimez deux pages sur une page. Exercice 10 page 26 (chapitre 1).
 Physique et Chimie cycle 4 Classe de TROISIEME
Physique et Chimie cycle 4 Classe de TROISIEME
Inspection pédagogique régionale de physique chimie - Académie de Lille. Juin 2020 vous proposer des révisions des exercices et des activités ludiques.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB Exercice : Sachant qu'un 1 kWh coûte environ 012 €
 Recueil dexercices corrigés en INFORMATIQUE I
Recueil dexercices corrigés en INFORMATIQUE I
étudiants de L1 Sciences de la Matière (Physique et Chimie). Il regroupe entre autres
 Troisième - Constitution des atomes - Exercices - Devoirs
Troisième - Constitution des atomes - Exercices - Devoirs
Exercice 4 corrigé disponible. Exercice 5 corrigé disponible. 1/4. Constitution des atomes – Exercices - Devoirs. Physique Chimie Troisième obligatoire
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
Problèmes corrigés de physique (CAPES de sciences physiques). © Bréal 2006 Eléments de correction des exercices du chapitre 4 : chimie des solutions.
 Cinématique et dynamique du point matériel (Cours et exercices
Cinématique et dynamique du point matériel (Cours et exercices
À la fin de ce polycopié nous proposons quelques exercices corrigés. On classe les grandeurs physiques suivant deux catégories : les grandeurs ...
Exercices corrigés - Chimie I niveau 3ème
Impression : Imprimez deux pages sur une page
Exercice 10 page 26 (chapitre 1)
a) On identifie la présence de cuivre à partir de la couleur rouge-orangée du métal comme on
peut le voir sur la photo.b) Pour vérifier la présence de fer, on peut utiliser un aimant et vérifier que les pièces sont
attirées par l"aimant. En effet, un aimant attire le fer, le nickel et le cobalt.Exercice 14 page 27 (chapitre 1)
a) Le passage du minerai à l"acier s"effectue en deux étapes. Tout d"abord, on enlève les atomes d"oxygène du minerai en utilisant du coke dans un hautfourneau. On obtient ainsi de la fonte. Ensuite, on diminue la quantité de carbone présent dans la fonte pour obtenir de l"acier.
b) La fonte est bon marché et se moule bien. Par contre, elle est cassante. On préfère l"acier car il est moins fragile. c) La fonte est composé de fer et de 2 à 6 % de carbone. L"acier est composé de fer et de moins de 2% de carbone. Le fer pur n"est composé que de fer. Ce qui différencie la fonte, l"acier et le fer pur est le pourcentage de carbone présent.Exercice 15 page 27 (chapitre 1)
a) Il y a 18% de la masse de la fourchette qui est du chrome.Donc, m(Cr) = Pourcentage (Cr) * m(fourchette)
Soit, m(Cr) = 18% * 50 g
m(Cr) = 9 g Il y a donc 9 grammes de chrome dans une fourchette de 50 grammes. Il y a 10% de la masse de la fourchette qui est du nickel.Donc, m(Ni) = Pourcentage (Ni) * m(fourchette)
Soit, m(Ni) = 10% * 50 g
m(Ni) = 5 g Il y a donc 5 grammes de nickel dans une fourchette de 50 grammes.Or, m(fourchette) = m(acier) + m(Ni) + m(Cr)
Donc, m(acier) = m(fourchette) - m(Ni) - m(Cr)
Soit, m(acier) = 50 g - 5 g - 9 g
m(acier) = 36 g La fourchette est constituée de 36 grammes d"acier.Méthode alternative (plus élégante) :
La foruchette est constituée d"acier, de chrome et de nickel. Autrement dit, 100 % = Pourcentage (Cr) + Pourcentage (Ni) + Pourcentage (acier) Donc, Pourcentage (acier) = 100 % - Pourcentage (Cr) - Pourcentage (Ni) Soit, Pourcentage (acier) = 100 % - 18 % - 10 %Pourcentage (acier) = 72 %
Or, m(acier) = Pourcentage (acier) * m(fourchette)Soit, m(acier) = 72% * 50 g
m(acier) = 36 g La fourchette est constituée de 36 grammes d"acier.b) On utilise des aciers inoxydables car ils résistent mieux à la corrosion. En effet, le chrome
et le nickel réalise, en s"oxydant, une couche d"oxydes protectrice qui bloque la corrosion.Exercice 4 page 39 (chapitre 2)
Un atome est électriquement neutre donc il possède autant de protons que d"électrons. Comme l"atome d"aluminium possède 13 électrons, il doit posséder aussi 13 protons. Nouspouvons donc éléminer le schéma n°2 car son noyeau ne possède que 12 protons, 12 charges
positives, au lieu des 13 requis.Le schéma n° 1 possède 12 électrons donc il n"est pas une représentation de l"atome
d"aluminium car il manque un électron.Le schéma n°3 possède 13 électrons et 13 protons, il s"agit donc d"une représentation de
l"atome d"aluminium.Exercice 8 page 40 (chapitre 2)
a) Entre les points A et B, on peut compter 7 sphères rouge et jaune donc il y a 7 atomes de carbone.b) Entre les points A et B, il y a 6 centimètres. Comme l"échelle précise qu"un centimètre
correspond en réalité à 1 nanomètre, alors la distance entre les points A et B est de 6
nanomètres.Je sais que : 1 nm = 10
-9 mDonc, 6 nm = 6.10
-9 m c)Soit, D
AB = la distance entre les points A et B
NC = le nombre d"atomes de carbone
dC = le diamètre d"un atome de carbone
Je sais que : D
AB = NC * dC
Donc, d
C = DAB / NC
Soit, d
C = 6 nm / 7
Soit, d
C = 0,86 nm
Un atome de carbone a donc un diamètre de 0,86 nanomètres.Exercice 10 page 40 (chapitre 2)
a) Lorsque l"interrupteur est fermé, le circuit est parcouru par du courant électrique. La
plaque étant métallique, elle laisse passer le courant car elle est conductrice. Les électrons se
déplacent donc tous dans le même sens de la borne négative vers la borne positive, soit dans
le sens contraire du sens conventionnel. Enobservant les deux figures,on constate que dans la figure 1 les électrons se déplacent dans tous les sens alors que dans la figure 2 ils se déplacent tous dans la même direction, de la gauche vers la droite. La représentation qui correspond donc au cas où le circuit est fermé est la figure 2. b) I sens de déplacement des électronsPlaque
de zinc _Exercice 2 page 57 (chapitre 3)
a) On constate sur la photographie n°1 que le précipité est de couleur verte donc on peut en
déduire qu"il s"agit d"ions Fe 2+. On constate sur la photographie n°2 que le précipité est de couleur bleue donc on peut en déduire qu"il s"agit d"ions Cu 2+. On constate sur la photographie n°3 que le précipité est de couleur orange donc on peut en déduire qu"il s"agit d"ions Fe 3+. b) Le détecteur utilisé est de la soude NaOH et plus particulièrement les ions OHEquations bilan des réactions :
- Photographie 1 : 2 OH - + Fe2+ ® Fe(OH)2 - Photographie 2 : 2 OH - + Cu2+ ® Cu(OH)2 - Photographie 3 : 3 OH - + Fe3+ ® Fe(OH)3Exercice 4 page 57 (chapitre 3)
1) Je sais que : Charge (ion) = Nombre de protons - Nombre d"électrons
L"ion n°1 est constitué de 27 électrons et 29 protons.Donc, Charge (ion n°1) = 29 - 27
Charge (ion n°1) = +2
L"ion n°2 est constitué de 23 électrons et 26 protons.Donc, Charge (ion n°1) = 26 - 23
Charge (ion n°1) = +3
L"ion n°1 a une charge électrique de +2 et l"ion n°2 a une charge électrique de +3.2) Je sais qu"un atome est électriquement neutre, c"est-à-dire qu"il est composé d"autant de
charges électriques négatives, les électrons, que de charges électriques positives, les
protons. L"ion n°1 possède 29 protons, l"atome correspondant aura donc 29 électrons. L"ion n°2 possède 26 protons, l"atome correspondant aura donc 26 électrons.29 électrons 26 électrons
Atome n°1 Atome n°2
29+ 26+
Pour aller plus loin : Lorsqu"il y a 29 protons, il s"agit de l"élément cuivre. L"ion n°1 est donc Cu
2+ et l"atome n°1
est Cu. Lorsqu"il y a 26 protons, il s"agit de l"élément fer. L"ion n°2 est donc Fe3+ et l"atome n°2 est
Fe.Exercice 5 page 57 (chapitre 3)
Nom Nombre de
charges positives du noyauNombre
d"électronsCharge de
l"ionFormule
de l"ionIon chlorure 17 18 -1 Cl-
Ion sodium 11 10 +1 Na+
Ion fer II 26 24 +2 Fe2+
Ion fer III 26 23 +3 Fe3+
Ion cuivre II 29 27 +2 Cu2+
· Ligne 1 : Il s"agit de l"ion Cl-, donc il s"appelle l"ion chlorure.· Ligne 2 :
1ère méthode
Cet ion a une charge positive, donc il a un électron de moins par rapport aux protons. Nous cherchons le nombre de protons. Charge (ion) = Nombre de protons - Nombre d"électrons Donc, Nombre de protons = Charge (ion) + Nombre d"électronsSoit, Nombre de protons = +1 + 10
Nombre de protons = +11
2ème méthode
Comme c"est l"ion sodium donc il s"agit de l"élément sodium. D"après le tableau périodique,
l"élément sodium est l"élément n°11. Il est donc composé de 11 protons.· Ligne 3 : Il s"agit de l"élément fer car il y a 26 protons, on utilisera donc le symbole Fe.
L"ion a une charge de +2 donc on ajoutera " 2+ » en exposant du symbole. La formule de l"ion est donc Fe 2+. · Ligne 4 : La charge de l"ion est +3 donc il a un déficit de 3 électrons par rapport aux protons. Nous cherchons le nombre d"électrons. Charge (ion) = Nombre de protons - Nombre d"électrons Donc, Nombre d"électrons = Nombre de protons - Charge (ion)Soit, Nombre d"électrons = 26 - (+3)
Nombre d"électrons = 23
· Ligne 5 :
1ère méthode
La formule de l"ion est Cu
2+ donc la charge de l"ion cuivre est +2.
2ème méthode
Cet ion possède 29 protons et 27 électrons. Nous cherchons la charge de cet ion. Charge (ion) = Nombre de protons - Nombre d"électronsSoit, Charge (ion) = 29 - 27
Charge (ion) = +2
Exercice 11 page 58 (chapitre 3)
Nous allons tester la présence des ions fer II et fer III dans l"eau de la source. Pour cela nous allons utiliser de la soude (NaOH) car les ions hydroxyde (OH -) présents dans la soude vont faire précipiter les ions fer présents dans l"eau de source.Matériel :
un tube à essai, une pipette, soudeProtocole :
1) Prélever de l"eau de source dans un tube à essai
2) Ajouter quelques gouttes de soude dans le tube à essai
3) Observer la couleur du précipité formé
Si le précipité est de couleur verte, alors c"est qu"il y avait des ions fer II dans l"eau de source et donc Damien aura raison.Si le précipité est de couleur rouille, alors c"est qu"il y avait des ions fer III dans l"eau de
source et donc Samy aura raison.Exercice 12 page 58 (chapitre 3)
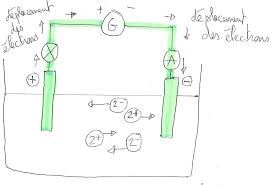
a) L"électrode positive est l"électrode reliée au pôle positif du générateur. L"électrode
négative est l"électrode reliée au pôle négatif du générateur. J"ai décidé de ne pas représenter les molécules d"eau pour ne pas surcharger le dessin.b) Les ions positifs vont se déplacer vers l"électrode négative alors que les ions négatifs vont
se déplacer vers l"électrode positive.quotesdbs_dbs7.pdfusesText_13[PDF] exercices corrigés physique chimie seconde nathan
[PDF] exercices corrigés physique chimie seconde nouveau programme pdf
[PDF] exercices corrigés physique chimie terminale s hachette
[PDF] exercices corrigés physique licence 1
[PDF] exercices corriges physique seconde refraction
[PDF] exercices corrigés probabilité terminale s pdf
[PDF] exercices corrigés provisions pdf
[PDF] exercices corrigés reproduction humaine pdf
[PDF] exercices corrigés retraitement bilan financier
[PDF] exercices corrigés second principe thermodynamique
[PDF] exercices corrigés statistiques
[PDF] exercices corrigés statistiques ? deux variables
[PDF] exercices corrigés statistiques pdf
[PDF] exercices corrigés suites arithmétiques géométriques pdf