 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Interpréter qualitativement un changement de pente dans un titrage conductimétrique. EXERCICE III. DE LA COMPOSITION D'UN SODA À SA CONSOMMATION. ACCÈS ...
 EXERCICES : Dosage par titrage conductimétrique
EXERCICES : Dosage par titrage conductimétrique
Exercices – dosages par conductimétrie. Exercice 1 : Titrage acido-basique. On dose par titrage conductimétrique
 Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
EXERCICE p : 479 n°10. Justifier l'évolution de la conductivité. On dose par titrage conductimétrique
 TP N°9 : TITRAGE CONDUCTIMETRIQUE DU VINAIGRE
TP N°9 : TITRAGE CONDUCTIMETRIQUE DU VINAIGRE
Ajouter de l'eau distillée jusqu'au trait de jauge et homogénéiser la solution en agitant. 2) Schéma du titrage conductimétrique : 3) Equation de la réaction de
 Terminale générale - Suivi dun titrage - Exercices - Devoirs
Terminale générale - Suivi dun titrage - Exercices - Devoirs
titrage acidobasique suivi par conductimétrie. Une solution aqueuse SA de volume V = 2000 mL est préparée à partir d'un comprimé entier. On prélève un ...
 BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
Partie B - Dosage par titrage conductimétrique des ions nitrate dans l'eau étudiée L'objectif de cet exercice est d'évaluer la consommation de gaz d'un four ...
 1 CORRECTION BAC-BLANC 2019 TS EXERCICE I : ÉTUDE DE L
1 CORRECTION BAC-BLANC 2019 TS EXERCICE I : ÉTUDE DE L
Protocole du titrage conductimétrique : On prélève à l'aide d'une pipette jaugée
 Sujet du bac S Physique-Chimie Spécialité 2018 - Polynésie
Sujet du bac S Physique-Chimie Spécialité 2018 - Polynésie
On réalise le titrage conductimétrique de 100 mL de la solution Smer par Commenter le résultat obtenu. Page 7. 18PYSCSPO1. Page 7 sur 14. EXERCICE II : LE ...
 Dans un dosage par titrage Dans un dosage par étalonnage On n
Dans un dosage par titrage Dans un dosage par étalonnage On n
EXERCICES D'APPLICATION DOSAGE PAR ETALONNAGE ET PAR TITRAGE. 1° Schéma c) Comment détermine-t-on le volume à l'équivalence lors d'un dosage conductimétrique ...
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
pente dans un titrage conductimétrique. EXERCICE 2 – UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE L'IBUPROFÈNE. ACCÈS CORRECTION.
 Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Justifier l'évolution de la conductivité. On dose par titrage conductimétrique
 Exercices Séquence n°22 Dosages par titrage avec suivi
Exercices Séquence n°22 Dosages par titrage avec suivi
Terminale STL – SPCL Chimie et Développement Durable Fiche d'activité – Séquence 22 : Dosage par titrage avec suivi conductimétrique. 1. Exercices Séquence
 EXERCICE A CARACTERE EXPERIMENTAL 1) La solution d
EXERCICE A CARACTERE EXPERIMENTAL 1) La solution d
EXERCICE A CARACTERE EXPERIMENTAL. TITRAGE CONDUCTIMETRIQUE D'UNE SOLUTION D'AMMONIAC. 1) La solution d'ammoniac. 05p. 2) On prélève la solution à titrer
 Dans un dosage par titrage Dans un dosage par étalonnage On n
Dans un dosage par titrage Dans un dosage par étalonnage On n
EXERCICES D'APPLICATION DOSAGE PAR ETALONNAGE ET PAR TITRAGE c) Comment détermine-t-on le volume à l'équivalence lors d'un dosage conductimétrique ?
 Exercice n°2 : ANALYSE DUN LAIT 65 pts
Exercice n°2 : ANALYSE DUN LAIT 65 pts
On se propose de déterminer les masses en ions chlorure et en acide lactique présents dans un lait. 1. DOSAGE PAR CONDUCTIMÉTRIE. 1.1. On prélève un volume V0 =
 BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
Le candidat traite 3 exercices : l'exercice 1 puis il choisit 2 exercices parmi On réalise le titrage conductimétrique d'un volume VA = 1000 mL de la ...
 Chapitre 23 – Contrôle de qualité : dosages par titrage direct Sirius
Chapitre 23 – Contrôle de qualité : dosages par titrage direct Sirius
EXERCICE RÉSOLU 2. Dosage par titrage conductimétrique. Énoncé. On prélève un volume V0 = 200 mL de lait (solution S0) et on les introduit dans une fiole
 CORRIGE Exercice à caractère expérimental Dosage
CORRIGE Exercice à caractère expérimental Dosage
Dosage conductimétrique des ions sulfate dans une eau minérale Au cours de ce titrage l'équivalence a lieu lorsque la quantité de matière des ions.
 Utilisation de REGRESSI pour un dosage conductimétrique
Utilisation de REGRESSI pour un dosage conductimétrique
(1) « Fichier ». (2) « Nouveau ». (3) « Clavier ». (4) Rentrer les symboles et les unités des grandeurs physiques qui figureront sur les axes.
Sirius T
ermS Nathan 2012 1
EXERCICE RÉSOLU 2
Dosage par titrage conductimétrique
Énoncé
On prélève un volume V0
= 20,0 mL de lait (solution S 0 ) et on les introduit dans une fiole jaugée de volume V S = 100,0 mL. On complète avec de l'eau distillée et on homogénéise pour obtenir une solution S, de concentration c SOn verse un volume V
1 = 10,0 mL de la solution S dans un bécher et on y ajoute environ 250 mL d'eau distillée. On plonge ensuite dans le bécher une cellule conductimétrique. Initialement, et après chaque ajout, mL par mL, d'une solution aqueuse de nitrate d'argent (Ag (aq), NO 3- (aq)) de concentration c = 5,0 103 molL
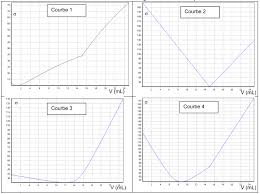
1 , on détermine la conductivité du milieu réactionnel.Le suivi conductimétrique du dosage permet d'obtenir la courbe d'évolution de la conductivité
du milieu réactionnel en fonction du volume V 2 de la solution de nitrate d'argent versé (voir courbeci-dessous). La transformation chimique, rapide, met uniquement en jeu les ions chlorure et les ions argent selon l'équation de réaction : Ag
(aq) + Cl (aq) AgCl(s).D'après BAC, Antilles, septembre 2009.
Données
À 25°C : (Cl
) = 76,3 10 4 m·S·mol 1 (NO 3- ) = 71,4 10 4 m·S·mol 1 (Ag ) = 61,9 10 4 m·S·mol 1Masse molaire des ions chlorure : M(Cl-
) = 35,5 g·mol 11. En utilisant les valeurs des conductivités molaires ioniques, interpréter la variation de la valeur de
la conductivité du milieu réactionnel au cours du dosage.2. Déterminer, en utilisant cette courbe, le volume V
e de solution de nitrate d'argent versé à l'équivalence.3. Quelle est, à l'équivalence, la relation entre la quantité de matière en ions argent introduits et la
quantité de matière en ions chlorure initialement présents ? Courbe d'évolution de la conductivité
Chapitre 23 - Contrôle de qualité : dosages par titrage directSirius T
ermS Nathan 2012 2
4. En déduire la concentration molaire c
S en ions chlorure initialement présents dans la solution S, puis celle c 0 dans le lait.5. La masse d'ions chlorure présents dans un litre de lait doit être comprise entre 1,0 et 2,0 g.
Calculer la masse d'ions chlorure présents dans le lait étudié et conclure.Connaissances
Il faut connaître la définition
de l'équivalence et savoir la traduire par une relation.Raisonner
Ne pas oublier de tenir
compte de la dilution.Une solution
1. Avant l'équivalence, le réactif limitant est Ag
. Les ions Cl sont consommés, des ions NO 3 sont introduits. La conductivité diminue car la conductivité ionique molaire de Cl est plus grande que celle de NO 3 Après l'équivalence, le réactif limitant est Cl . La quantité d'ions NO 3 augmente. Des ions Ag sont introduits sans être consommés donc la conductivité augmente.2. D'après la courbe, le volume versé à l'équivalence est V
e = 12,0 mL.3. À l'équivalence, les réactifs ont été introduits dans les proportions stoechiométriques.
n Cl , i 1 =n Ag , e 1 4. c s V 1 = cV e donc c s cV e V 1A.N. : c
s 5,010 312,010
310,010
3 =6,010 3 mol·L 1 Lors d'une dilution, il y a conservation de la quantité de matière : c 0 V 0 = c S V S donc c 0 c S V S V 0A.N. :
333100,20100,100100,6
= 3,0 10 2 mol·L 15. A.N. : c
m = c 0M = 3,0 10
235,5 = 1,7 g·L
1 Dans un litre de ce lait, il y a 1,7 g d'ions chlorure, ce lait peut donc être consommé car 1,0 < 1,7 < 2,0 g·L 1quotesdbs_dbs1.pdfusesText_1[PDF] exercice titrage type bac
[PDF] exercice torseur statique corrigé
[PDF] exercice transfert thermique conduction
[PDF] exercice transformation en chimie organique terminale s
[PDF] exercice travail d'une force terminale s
[PDF] exercice travail et puissance 1ere s
[PDF] exercice trigonométrie 3ème type brevet
[PDF] exercice trigonométrie brevet
[PDF] exercice trigonométrie seconde
[PDF] exercice type bac acide base
[PDF] exercice type bac effet doppler
[PDF] exercice type bac exponentielle terminale es
[PDF] exercice type bac fonction exponentielle es
[PDF] exercice type bac fonction logarithme neperien es
