 Correction des parties 1. et 2. de lexercice Les débuts de lélectron
Correction des parties 1. et 2. de lexercice Les débuts de lélectron
Corrigé réalisé par B. Louchart professeur de Physique-Chimie. © http://b.louchart.free.fr. 1. L'expérience de J.J. Thomson. 1.1. D'après le texte d
 EXERCICE II : LES DÉBUTS DE LELECTRON EN PHYSIQUE (9
EXERCICE II : LES DÉBUTS DE LELECTRON EN PHYSIQUE (9
L'expérience de J.J. Thomson. Lors de ses recherches dans son laboratoire de Cambridge Thomson conçoit un dispositif dans lequel un faisceau d'électrons est
 Devoir surveillé N°2
Devoir surveillé N°2
20 nov. 2017 Exercice 1 : L'expérience de J.J. Thomson (925 points). Le problème posé par la nature des « rayons cathodiques » à la fin du XIXème siècle.
 Expérience - UNIVERSITE BADJI MOKHTAR-ANNABA Exercice 1
Expérience - UNIVERSITE BADJI MOKHTAR-ANNABA Exercice 1
Exercice 1 : Expérience de J.J.Thomson. Un faisceau d'électrons subit une déviation y0 sous l'action d'un champ électrique.
 Dr: BELALA ZOHRA
Dr: BELALA ZOHRA
3: Expérience de J.J Thomson (1895). L'électron e pénètre avec une vitesse Corrigé des exercices d'application. Exercice 01: On dispose de 04 moles de ...
 T4 – Appendice 1 DÉTENTES DE JOULE
T4 – Appendice 1 DÉTENTES DE JOULE
II Détente de Joule-Thomson (Joule-Kelvin). II.1 Description de l'expérience Exercices. T4.A1. Solution Ex-III.1. 1) Lorsqu'on enlève la kième cale on est ...
 Physique PCSI. Exercices M3 Lycée Brizeux 2016-2017 Exercice 1
Physique PCSI. Exercices M3 Lycée Brizeux 2016-2017 Exercice 1
Expérience de Thomson (1897). En 1897 J.J. Thomson voulait mesurer le rapport pour l'électron. La déviation par un champ magnétique ou électrique
 DEVOIR COMMUN N°2
DEVOIR COMMUN N°2
ATTENTION. TOUT CE QUI EST DEMANDÉ EN ANNEXE NE SERA CORRIGÉ QU'EN ANNEXE. EXERCİCE 1 : EXPERIENCE DE THOMSON… (5 points). Joseph John Thomson. (1856 -1940)
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
expérience de J.J. Thomson et l'expérience de Rutherford. Le troisième Corrigé des exercice Chapitre V. Exercice 1. 1) la position des éléments suivants ...
 Correction des parties 1. et 2. de lexercice Les débuts de lélectron
Correction des parties 1. et 2. de lexercice Les débuts de lélectron
Correction des parties 1. et 2. de l'exercice Corrigé réalisé par B. Louchart professeur de Physique-Chimie ... L'expérience de J.J. Thomson.
 CORRIGÉ DU BAC BLANC 2016 EXERCICE A : LES DÉBUTS DE L
CORRIGÉ DU BAC BLANC 2016 EXERCICE A : LES DÉBUTS DE L
CORRIGÉ DU BAC BLANC 2016. EXERCICE A : LES DÉBUTS DE L'ÉLECTRON EN PHYSIQUE (9 POINTS). 1. L'EXPÉRIENCE DE J.J. THOMSON. 1.1. Le champ électrique E dans un
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
chapitres avec des exercices corrigés dans chaque chapitre. Le premier chapitre étudie les expérience de J.J. Thomson et l'expérience de Rutherford.
 CCINP Physique PC 2019 — Corrigé
CCINP Physique PC 2019 — Corrigé
La première partie traite de l'expérience de Rutherford qui a conduit à valider le modèle de l'atome de Jean Perrin. Elle fait appel à des connaissances en.
 T4 – Appendice 1 DÉTENTES DE JOULE
T4 – Appendice 1 DÉTENTES DE JOULE
guide théorique pour l'application de la détente de Joule-Thomson `a la Rq2 : L'expérience réalisée en 1806 par Louis Gay Lussac (1778-1850)
 Problèmes de physique de concours corrigés – 1ère année de
Problèmes de physique de concours corrigés – 1ère année de
Cet exercice présente l'expérience historique de diffusion d'une particule alpha (noyau Au début du siècle les atomes
 CCP Physique 2 MP 2005 — Corrigé
CCP Physique 2 MP 2005 — Corrigé
Thomson à qui l'on attribue également la découverte de l'électron. On cherche à caractériser notamment la réponse de cet atome à une excitation électrique
 Terminale générale - Mouvement dans un champ uniforme - Exercices
Terminale générale - Mouvement dans un champ uniforme - Exercices
Exercice 2 corrigé disponible. Document 1 : La deuxième expérience de Thomson Le physicien anglais Joseph. John Thomson utilisa un tube à vide dans lequel
 DEVOIR COMMUN N°2
DEVOIR COMMUN N°2
TOUT CE QUI EST DEMANDÉ EN ANNEXE NE SERA CORRIGÉ QU'EN ANNEXE. EXERC?CE 1 : EXPERIENCE DE THOMSON… (5 points). Joseph John Thomson. (1856 -1940).
 Lycée Maurice Ravel
Lycée Maurice Ravel
Données de l'expérience : Expliquer comment J.J. Thomson a déduit de son expérience que les ... Corrigé de l'exercice 1 : Champ dans un condensateur.
CORRIGÉ DU BAC BLANC 2016
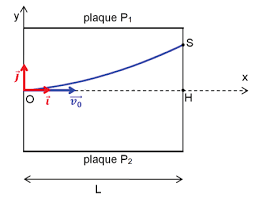
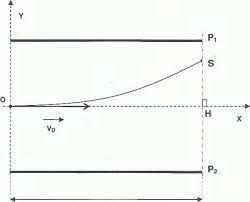
EXERCICE A : LES DÉBUTS DE L'ÉLECTRON EN PHYSIQUE (9 POINTS)1. L'EXPÉRIENCE DE J.J. THOMSON
1.1. Le champ électrique E
E dans un condensateur plan est perpendiculaire aux armatures.La force électrique eF q.E e.E= = -
F q.Ee.E
F q.EF q.E a donc même direction.
L'électron est dévié vers le haut donc la force électrique eFF est orientée de P2 vers P1.
Le champ électrique a un sens opposé car eF e.E= -F e.EF eF edonc orienté de P1 vers P2.
1.2. Système : électron Référentiel : terrestre considéré galiléen
Bilan des forces extérieures : force électrostatique eF e.E= -F e.EF eF e
2ème loi de Newton : ext eF m .aS =
F m .aS =
F mF m soit : ee.E m .a- =
e.E m .ae.E me.E m d'où : e e.Eam-= e.Ea-= e.E x x y y y e ea 0 dv /dt e.E ae.Ea dv /dtm m= = x x a 0x xx x e.a a 0 a 0íïï d'où par intégration :
x 1 y 2 ev C v e.Ev .t Cm= x 1 v C x 1 x 1 v e.E v Cv Cíïï or : ( )
0x 0 1
0y 2v v Cv 0sv 0 C= =
0x 0 1
v v0x 0 1 v 0s( x 0 y ev v dx /dt v e.Ev .t dy/dtm= = x 0 v v x 0 x 0 v e.E v v v víïï d'où par intégration :
0 3 2 4 ex v .t C OM e.Ey t C2.m= + x v OM x v x víïï or : ( )OM 0s 0=
OM 0s 0() donc C3 = C4 = 0
0 2 e(1)x v .t OM e.Ey t(2)2.m= x v OM x vx v1.3. (1) donne :
0 xtv= d'où en remplaçant dans (2) : 2 2 e 0e.Ey .x (3)2.m .v=1.4. Le point S appartient à la trajectoire : ses coordonnées
( )SL,y vérifient l'équation (3) : 2 S 2 e 0e.Ey .L2.m .v= Û 2 2 e 0 S2.m .v .y e.E.L= Û ( ) 27 2211 1 0 S
223 2e2 2,27.10 1,85.102.v .ye1,76.10 C.kgmE.L15,0.10 8,50.10-
Avec les valeurs de l'énoncé :
19 11 1 31ee 1,602176565.101,7588201.10 C.kgm9,1093826.10- Il y a donc un bon accord avec les valeurs actuellement admises. 1.5.
2 2 2 2
On ne garde qu'un CS pour l'incertitude en la majorant : U(e/m) = 7.109C.kg-1 = 0,07.1011C.kg-1 donc :11 -1e/m (1,76 0,07).10 C.kg= ±
1.6. Calculons le rapport suivant :
3 11 14 e e e eFe.E e E 15,0.10. 1,76.10 2,7.10 1P m .g m g 9,8= = = = 1 Le poids de l'électron est donc bien négligeable devant la force électrostatique.2. L'EXPÉRIENCE DE MILLIKAN
2.1. Chute verticale de la gouttelette
2.1.1. Lorsque la vitesse constante v1 est atteinte, le mouvement de la gouttelette est alors rectiligne uniforme donc d'après le
principe d'inertie (ou 1ère loi de Newton) :
extF 0S =F 0S =
F 0F 0 Û P f 0+ =
P f0 P fP f soit en norme : P = f
d'où :16. . .r.v m.gph = Û 1m.gv6. . .r=ph
2.1.2.
212. .g.rv9.r=h Û ( )5 3
619 1,8.10 2,11.10 /10,09. .vr1,4.10 m 1,4µm2. .g 2 890 9,8- -
-´ ´h= = = =r ´ ´2.1.3.
212. .g.rv9.r=h donc si r diminue alors v1 diminue Þ il faut sélectionner une petite gouttelette.
2/42.2. Remontée de la gouttelette
2.2.1. Si la vitesse de descente
212. .g.rv9.r=h est la même c'est donc que le rayon est le même pour les 2 gouttelettes
considérées, les autres paramètres (r, g et h) restants identiques. Comme ( )1 26. . .r. v vqEph += - alors : 2 1q.Ev v6. . .r= - -phComme v
2 est différente pour les 2 gouttelettes et que v1 et r sont identiques, cela implique des charges q différentes.
2.2.2. Calculons le rapport |q| / e pour chaque gouttelette du tableau :
Le rapport calculé est toujours égal à un nombre entier : la charge électrique des gouttelettes est quantifiée.
2.3. Millikan a observé des gouttelettes chargées électriquement qu'il a immobilisées en faisant varier la valeur du champ électrique
tandis que Thompson a observé la déviation d'un faisceau d'électron en maintenant la valeur du champ électrique constante.
EXERCICE B : AUTOUR DE L'ACIDE CROTONIQUE (6 POINTS)1. Détermination de la formule brute de l'acide crotonique
1.1. ( )( )( )x y z
x.M CP CM C H O= Û ( )( ) x y zP C .M C H O0,558 86,0x 4,00M C 12,0´= = =De même :
x y zP H .M C H O0,070 86,0y 6,0M H 1,0´= = = et : ( )( ) x y zP O .M C H O0,372 86,0z 2,00M O 16,0´= = = La formule brute de l'acide crotonique est bien : C 4H6O22. Structure de l'acide crotonique
2.1. 2.2. 2.3.2.4. Règle des (n+1)-uplets : un groupe de protons équivalents possédant n voisins est caractérisé par un signal avec n+1 pics.
2.5. A2 est l'acide 2-méthylprop-2-énoïque :
- suffixe "oïque" : c'est un acide carboxylique - "prop" : chaine principale avec 3 atomes de carbone- "2-én" : présence d'une double liaison C=C entre les carbones n°2 et 3 de la chaine principale
- "2-méthyl" : ramification -CH3 portée par le carbone n°2 de la chaine principale 2.6.Numéro
de la gouttelette Charge q de la gouttelette (C) |q| / e1 -6,4.10-19 4,0
2 -8,0.10-19 5,0
3 -9,6.10-19 6,0
4 -1,6.10-18 1,0
5 -9,6.10-19 6,0
groupe avec 3H1 voisin donc doublet
Þ signal à 1,9ppm
groupe avec 1H1 voisin donc doublet
Þ signal à 5,9ppm
groupe avec 1H4 voisins donc multiplet
Þ signal à 7,1ppm
groupe avec 1H0 voisin donc singulet
H groupe carboxyle donc d
> 8,5ppmÞ signal à 12ppm
groupe carboxyleA1 présente l'isomérie Z/E
A2 ZE : acide crotonique
A2 La molécule présente 4 groupes de protons équivalents : a, b, c et d. Les deux H des groupes (a) et (b) ne sont pas équivalents car ils ne possèdent pas le même environnement chimique : la double liaison C=C entre les carbones n° 2 et 3 empêche la libre rotation autour de cette liaison. L'un (a) reste toujours plus proche du groupe méthyl, l'autre (b) du groupe carboxyle. (a) (b) (c) (d)quotesdbs_dbs1.pdfusesText_1[PDF] experience effet doppler
[PDF] expérience levure et glucose
[PDF] expérience localisation de l'information génétique
[PDF] experience resistance toile d'araignée
[PDF] expertise immobilière guide pratique pdf
[PDF] explication biblique
[PDF] explication de la loi 9-88
[PDF] explication de texte des iles toujours neuves
[PDF] explication de texte descartes discours de la méthode premiere partie
[PDF] explication de texte français
[PDF] explication de texte philo exemple
[PDF] explication de texte philo méthode
[PDF] explication de texte philosophie
[PDF] explication des comptes scf