 TP Spé CHIMIE – chap 03. Eau et énergie :ELECTROLYSE DE LEAU.
TP Spé CHIMIE – chap 03. Eau et énergie :ELECTROLYSE DE LEAU.
Eau et énergie :ELECTROLYSE DE L'EAU. TP réalisé à partir de l'activité expérimentale 1 p.54-55 du manuel Hachette TS Spé (2012).
 TP : ELECTROLYSE : PRODUCTION DE DIHYDROGENE
TP : ELECTROLYSE : PRODUCTION DE DIHYDROGENE
électrolyse de l'eau. Vous trouverez sur le blog de spécialité une vidéo introductive expliquant en quoi le dihydrogène est une énergie d'avenir. Problème
 Correction TP n°5 : LElectrolyse de leau 1. Le tube 1 contient le
Correction TP n°5 : LElectrolyse de leau 1. Le tube 1 contient le
Correction TP n°5 : L'Electrolyse de l'eau. 1. Le tube 1 contient le dioxygène. Il est caractérisé par la façon dont il ravive l'incandescence d'une buchette
 Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
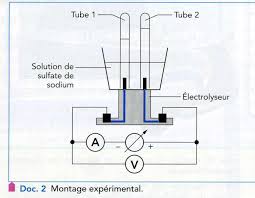
Fig. 1 – Dispositif expérimental de l'électrolyse. • Introduire 150 mL de solution de sulfate de sodium. 2Na+. (aq)
 RENDEMENT DUN ÉLECTROLYSEUR BACCALAURÉAT SÉRIE S
RENDEMENT DUN ÉLECTROLYSEUR BACCALAURÉAT SÉRIE S
Spécialité. RENDEMENT D'UN ÉLECTROLYSEUR. Session. 2019. Page 5 sur 10. DOCUMENTS MIS À DISPOSITION DU CANDIDAT. Document 1 : Électrolyse de l'eau. L'
 TP : Transformations forcées electrolyse
TP : Transformations forcées electrolyse
TP : Transformations forcées electrolyse. Consignes de sécurité de base Verser à l'aide d'un pot de l'eau pour que les electrodes soient juste immergées.
 Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
Séance de Spécialité no 19. Page 5 sur 6. Page 6. 4 Corrigé du TP de la séance no 18 – Dosage du dioxygène o. Réaction des ions manganèse (II) Mn2+ avec les
 Thème eau et environnement Tp « les pluies acides » Type de
Thème eau et environnement Tp « les pluies acides » Type de
Tp « l'électrolyse de l'eau ». Type d'expérience : l'électrolyse. Le Cette année nous avons fais en spécialité un dosage conductimétrique mais vous devez ...
 BACCALAURÉAT GÉNÉRAL
BACCALAURÉAT GÉNÉRAL
L'électrolyse au sel est un procédé de transformation naturel basé sur un cycle qui se renouvelle. D'abord il faut rendre l'eau de la piscine légèrement saline
 TP Spé CHIMIE – chap 03. Eau et énergie :ELECTROLYSE DE LEAU.
TP Spé CHIMIE – chap 03. Eau et énergie :ELECTROLYSE DE LEAU.
TP réalisé à partir de l'activité expérimentale 1 p.54-55 du manuel Hachette TS Spé (2012). L'électrolyse de l'eau est l'une des voies de
 Correction TP n°5 : LElectrolyse de leau 1. Le tube 1 contient le
Correction TP n°5 : LElectrolyse de leau 1. Le tube 1 contient le
Correction TP n°5 : L'Electrolyse de l'eau. 1. Le tube 1 contient le dioxygène. Il est caractérisé par la façon dont il ravive l'incandescence d'une
 TP : ELECTROLYSE : PRODUCTION DE DIHYDROGENE
TP : ELECTROLYSE : PRODUCTION DE DIHYDROGENE
électrolyse de l'eau. Vous trouverez sur le blog de spécialité une vidéo introductive expliquant en quoi le dihydrogène est une énergie d'avenir. Problème :.
 Documents de Physique-Chimie – M. MORIN 1
Documents de Physique-Chimie – M. MORIN 1
Thème : Prévoir l'état final d'un système siège d'une transformation chimique. TP C17 : Forcer le sens d'évolution d'un système. Electrolyse de l'eau.
 RENDEMENT DUN ÉLECTROLYSEUR BACCALAURÉAT SÉRIE S
RENDEMENT DUN ÉLECTROLYSEUR BACCALAURÉAT SÉRIE S
Spécialité. RENDEMENT D'UN ÉLECTROLYSEUR. Session. 2019. Page 5 sur 10. DOCUMENTS MIS À DISPOSITION DU CANDIDAT. Document 1 : Électrolyse de l'eau.
 Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
1 – Dispositif expérimental de l'électrolyse. • Introduire 150 mL de solution de sulfate de sodium. 2Na+. (aq)+ SO2-. 4 (aq)
 Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
Séance de Spécialité no 19 Électrolyse 1 Électrolyse de leau
Pourquoi a-t-on utilisé une solution aqueuse de sul- fate de sodium et non de l'eau pure pour réaliser l'électrolyse de l'eau ? i . Quels sont les porteurs de
 Activités expérimentales Terminale Spécialité
Activités expérimentales Terminale Spécialité
L'objectif de ce TP est de déterminer le degré d'acidité d'un vinaigre en réalisant un produits formés lors d'une électrolyse de l'eau produisant du ...
 TP Terminale
TP Terminale
Ecole alsacienne – TP Spécialité CHIMIE – Michel LAGOUGE L'EAU PEUT ELLE ÊTRE UNE SOURCE D'ENERGIE ? ... A. Electrolyse de l'eau. 1. Etude qualitative.
 LÉLECTROLYSE ET LES APPLICATIONS INDUSTRIELLES
LÉLECTROLYSE ET LES APPLICATIONS INDUSTRIELLES
Term Spécialité PC • Constitution et transformation de la matière Document 7 : L'électrolyse de l'eau : une découverte du XIXe.
 TP Spé CHIMIE chap 03 Eau et énergie :ELECTROLYSE DE L’EAU
TP Spé CHIMIE chap 03 Eau et énergie :ELECTROLYSE DE L’EAU
TP Spé CHIMIE – chap 03 Eau et énergie :ELECTROLYSE DE L’EAU TP réalisé à partir de l’ativité expérimentale 1 p 54-55 du manuel Hachette TS Spé (2012) L’électrolyse de l’eau est l’une des voies de production du dihydrogène Elle est envisagée pour utiliser les surplus de production d’électricité
 RENDEMENT D’UN ÉLECTROLYSEUR BACCALAURÉAT - ECE-BAC
RENDEMENT D’UN ÉLECTROLYSEUR BACCALAURÉAT - ECE-BAC
Michel DELUZARCHE - professeur de chimie en CPGE au lycée Kléber de Strasbourg TP de chimie - année 2010-2011 Électrolyse de l’eau Tracer les courbes i=f(E) pour une solution d’acide sulfurique molaire sur électrode de platine On fera varier E de 01 en 01 V Recommencer en utilisant cette fois une solution molaire de soude
 L’électrolyse de l’eau - F2School
L’électrolyse de l’eau - F2School
L’électrolyse de l’eau est donc une technique qui permet de casser la molécule d’eau en H 2 et O 2 grâce au passage d’un courant électrique Ne pas confondre ave les réa tions d’életrolyse par l’eau très ourantes en chimique organique qui onsiste à ouper une molé ule organique en deux par réa tion himique ave l’eau
 TP N°11 : EXEMPLE DE TRANSFORMATION FORCEES ET APPLICATIONS
TP N°11 : EXEMPLE DE TRANSFORMATION FORCEES ET APPLICATIONS
II Expérience 2 : Aspect quantitatif d'une électrolyse : électrolyse de l'eau en milieu acide : 1) Manipulation : a Introduire 250 mL d'eau distillée dans l'électrolyseur b Remplir les 2 tubes gradués avec de l'eau distillée et les retourner sans bulles d'air sur les électrodes
 Physique Chimie RENDEMENT D’UN ÉLECTROLYSEUR - RMSPC
Physique Chimie RENDEMENT D’UN ÉLECTROLYSEUR - RMSPC
Problématique :l’électrolyse est une méthode expérimentale qui consiste à convertir de l’énergie électrique en énergie chimique Il est par exemple possible à partir d’énergie électrique de séparer les composants de l’eau (l’hydrogène et l’oxygène) Une telle conversion a lieu dans un électrolyseur
 Electrolyse de l'eau - F2School
Electrolyse de l'eau - F2School
Lycée Émile LOUBET Electrolyse de l'eau - TP 1°S - Energie NOM : Prénom : Classe : Note : Appréciation : 2 Faites les mesures 3 Tracer la courbe Électrolyse 1 Réaliser le montage en plaçant les tubes à essais plein d'eau sur les électrodes 2 Noter la température de l'eau 3
 Chapitre IV Electrolyse de l'eau
Chapitre IV Electrolyse de l'eau
Electrochimie Préparative (UEF12) Chapitre IV Electrolyse de l'eau ) 11 5 -Electrolyse acide à Membrane Polymère Solide PEM ( PEM : Proton Exchange Membrane) La plus ancienne façon de réaliser l’électrolyse de l’eau consiste à faire passer un courant électrique dans une solution à 15 en acide sulfurique
 Les compétences travaillées dans le cadre de la démarche
Les compétences travaillées dans le cadre de la démarche
Modéliser et schématiser à partir de résultats expérimentaux les transferts d’électrons aux électrodes par des réactions électrochimiques Déterminer les variations de quantité de matière à partir de la durée de l’électrolyse et de la valeur de l’intensité du courant
 THEME 1 :L’EAU CORRECTION TP n°7 - wifeocom
THEME 1 :L’EAU CORRECTION TP n°7 - wifeocom
THEME 1 :L’EAU CORRECTION TP n°7: Comment produire du dihydrogène ? I Présentation 1°> Équations des réactions mises en jeu lors de la conversion du méthane : CH 4 (g) + H 2 O (g) CO (g) + 3 H 2 (g) CO (g) + H 2 O (g) CO 2 (g) + H 2 (g) Le bilan de ces deux réactions s’écrit : CH 4 (g) + 2 H 2 O (g) CO 2 (g) + 4 H 2 (g) 2°> C n H
 TP Terminale S Spécialité Sciences Physiques SÉPARATION ET
TP Terminale S Spécialité Sciences Physiques SÉPARATION ET
TP Terminale S Spécialité Sciences Physiques - 3 - TS Spécialité Chimie TP - Michel LAGOUGE D- Élimination des ions fer (III) Industriellement l’hydroxyde de fer (III) est pratiquement impossible à filtrer pour palier cette difficulté on utilise le plus souvent le procédé « à la jarosite »
 Searches related to electrolyse de l+eau tp spécialité filetype:pdf
Searches related to electrolyse de l+eau tp spécialité filetype:pdf
Activité : Electrolyse de l’eau Spécialité Terminale Mélanie Gendre – Physique-Chimie Spécialité Terminale – Lycée International de Saint Germain en Laye But de l’activité: Découvrir le principe d’une transformation chimique forcée Document 1 : L’électrolyse de l’eau
Comment réussir l’électrolyse?
- Spécialité RENDEMENT D’UN ÉLECTROLYSEURSession 2019 Page 8 sur 10 2. Électrolyse (20 minutes conseillées) Schéma de l'électrolyse : En utilisant le montage mis à disposition : • remplir convenablement l’électrolyseur de solution de sulfate de sodium ; mais ne pas encore positionner les éprouvettes graduées au dessus des électrodes ;
Comment faire une électrolyse de l'eau en milieu acide ?
- II Expérience 2 : Aspect quantitatif d'une électrolyse : électrolyse de l'eau en milieu acide : 1)Manipulation : a. Introduire 250 mL d'eau distillée dans l'électrolyseur. b. Remplir les 2 tubes gradués avec de l'eau distillée et les retourner, sans bulles d'air , sur les électrodes. c.
Comment fonctionne l'évaluation d'un électrolyseur?
- • Lors de l’appel n°1, l’évaluateur vérifie que l’élève a retrouvé l’expression du rendement de l’électrolyseur en fonction de grandeurs physiques mesurables. Il vérifie également que l’élève sait comment mesurera ces grandeurs. • Lors de l’appel n°2, l’évaluateur vérifie le montage de l'électrolyse et les
Quels sont les avantages de l’électrolyseur?
- Le CEA-Liten a annoncé la validation d’un système de production de dihydrogène par électrolyse de l’eau à haut rendement : plus de 90 %, contre 70 à 85 % pour les électrolyseurs industriels classiques. Moins médiatique que la pile à combustible, l’électrolyseur est un élément clé du
Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 1Nom Coéquipier
ÊTRE ?
Objectif et questionnement : -
inconvénients ? Remarque : toutes les expériences sont des expériences collectives A.1. Etude qualitative
Expérience 1 : réactions aux électrodes
Soit le dispositif suivant :
BBT pKa = 7 acide => jaune basique => bleu http://fr.wikipedia.org/wiki/Bleu_de_bromothymol
Video : http://www.youtube.com/watch?feature=player_embedded&v=VY9xTrIzAmIQuestions
1) Quelle est la couleur de la solution dans chaque bécher avant de faire circuler le courant électrique ?
2) Après avoir fait circuler le courant électrique quelques minutes, noter les observations relatives aux couleurs dans
chaque bécher.Cathode : Anode :
3) Interprétez les observations faites
a) -basicitéCathode : Anode :
b) Réactions aux électrodesCathode : Anode :
Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 2Expérience 2 : étude avec électrolyseur
Soit le dispositif suivant :
solution acide sulfurique environ molaireOn augmente progressivement la
tension U délivrée par le générateur extérieurQuestions
4) - ?
5) -t-on dans les deux tubes à dégagement ? Y a-t-il une relation entre les volumes de gaz dégagés
respectivement sur chaque électrode ?6) Proposez une expérience simple permettant de mettre en évidence la nature du gaz respectivement dégagé sur chaque
électrode.
7) Interprétez ( le rapport des volumes de
gaz dégagés respectivement sur chaque électrode2. Etude quantitative
Considérons une intensité I = 0,30 A circulant pendantQuestions
8) Etablir - donc détailler le raisonnement !- littérale de V(O2) -ou V(H2) du volume de gaz dégagé à
chaque électrode en fonction de I et9) Un thermomètre a été placé dans la salle : quelle peut être son utilité dans ?
10)V(O2 V(H2
Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 3B. Pile à hydrogène
façon réversible soit en électrolyseur soit en pile à hydrogène.Le matériel présenté sur la paillasse professeur est un système simplifié par rapport à la photographie ci-dessous : le
même module peut fonctionner de façon réversible (électrolyseur Ù pile) alors que sur la photographie ci-dessous, les
dans les deux modes de fonctionnement..Questions
11) Sur la photographie ci-dessus, repérer les différentes parties
(1) (2) (3) (4) (5) (6) 12) ?............(1) ?............(2) ?............(3) ?............(4)13) Expliquer brièvement quelle est, dans cette chaîne de transformation énergétique, le rôle des réservoirs gazeux ?
En pratique, on s
" inépuisable ».Voir la video résumant le fonctionnement: http://www.h-tec.com/fr/education/service/materiel-pedagogique/
Un autre dispositif : http://www.youtube.com/watch?v=d0gjpF8taDk (1) (2) (3) (4) (5) (6)Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 41. Fonctionnement en électrolyse : " recharge » de la batterie
¾ Voir le tableau 1
Questions
14) Le graphe du tableau 1 est-il cohérent avec la réponse apportée à la question 4) ?
15) s unités
correspondantes. Remarque : La théorie donne comme valeur de tension Useuil phénomènes de surtension sur les électrodes. caractéristique " idéale » correspondante17) r = Energie chimique produite
Energie électrique consommée
electrolyseur pQHUJLH pQHUJLH littéral r = AN : r =¾ Voir le tableau 2
Données : Qdiss_liq = 285,8 kJ.mol-1
Volume molaire à 25 °C sous Pression atmosphérique V0 = 24,45 L. mol-1Questions
18) Du graphe du tableau 2, déduire vfor: la vitesse de formation du diDétailler le
raisonnement fait et préciser les unités des grandeurs considérées.19) ssion de PchimQdiss_liq et vfor.
20) Déduire le rendement expérimental rexp
Littéral rexp
AN : rexp
21) Le résultat est-il cohérent avec la réponse apportée à la question 17) ?
Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 52. Fonctionnement en générateur : " décharge » de la batterie
Une photographie de la manipulation sur la
paillasse professeur¾ Voir le tableau 3
Données : Qdiss-gaz = 241,8 kJ.mol-1
Volume molaire à 25 °C sous Pression atmosphérique V0 = 24,45 L. mol-1Questions
22) Ecrire les équations chimiques respectives globales lors du fonctionnement du module en
Electrolyseur Générateur
Equation chimique :
23) Du graphe du tableau 3, déduire vdisp : la vitesse de disparition du dihydrogène lors du fonctionnement en pile.
Détailler le raisonnement fait et préciser les unités des grandeurs considérées.24) chim, la puissance chimique consommée par la pile en fonction de Qdiss-gaz et vdisp.
25) Déduire le rendement expérimental rexp de la pile
Littéral rexp
AN : rexp
26) Analyser le bilan énergétique des différentes opérations étudiées (électrolyse et pile) et faites une analyse commentée
de ces bilans. Et répondre à la question énoncée dans le titre.Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 6 Annexe Module électrolyseur Ù Pile à hydrogène Données constructeur (Site : http://www.h-tec.com/fr/education/ ) Module électrolyseur (Remarque : le constructeur demande de ne pas dépasser U = 2 V)Tableau 1
U/V I/V
0,1 0,2 0,3 0,4 1,3 1,5 1,6 1,7 1,8 1,9 2,0 0 0 0,03 0,21 0,41 0,63 0,87 1,06Tableau 2
t/s V(H2)/mL 0 4080
119
160
200
238
0 5,0 10,0 15,0 20,0 25,0
30,0
Module Pile à hydrogène Tableau 3
t/s V(H2)/mL 0 175356
534
712
30,0
25,0
20,0 15,0 10,0
Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 7C. Etude documentaire (étude complémentaire et résumé critique des études précédentes)
Les piles à combustible : mythe ou réalité ? (doc de ac-grenoble.fr)I- Généralités
1- - - - comburant ?
2- - ?
3- A quoi sont utilisées les combustions ? A quoi servent les piles ?
3- Est-ce que les combustions et les piles sont utilisées dans le même objectif ?
4- Pourquoi parle-t-on de pile à combustible ?
5- Qui était le précurseur des piles à combustible ? A quelle époque travaillait-il ? Que vous inspire cette réponse ?
II- Les piles à combustibles, ça fonctionne comment ? -oxygène est très simple. Une cellule de réaction estcomposée de deux électrodes séparées par un électrolyte. Cet électrolyte est une membrane qui permet le passage des protons
H+, mais qui empêche les électrons de passer.Schéma de la pile :
Dans le cas de notre exemple, on utilise la pile à combustible pour alimenter une lampe.1- Quelle est la nature des porteurs de charge dans le circuit extérieur à la pile ?
2- Indiquer sur le schéma le sens de déplacement conventionnel du courant électrique I, ainsi que le sens de
On donne les demi-couples des espèces chimiques mises en jeu :H+/H2 O2/H2O
3- Pour chaque couple mis en jeu, écrire les demi-équations électroniques en milieu aqueux acide.
4- bite.
5- -ils ? Les dessiner sur le schéma avec leur sens de déplacement. réservoir de H2 contenant du O2électrolyte
laissant passer les H+électrodes
Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 8 Le dihydrogène est appelé " combustible » de la pile.6- Quelle transformation chimique subit le dihydrogène. Pourquoi est-il appelé combustible ?
7- -ce le pôle positif ou négatif de la pile ?
Compléter le schéma en nommant les deux électrodes. III- Les piles à combustible, ça marche ou pas ? A partir des trois textes distribués, répondre aux questions suivantes : 1- ?2- Quels sont les g ?
3- Quels sont les principaux avantages des piles à combustible ?
4-Convertir 1kWh en joules.
6- Relever les polluants locaux cités dans le texte de Jean-Marc JANCOVICI ? Quels sont leurs effets ?
5- ?6- Quels sont les moyens de production du dihydrogène ?
7-8- Parmi ces moyens, lesquels respectent le développement durable ?
9- Selon vous, les piles à combustible est-ce un mythe ou une réalité ?
IV- Quelques petites applications :
1- Calculer la charge électrique Q libérée en 24 heures. En déduire la quantité de matière des porteurs de charge ayant transité dans le circuit.2- Dans une voiture de tourisme, on estime à 0,60 kg la masse de dihydrogène nécessaire pour effectuer 100 km.
Calculer le volume en m3
pression. Rappeler la loi des gaz parfaits en précisant les unités des grandeurs mises en jeu. Proposer alors une
méthode pour diminuer à température ambiante le volume occupé par le dihydrogène.3- Remplir le tableau suivant :
Terme Définition Exemple dans la pile à combustible O2 électrode où se produit la réduction borne + de la pile combustible anode espèce susceptible de céder des électrons fin de réactionO2 + 2e- + 2H+ = 2 H2O
rendement Données : M(H) = 1,00 g.mol-1 ; M(O) = 16,0 g.mol-1 A = 6,02.1023 mol-1 ;charge élémentaire e = 1,6.10-19 C ; Faraday 1 F = 96500 C.mol-1 Volume molaire (conditions : 20°C et Patm) = 24,0 L.mol-
1.Terminale S Spécialité CHIMIE
Ecole alsacienne Ȃ TP Spécialité CHIMIE Ȃ Michel LAGOUGE Page 9quotesdbs_dbs21.pdfusesText_27[PDF] electronique analogique diode exercices corrigés pdf
[PDF] electronique analogique exercices corrigés transistor
[PDF] electronique analogique exercices et problèmes corrigés pdf
[PDF] electronique de puissance cours complet
[PDF] electronique de puissance cours gratuit
[PDF] electronique de puissance cours pdf
[PDF] électronique de puissance définition
[PDF] electronique de puissance exercices corrigés pdf
[PDF] electronique de puissance thyristor pdf
[PDF] electronique embarquée automobile pdf
[PDF] electronique generale exercice corrigé
[PDF] electronique numerique cours et exercices corrigés pdf
[PDF] electronique numerique definition
[PDF] électronique numérique en 26 fiches pdf
