 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB. 1/ Chimie : organisation et transformation de la matière a) Atomes molécules et ions. Un atome est
 Fiche de revision physique chimie 3eme pdf 2017
Fiche de revision physique chimie 3eme pdf 2017
Fiche de revision physique chimie 3eme pdf 2017. Fysik 3. Fysik åk 9. Cours complet de Troisième (Version 2017) Ensemble des fiches de révision Quelques
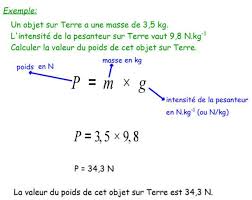 FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE
FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE
FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE BREVET. Formule à connaître : Formules « annexes » : Exemple : Page 1 sur 4
 Fiches DNB
Fiches DNB
Fiche de révision du brevet réalisée par les 5ème A pour les 3ème : LES MELANGES Schématiser tous les objets physiques (1 et. 2) en plaçant l'objet étudié au ...
 brevet : révisions de svt
brevet : révisions de svt
Les responsables sont les sucres et les lipides (cholestérol) le tabac et le manque d'activité physique. Page 23. Collège de Varens Passy. Page 23. Les
 fiche-gravitation-universelle-poids-et-masse.pdf
fiche-gravitation-universelle-poids-et-masse.pdf
Fiche révision collège cycle 4. La gravitation universelle le poids et la masse. la gravitation universelle. ➢ qu'est-ce que la gravitation universelle
 Fiche revision brevet blanc
Fiche revision brevet blanc
Fiche de revision francais brevet blanc 2022. Fiche revision brevet blanc physique chimie. Fiche revision brevet blanc math. Fiche de revision 3eme histoire
 FICHE METHODE : LA DEMARCHE SCIENTIFIQUE
FICHE METHODE : LA DEMARCHE SCIENTIFIQUE
d'un phénomène physique. 2ème étape : HYPOTHESE. • Dans cette partie vous devez donner votre avis à priori (c'est-à-dire avant d'avoir réalisé quelque.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB. 1/ Chimie : organisation et transformation de la matière a) Atomes molécules et ions.
 Fiche de révisions sur les acides et les bases
Fiche de révisions sur les acides et les bases
C – Comparons la force des acides et des bases : Puisque TOUS les acides forts se dissolvent entièrement dans l'eau ils sont TOUS aussi forts les uns que.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB. 1/ Chimie : organisation et transformation de la matière a) Atomes molécules et ions.
 Fiches DNB
Fiches DNB
Fiche de révision du brevet réalisée par les 5ème A pour les 3ème : LES MELANGES. MÉLANGE : un mélange est constitué de plusieurs molécules différentes
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
La seule espèce colorée est le diode I?2(aq)? . Initialement le système chimique contient 30 mol de diiode et 5
 fiche révision physique 2013
fiche révision physique 2013
PHYSIQUE CHIMIE. TERMINALE S. FICHES DE REVISION PHYSIQUE 3ème loi de Newton (ou principe des actions réciproques) : si A et B sont deux objets en.
 Fiche de révision Solutions acides et basiques Physique Chimie 3 I
Fiche de révision Solutions acides et basiques Physique Chimie 3 I
Fiche de révision. Solutions acides et basiques. Physique Chimie 3 ème. I. Définitions. - pH d'un liquide inférieur à 7 : acide.
 Bookmark File PDF Fiche 1 D Exercices Chap 4 Statistiques 2016
Bookmark File PDF Fiche 1 D Exercices Chap 4 Statistiques 2016
il y a 8 jours d'exercices CORRIGES sur les Puissances : Fiche de REVISION (PDF) ... Ressources Scolaire Physique-Chimie Exos - Physique 3ème Exercices.
 Fiche révision brevet de chimie Toutes les parties doivent être
Fiche révision brevet de chimie Toutes les parties doivent être
Il faut savoir refaire les exercices vus en cours. Compétences du socle. Partie du cours. Notions de molécules atomes. Interpréter une formule chimique en.
1/ Chimie : organisation et transformation de la matière
a) Atomes, molécules et ions8Q MPRPH HVP ŃRQVPLPXp G·XQ QR\MX MXPRXU GXTXHO JUMYLPHQP GHV pOHŃPURQVB
Une molécule est constituée de plusieurs atomes.Modèle de
O·MPRPH
Nom Carbone Hydrogène Oxygène Azote
Symbole C H O N
La molécule contient 2 atomes de
carbone, 6 atomes d'hydrogğne et1 atome d'odžygğne
Electrons : chargés -
Protons : chargés +
Neutrons : charge 0
GHVŃULSPLRQ G·XQ MPRPH :
Quasiment toute la masse est contenue dans le noyau.IM PMLOOH GX QR\MX § 10-15 m OM PMLOOH GH O·MPRPH § 10-10 m AE un noyau est environ
100 000 IRLV SOXV SHPLP TXH O·MPRPHB
I·MPRPH M XQH VPUXŃPXUH lacunaire : entre les électrons et le noyau, il y a du vide.Un atome est électriquement neutre : il y a donc autant de protons (chargés Ą TXH G·pOHŃPURQV
(chargés -). Les atomes (et noyaux) sont représentés par un symbole :Atome Nombre de
protons (Z)Nombre
G·pOHŃPURQV
Nombre de
neutronsCarbone
Sodium
Les 118 atomes différents sont classés dans le tableau périodique des éléments par numéro atomique Z croissant
(18 colonnes et 7 lignes). AtomeMolécule
C2H6OUn LRQ HVP XQ MPRPH RX JURXSH G·MPRPHV TXL M SHUGX RX JMJQp XQ RX SOXVLHXUV pOHŃPUons. Il y a donc
des :Ions positifs appelés CATIONS $PRPH RX JURXSH G·MPRPHV TXL M 3(5G8 GHV pOHŃPURQVB ([ )H2+, Fe3+, Al3+"
Ions positifs appelés ANIONS $PRPH RX JURXSH G·MPRPHV TXL M *$*1( GHV pOHŃPURQVB ([ FO-, F-, SO42-"
Formation d'un ion positif AE cation Formation d'un ion nĠgatif AE anion1RP LRQ" )RUPXOH ŃOLPLTXH GH O·LRQ 3HUPH RX JMLQ G·H- nb de charges " + » nb de charges " - »
aluminium (III) Al3+ perte de 3 e- 13 10 fer(III) Fe3+ perte de 3 e- 26 23 fer (II) Fe2+ perte de 2 e- 26 24 chlorure Cl- JMLQ G· 1 H- 17 18 b) Identification des ionsUne solution est toujours électriquement neutre : il y a autant de charges positives que de charges négatives.
Une sROXPLRQ LRQLTXH V·pŃULP LRQ + + ions -)Exemples : sulfate de cuivre II : (Cu2+ + SO42²) Chlorure de fer III : (Fe3+ + 3 Cl-)
3RXU LGHQPLILHU GHV LRQV RQ SHXP XPLOLVHU GHV UpMŃPLIV VRXGH QLPUMPH G·MUJHQP TXL YRQP GRQQHU GHV SUpŃLSLPpV
de couleurs. (Le PMNOHMX VXLYMQP Q·HVP SMV j MSSUHQGUHBIon Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn2+Aluminium
Al3+Réactif
utiliséNitrate
G·MUJHQP
(Ag+ +NO3)Soude ou hydroxyde de sodium (Na+ + HO-)
Précipité
obtenuBlanc qui
noircit à la lumièreBleu Vert kaki Marron-orangé blanc blanc
Exemples :
Les réactions chimiques
qui ont lieu entre le réactif et la solution sont :Cu2+ + 2 OH- Cu(OH)2
Ag+ + Cl- AgCl
Zn2+ + 2 OH- Zn(OH)2
Un précipité est un
solide. c) pH : solutions acides et basiquesUne solution est acide si son pH est inférieur à 7. L'aciditĠ est due ă l'ion hydrogène H+
Une solution est basique si son pH est supérieur à 7. La basicitĠ est due ă l'ion
hydroxyde HO-.On mesure le pH avec :
Ö Du papier pH
Ö Un indicateur coloré acido-basique comme le jus de chou rouge, qui change de couleur en fonction du pH.
Ö Un pH-mètre MSSMUHLO pOHŃPURQLTXH TX·RQ PUHPSH GMQV OM VROXPLRQ HP TXL MIILŃOH OM YMOHXU GX
pH.Remarque IRUVTX·RQ GLOXH XQH VROXPLRQ MÓRXP G·HMX SXUH), son pH se rapproche toujours de 7.
d) Réaction entre un acide et une base4XMQG RQ IMLP UpMJLU GH O·MŃLGH ŃOORUO\GULTXH + Ą Ą FO-) et une solution
G·O\GUR[\GH GH VRGLXP 1M Ą Ą +2-), une réaction chimique a lieu et dégage beaucoup de chaleur.H+ + HO- AE H2O
e) Réaction entre un acide et un métal Un métal est un bon conducteur thermique et électrique. Il est recyclable.5pMŃPLRQ HQPUH GH O·MŃLGH ŃOORUO\GULTXH HP OH IHU
2 H+ + Fe H2 + Fe2+
Dihydrogène explosif : quand on approche une allumette : détonation " POP »5pMŃPLRQ HQPUH GH O·MŃLGH ŃOORUO\GULTXH HP OH zinc :
2 H+ + Zn H2 + Fe2+
5pMŃPLRQ HQPUH GH O·MŃLGH ŃOORUO\GULTXH HP O·MOXPLQLXP
6 H+ + 2 Al 3 H2 + 2 Al3+
5pMŃPLRQ HQPUH GH O·MŃLGH ŃOORUO\GULTXH HP O·RU C MUJHQP C ŃXLYUH 5H(1
IHV LRQV TXL QH UpMJLVVHQP SMV VRQP GLPV VSHŃPMPHXUV RQ QH OHV pŃULP SMV GMQV O·pTXMPLRQ GH OM UpMŃPLRQ ŃOLPLTXHB
Lors de la réaction entre un acide et un métal, Les ions hydrogène H+ de O·MŃLGH UpMJLVVHQP MYHŃ OH PpPMO pour
donner du dihydrogène gazeux H2 et O·LRQ PpPMOOLTXH.IRUV G·XQH UpMŃPLRQ ŃOLPLTXH
- Il y a conservation de la masse ŃMU OHV MPRPHV VRQP ŃRQVHUYpV LO \ M MXPMQP G·MPRPHV G·O\GURJqQH GH
chaque côté du signe " »)- Il y a conservation des charges électriques (il y a autant de + et de ² de chaque côté).
f) Autres transformations chimiques : A chaque fois, il faut veiller à la conservation des atomes de chaque côté du " = ».Combustion du carbone : C + O2 CO2
Combustion du méthane : CH4 + 2 O2 CO2 + 2 H2O Combustion du propane : C3H8 + 5 O2 3 CO2 + 4 H2O FRPNXVPLRQ GH O·pPOMQRO F2H6O+ 3 O2 2 CO2 + 3 H2O6\QPOqVH GH O·MU{PH de banane : C5H12 O + C2H4O2 C7H14O2 + H2O
g) Masse volumique :Exemple :
Un matériau appelé Hassium est un des plus dense sur Terre. Un morceau de volume V= 1200 cm3 = 1,2 L a
XQH PMVVH P 48E NJB FMOŃXOH OM PMVVH YROXPLTXH ǒ GH O·OMVVLXP HQ JCŃP3 et kg/m3 ǒ PC9 48 E00 C1200 40,8 g/cm3 = 40 800 kg/m3 h) Différents états de la matièreEtat Solide Liquide gazeux
5HSUpVHQPMPLRQ j O·MLGH
du modèle molécule (QVHPNOH" Compact et ordonné Compact et désordonné Dispersé et très désordonnéMolécules Liées, quasi immobiles
et rapprochéesUn peu liées, mobiles et
très rapprochéesNon liées, éloignées, en
mouvement rapidePossqGH XQ" Volume propre, une
forme propre Volume propre i) Atmosphère terrestre I·MLU HVP XQ mélange de plusieurs gaz : sa composition est78% de diazote N2 : on arrondira à 80 % soit 4/5.
21% de dioxygène O2: on arrondira à 20% soit 1/5.
1 G·MXtres gaz : le dioxyde de carbone CO2 O·MUJRQ $U
le dihydrogène H2" Le dioxygène O2 est un gaz indispensable à la respiration et auxŃRPNXVPLRQV"
I·MLU M XQH PMVVH 1 I G·MLU SqVH HQYLURQ 1 J - 1 OLPUH G·HMX SqVH 1 NJ j) Différence entre transformation physique, transformation chimique, mélange- Une transformation physique est le SMVVMJH GH OM PMPLqUH G·XQH IRUPH j XQH MXPUHB HO \ M ÓXVPH XQ
ŃOMQJHPHQP G·MVSHŃP GH IRUPHB $PRPHV HP PROpŃXOHV QH ŃOMQJHQP SMVB ([ YMSRULVMPLRQ VROLGLILŃMPLRQ
érosLRQ"
- Une transformation chimique est le passage d'une espèce chimique à une nouvelle espèce chimique.
Les espèces chimiques de départ, appelées REACTIFS, se transforment en nouvelles espèces chimiques
appelées PRODUITS. Le phénomène permettant cette transformation chimique est appelé réaction
chimique. Exemples : décomposition, synthèses, oxydations, précipitations, certaines dissolutions. - Un mélange est juste une mise en commun de deux corps ensemble. Ex : huile + vinaigre. k) Différence entre transformation physique, transformation chimique, mélangeTests caractéristiques
Gaz Test
Dihydrogène
H2Détonation à
O·MSSURŃOH G·XQH
allumetteDioxyde de
carbone CO2Eau de chaux qui
se troubleEteint une flamme
de bougieDichlore Cl2 Gaz de couleur
verte qui pueDioxygène O2 Ravive une flamme
ou une braise (Liquide ou gaz)Eau H2O
Sulfate de cuivre
anhydre qui devient bleu2/ Energie
I·pQHUJLH HVP XQ ŃRQŃHSP MNVPUMLP TXL TXMQPLILH OM ŃMSMŃLPp G·XQ RNÓHP j HIIHŃPXHU GHV PUMQVIRUPMPLons.
I·pQHUJLH VH transfère et se transforme.
Unité officielle (SI) : le Joule (J).
a) 6RXUŃHV G·pQHUJLH IRUPHV G·pQHUJLHIHV VRXUŃHV G·pQHUJLH renouvelables VRQP GHV VRXUŃHV G·pQHUJLH inépuisables à O·pŃOHOOH GH O·OXPMQLPp
Soleil, eau, chaleur de la Terre (géothermie), vent, biomasseIHV VRXUŃHV G·pQHUJLH non- renouvelables VRQP GHV VRXUŃHV G·pQHUJLH épuisables à O·pŃOHOOH GH O·OXPMQLPpB
Il y a en 2 types :
o Sources fossiles : pétrole, gaz, charbon. o Source nucléaire : Uranium.IM IRUPH G·pQHUJLH ŃRUUHVSRQG MX P\SH G·pQHUJLH potentielle de position, cinétique, électrique,
lumineuse, ŃOLPLTXH POHUPLTXH PpŃMQLTXH QXŃOpMLUH PXVŃXOMLUH"6RXUŃH G·pQHUJLH )RUPH G·pQHUJLH
Pétrole, gaz, charbon Energie chimique
Uranium Energie nucléaire
Vent Energie cinétique (ou éolienne)
Soleil Energie lumineuse ( ou solaire)
Chaleur de la Terre Energie thermique (ou géothermique)Biomasse Energie chimique
Eau Energie cinétique ( ou hydraulique)
b) FRQYHUVLRQ G·pQHUJLHEx : pile qui alimente une lampe
8QH SLOH HVP XQ ŃRQYHUPLVVHXU G·pQHUJLH ŃOLPLTXH HQ pQHUJLH
électrique.
Ex : dynamo qui alimente une lampe
8Q MOPHUQMPHXU HVP XQ ŃRQYHUPLVVHXU G·pQHUJLH ŃLQpPLTXH HQ
énergie électrique.
c) Transfert d·pQHUJLH Il existe plusieurs façons GH PUMQVIpUHU G·XQ corps à un autre corps :ª Le PUMYMLO G·XQH IRUŃH.
ª Le transfert thermique par :
Conduction : sans transport de matière, du corps chaud vers le corps froid. Convection : avec transport de matière, entre des fluides chauds et froids. Rayonnement : par des ondes électromagnétiques. d) 3URGXŃPLRQ GH O·pQHUJLH pOHŃPULTXHIHV ŃHQPUMOHV pOHŃPULTXHV SURGXLVHQP O·pOHŃPULŃLPp GH OM PrPH PMQLqUH 2Q IMLP PRXUQHU XQH turbine (avec de la
YMSHXU G·HMX GX YHQP TXL IMLP PRXUQHU O·MLPMQP G·XQ alternateur.Aimant = Rotor
bobine statorAlternateur
Un alternateur HVP ŃRQVPLPXp G·XQ aimant + une bobine. I·MLPMQP MSSHOp URPRU PRXUQH GMQV XQH NRNLQH VPMPLTXH MSSHOpH 6PMPRUB Un alternateur est un ŃRQYHUPLVVHXU G·pQHUJLH ŃLQpPLTXH RX mécanique) en énergie électrique (Q 2016 HQ )UMQŃH 723 GH O·pQHUJLH pOHŃPULTXH SURYLHQP GHV ŃHQPUMOHV nucléaire et 19,1 % (eau, vent, bois, déchets, soleil) provient de sourcesG·pQHUJLH UHQRXYHOMNOHVB
2Q XPLOLVH OHV VRXUŃHV G·pQHUJLH Uenouvelables ou non renouvelable pour
IMNULTXHU GH OM YMSHXU G·HMX TXL IHUM HQVXLPH PRXUQHr la turbine puisquotesdbs_dbs13.pdfusesText_19[PDF] fiche de revision physique chimie terminal stl
[PDF] fiche de revision ressources humaines
[PDF] fiche de révision science de l'ingénieur terminale s
[PDF] fiche de revision ses 1ere es
[PDF] fiche de revision statistique 3eme
[PDF] fiche de revision sur emile zola
[PDF] fiche de révision sur la chine depuis 1911
[PDF] fiche de revision svt 3eme pdf
[PDF] fiche de revision svt brevet 2017 pdf
[PDF] fiche de seance saut en longueur
[PDF] fiche de séquence pédagogique
[PDF] fiche de séquence pédagogique vierge
[PDF] fiche de synthèse bac musique
[PDF] fiche de traçabilité entretien des locaux