 Fiche dexercices : Révision 2 : Changement détat - Compétences
Fiche dexercices : Révision 2 : Changement détat - Compétences
Quelle est son unité ? 3-. Quel est l'état physique de l'eau au début de l'expérience (solide liquide ou gazeux)
 CH.7 LES CHANGEMENTS DÉTATS – exercices
CH.7 LES CHANGEMENTS DÉTATS – exercices
c) Que contient le bécher au bout de 10 min ? On est encore sur le palier donc toujours de l'eau liquide et de la glace
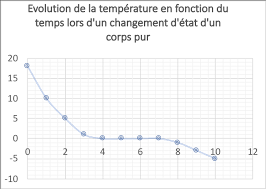
 Fiche dexercices : Révision 2 : Changement détat - Compétences
Fiche dexercices : Révision 2 : Changement détat - Compétences
A partir de ses mesures elle a réalisé le graphique suivant. 1-. Quelle grandeur physique a-t-elle porté sur l'axe vertical ? Quelle est son unité ?
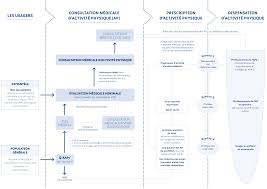 Consultation et prescription médicale dactivité physique à des fins
Consultation et prescription médicale dactivité physique à des fins
Il doit y avoir au moins un jour de repos en interséance. Selon la pathologie ou l'état de santé ciblé d'autres types d'exercices peuvent être associés : des.
 Chapitre 2. Les changements détat Exercices supplémentaires
Chapitre 2. Les changements détat Exercices supplémentaires
En s'inspirant du cycle de l'eau rédiger un court texte décrivant la formation du brouillard. Page 3. Physique Chimie Cycle 4 © Nathan 2017. Exercice 3. Du sel
 Maquette ePub
Maquette ePub
Lorsqu'un mélange change d'état sa température ne reste pas constante au cours du temps
 Fiche dexercices : LES ÉTATS DE LA MATIÈRE ET LEURS
Fiche dexercices : LES ÉTATS DE LA MATIÈRE ET LEURS
Complétez le tableau des changements d'état ci-dessous. Nom du changement d'état. État initial. État final. Solidification. Liquide. Solide.
 Guide des connaissances sur lactivité physique et la sédentarité
Guide des connaissances sur lactivité physique et la sédentarité
13 juil. 2022 Le taux de progression va dépendre de l'état de santé de la condition physique et des ré- ... L'exercice physique est une AP planifiée ...
 C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
Dans quel état physique ? 7 Choisir les affirmations exactes. Recopie la chapitre 5 / Étude des changements d'état. Exercice 12. Boîte à idées. Lors de ...
 Exercice 3. Le diagramme de changement détat de lhélium
Exercice 3. Le diagramme de changement détat de lhélium
10 juil. 2013 1) Quel est l'état physique de l'hélium dans un ballon de fête foraine gonflé à 12 bar ? Page 2. L'hélium est gazeux sous la pression de ...
 exercices 7 correction
exercices 7 correction
La sonde indique 100°C car lors du changement. (liquide/vapeur) la température reste au palier. 100°C. La masse ne varie pas au cours d'un changement d'état.
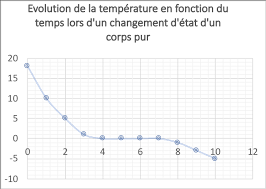
 Fiche dexercices : Révision 2 : Changement détat - Compétences
Fiche dexercices : Révision 2 : Changement détat - Compétences
Exercice 1 : Reconnaitre des courbes de changement d'état. 1- A quelle transformation correspond chacune Quel est l'état physique de l'eau au début de.
 Exercices de Thermodynamique
Exercices de Thermodynamique
Ce fut la grande tâche et la grande gloire de la physique du XIXe siècle 1) D'apr`es l'équation d'état du gaz parfait le nombre de molécules par unité ...
 Reaction chimique - Thermodynamique - Cinétique
Reaction chimique - Thermodynamique - Cinétique
Remarque : s'il s'agit d'un changement d'état physique on parle de transformation physique. I - Equation d'une réaction chimique.
 Exercices - Chimie 5.2 - Eau
Exercices - Chimie 5.2 - Eau
Précise à chaque fois l'état physique de l'eau. Exercice 3 : Livre Exercice 6 : Changement d'état ... Exercice 8 : Graphique d'un changement d'état.
 Devoir maison : chapitre 6 : transformation physique
Devoir maison : chapitre 6 : transformation physique
6) Qu'est que la chaleur latente de changement d'état L ? Donner la relation liant L la chaleur Q et la masse m de corps. Préciser les unités. Exercice 1
 Exercice 1 : Dans un tube à essais on a réalisé la solidification dun
Exercice 1 : Dans un tube à essais on a réalisé la solidification dun
Exercice 1 : 1) Sous quel état physique se trouve A avant sa solidification ? ... Le changement d'état qui a eu lieu est soit une fusion soit une ...
 Exercices sur les transferts thermiques Exercices sur les transferts
Exercices sur les transferts thermiques Exercices sur les transferts
Donner l'expression de l'énergie de changement d'état d'une espèce chimique de masse m. 5. En déduire l'énergie thermique massique Lf de fusion de l'étain.
 Stratégie mondiale pour lalimentation lexercice physique et la santé
Stratégie mondiale pour lalimentation lexercice physique et la santé
17 avr. 2004 Les changements seront certes progressifs mais les facteurs de risque et la prévalence des maladies non transmissibles pourraient baisser ...
 [PDF] CH7 LES CHANGEMENTS DÉTATS – exercices
[PDF] CH7 LES CHANGEMENTS DÉTATS – exercices
? De l'eau dans quel état ? ? Choisi la ou les bonnes réponses : ? : fusion ? : solidification ? : vaporisation
 [PDF] Fiche dexercices : Révision 2 : Changement détat
[PDF] Fiche dexercices : Révision 2 : Changement détat
Exercice 1 : Reconnaitre des courbes de changement d'état 1- A quelle transformation correspond chacune de ces courbes ? Courbe 1 : Courbe 3 :
 [PDF] Les changements détats physiques de la matière - AlloSchool
[PDF] Les changements détats physiques de la matière - AlloSchool
Exercice I : Répondre par vrai (V) ou faux (F) a- On repère la température avec une éprouvette graduée b- Quand un corps cède de la chaleur
 [PDF] C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
[PDF] C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
Quel est l'état physique de l'eau au début de l'expérience ? 2 Pendant combien de temps toute l'eau reste-elle solide ? 3 Que
 [PDF] Exercices de révisions : Physique-chimie
[PDF] Exercices de révisions : Physique-chimie
Exercice n°1 : Tableaux d'avancement Compléter les tableaux suivants dans lequel (E I ) signifie état initial (E F ) état final et en
 [PDF] DS 2de Energie de changement détat Exercice 1
[PDF] DS 2de Energie de changement détat Exercice 1
Formulaire : Energie massique de fusion de la glace L = 335 kJ/kg ; E = P ?t Exercice 3 : Changement d'états dans un réfrigérateur La baisse de température
 [PDF] Correction des exercices sur lénergie lors des changements détat
[PDF] Correction des exercices sur lénergie lors des changements détat
Quelle transformation est endothermique ? A La fusion 4 L'énergie massique de changement d'état s'exprime en :
 Exercices Lelivrescolairefr
Exercices Lelivrescolairefr
Reproduis la courbe et indique dans quel état physique (solide liquide ou gazeux) se trouve l'eau dans chacune des parties de la courbe
 Solidification – Exercices corrigés – 5ème – Physique – Chimie
Solidification – Exercices corrigés – 5ème – Physique – Chimie
Changements d'état de l'eau – Evaporation – Fusion – Solidification – Exercices corrigés – 5ème – Physique – Chimie – Collège – PDF à imprimer
 [PDF] Exercice 1 : Dans un tube à essais on a réalisé la solidification dun
[PDF] Exercice 1 : Dans un tube à essais on a réalisé la solidification dun
Exercice 1 : 1) Sous quel état physique se trouve A avant sa solidification ? Le changement d'état qui a eu lieu est soit une fusion soit une

Exercices de Thermodynamique
" Ce fut la grande tâche et la grande gloire de la physique du XIX esiècle d"avoir ainsi considérablement précisé et étendu en tous sens notre connais- sance des phénomènes qui se jouent à notre échelle. Non seulement elle a continué à développer la Mécanique, l"Acoustique, l"Optique, toutes ces grandes disciplines de la science classique, mais elle a aussi créé de toutes pièces des sciences nouvelles aux aspects innombrables : la Thermodynamique et la science de l"Électricité. » LouisDe Broglie(1892-1987) -Matière et Lumière, exposés généraux sur la physique contemporaine, 1(1937) ?Syst`emes thermodynamiques T1? Soit une mole d"un gaz occupant une volumeVmsous la pressionPet `a la temp´eratureT.1)On suppose que ces grandeurs sont li´ees par l"´equation :?
P+a V2m? (Vm-b) =RT, o`ua,betRsont des constantes. Utiliser les propri´et´es d"intensivit´e ou d"extensivit´e des grandeurs pour
´etablir l"´equation correspondante relative `anmoles.2)Mˆeme question pour l"´equation :P(Vm-b) exp?a
RTVm? =RT. On consid`ere du sable fin dont chaque grain occupe un volumeV0= 0,1mm3. Quel est le volume Voccup´e parN= 6.1023grains? Si on ´etendait uniform´ement ce sable sur la France(d"aire S= 550000km2) quelle serait la hauteur de la couche de sable? ?Consid´erations `a l"´echelle microscopique T1? ???Ex-T1.3Vitesse de lib´eration et vitesse quadratique moyenne1)Calculer num´eriquement `a la surface de la Terre et de la Lune, pour une temp´erature
T= 300K, la vitesse de lib´erationvlet la vitesse quadratique moyenne pour du dihydrog`ene et du diazote. Commenter. Donn´ees :Constante de gravitationG= 6,67.10-11uSI. Rayon terrestreRT= 6,4.106m; masse de la TerreMT= 6.1024kg. Rayon lunaireRL= 1,8.106m; masse de la LuneML= 7,4.1022kg. Masses molaires :M(H2) = 2g.mol-1etM(N2) = 28g.mol-1.Constante desGP:R= 8,314J.K-1.mol-1.
2)Quel devrait ˆetre l"ordre de grandeur de la temp´eratureTpour que le diazote, constituant
majoritaire de l"atmosph`ere terrestre, ´echappe quantitativement `a l"attraction terrestre? R´ep : 1)Pour l"expression de la vitesse de lib´erationÜCf Cours de M´ecaniqueetDSn05: v l,T?11,2km.s-1etvl,L?2,3km.s-1. de plus :vq(H2)?1,9km.s-1etvq(N2)?0,5km.s-1.2)Il faudraitTT≂100000K(!)
1)calculer le nombre de mol´ecules parcm3dans un gaz parfait `a 27◦Csous une pression de
10 -6atmosph`ere.2)Calculer le volume occup´e par une mole d"un gaz parfait `a latemp´erature de 0◦Csous la
pression atmosph´erique normale. En d´eduire l"ordre de grandeur de la distance moyenne entre mol´ecules.Exercices de Thermodynamique2008-2009
Solution Ex-T1.1
1)CommeVm=Vn, on a :
P+a V2m? (Vm-b) =RT??P+n2aV2??
Vn-b? =RT? P+n2a V2? (V-nb) =nRT Rq :on peut ´ecrire l"´equation d"´etat sous la forme? P+A V2? (V-B) =nRTen posantB=nb etA=n2a. Best une grandeur extensive puisqu"elle est additive, sin=n1+n2,B=nb=n1n+n2b= B1+B2.Aest aussi une grandeur extensive, mais elle n"est pas additive car sin2a?=n21a+n22a.
2)P(V-nb)exp?na
RTV? =nRT.Solution Ex-T1.2
Le volume occup´e estV=N.v= 6.1013m3= 6.1016L(60 millions de milliards de litres!) . Ce sable ´etal´e surS= 5,5.105km2= 5,5.1011m2formerait une couche de hauteurh=VS?110m
Solution Ex-T1.3
1)D"apr`es l"´equation d"´etat du gaz parfait, le nombre de mol´ecules par unit´e de volume est
n ?=N V=PkBT?10-6.1,01325.1051,38.10-23×300?2,5.1019mol´ecules par m`etre cube soitn??2,5.1013 mol´ecules parcm3ou encoren??4.10-11mol.cm-3.2)Le volume molaire cherch´e est :Vm=RT
V=8,314×273,151,013.105= 22,4.10-3m3= 22,4L.
?Mod´elisations de gaz r´eelsT1? ???Ex-T1.4Dioxyde de carbonePour le dioxyde de carbone (" gaz carbonique »), les coefficientsaetbde l"équation d"état deVan
der Waalsont pour valeurs respectives0,366kg.m5.s-2.mol-2et4,29.10-5m3.mol-1. On place deux moles de ce gaz dans une enceinte de volumeV= 1Là la température deT= 300K.Q :Comparer les pressions données par les équations d"état du gaz parfait et du gaz deVan der
Waals, la valeur exacte étantP= 38,5bars.
Rép :PGP=nRT
V?4,99.106Pa, soit une erreur relative de?
?P-PGP P? ?≈30%;PVdW= nRTV-nb-n2aV2?3,99.106Pa, soit une erreur relative de? ?P-PVdW P? ?≈4%. Le modèle du gaz parfait est donc inacceptable, tandis que le modèle du gaz deVan der Waalsmontre une bien meilleure précision. ???Ex-T1.5Deux r´ecipients Un récipient(A)de volumeVA= 1L, contient de l"air àtA= 15◦Csous une pressionPA=72cmHg.
Un autre récipient(B)de volumeVB= 1L, contient également de l"air àtB= 20◦Csous une pressionPB= 45atm.On réunit(A)et(B)par un tuyau de volume négligeable et on laisse l"équilibre se réaliser à
t= 15◦C. On modélise l"air par un gaz parfait de masse molaireM= 29g.mol-1.Données :le "centimètre de mercure» est défini par la relation1atm= 76cmHg= 1,013.105Pa.Q :Quelle est la pression finale de l"air dans les récipients? Quelle est la masse d"air qui a été
transférée d"un récipient dans l"autre? Indications :Exprimer, initialement, les quantités de matièrenAetnBdans les récipients. Endéduire la quantité de matière totale. L"état final étant un état d"équilibre thermodynamique,
2http ://pcsi-unautreregard.over-blog.com/qadripcsi@aol.com
2008-2009Exercices de Thermodynamique
les variables intensives sont uniformes, dont la densité moléculaire etla pression. En déduire les
quantités de matière finalesnAFetnBF.Rép :mB→A= 26,1getP?22,5bars?22,2atm.
???Ex-T1.6Point critique et ´equation r´eduite d"un gaz de Van der Waals (*)1)Une mole de gaz deVan der Waalsa pour équation d"état :?
P+a V2? (V-b) =RT ExprimerPen fonction deTetVet calculer les dérivées partielles :?∂P ∂V? T et?∂2P∂V2? T2)Montrer qu"il existe un unique état C tel que :?∂P
∂V? T = 0et?∂2P∂V2? T = 0. Déterminer son volume molaireVC, sa températureTCet sa pressionPC.3)On poseθ=T
TC,ν=VVCet?=PPC.
Montrer que l"équation d"état liantθ,νet?est universelle, c"est à dire qu"elle ne fait plus
intervenir aucune constante dépendant du gaz.Rép : 1)?∂P
∂V? T =-RT(V-b)2+2aV3et?∂2P∂V2? T =2RT(V-b)3-6aV4 2)C? VC= 3b;TC=8a
27Rb;PC=a27b2?
-3)? ?+3ν2? (ν-1) = 8θ ???Ex-T1.7Mod´elisations d"un gaz r´eel (*)1)Le tableau ci-dessous donne avec trois chiffres significatifs exacts le volume molaireV(en
m3.mol-1) et l"énergie interne molaireU(enkJ.mol-1) de la vapeur d"eau à la température
t= 500◦Cpour différentes valeurs de la pressionP(enbars). On donne en outre la constante des GP :R= 8,314J.K-1.mol-1.P110204070100
U56,3356,2356,0855,7755,4754,78
Justifier sans calcul que la vapeur d"eau ne se comporte pas comme unGP. On se propose d"adopter le modèle deVan der Waalspour lequel on a, pour une mole de gaz : P+a V2? (V-b) =RTetU=UGP(T)-aV.Calculer le coefficientaen utilisant les énergies internes des états àP= 1baret àP= 100bars.
Calculerben utilisant l"équation d"état de l"état àP= 100bars. Quelle valeur obtient-on alors pourUàP= 40bars? Quelle température obtient-on alors en utilisant l"équation d"état avecP= 40barsetV= 1,56.10-3m3.mol-1?
Conclure sur la validité de ce modèle.
2)On réalise une détente isochore (ie à volume constant) d"une mole de vapeur d"eau de l"état
initialI{tI= 500◦C;PI= 100bars}jusqu"à l"état finalF{TF=?;PF= 70bars}. Le tableau ci-dessous donne le volume molaireV(enm3.mol-1) et l"énergie interne molaireU (enkJ.mol-1) de la vapeur d"eau sousP= 70barspour différentes valeurs de la températuret (en ◦C). t300320340360380400U47,3048,3849,3250,1750,9651,73
Déterminer la température finaleTFet la variation d"énergie interneΔU=UF-UI. qadripcsi@aol.comhttp ://pcsi-unautreregard.over-blog.com/3Exercices de Thermodynamique2008-2009
Rép : 1)UH2O(g)ne vérifie pas la première loi deJoule:H2O(g)ne se comporte pas comme un gaz parfait. Modélisation deVdW:a= 9,23.10-1J.m-3.mol-1etb= 8,2.10-5m3.mol-1.2)TF= 599KetΔU=UF-UI=-6,1kJ.mol-1.
?Coefficients thermo´elastiques et phases condens´ees T1? ???Ex-T1.8Gaz de Van der Waals Une mole de dioxyde de carboneCO2obéit à l"équation deVan der Waals:? P+a V2? (V-b) =RT, oùVest le volume molaire du gaz.
Déterminer le coefficient de dilatation à pression constanteαen fonction des variables indépen-
dantesTetV, des constantesa,bet deR. Retrouver son expressionαGPdans le cas d"un gaz parfait.Rép :a=R
-2aV2(V-b) +RTVV-bet on vérifie quelim a→0 b→0α=1T=αGP.
???Ex-T1.9Gaz de JouleUne mole de gaz deJouleobéit à l"équation d"état :P(V-b) =RT, oùVest le volume molaire
du gaz.Déterminer le coefficient de compressibilité isothermeχTen focntion des variables indépendantes
V,P, etb.
Retrouver son expressionχT,GPdans le cas d"un gaz parfait. Exprimer l"écart relatif :χT-χT,GP
χT,GP.
Comparer les compressibilité d"un gaz deJouleet d"un gaz parfait.Rép :χT=?
1-b V?1Pet on vérifie quelim
b→0χT=1P=αGP.T-χT,GP
χT,GP=-bV<0→; donc le gaz de Joule est moins compressible que le gaz parfait. ???Ex-T1.10Eau liquideUne mole d"eau liquide est caractérisée dans un certain domaine de températures et de pressions
autour de l"état 0 où{P0= 1bar;T0= 293K;V0= 10-3m3}, par un coefficient de dilatation isobareα= 3.10-4K-1et par un coefficient de compressibilité isothermeχT= 5.10-10Pa-1 constants.1)Établir que l"équation d"état liantV,PetTde ce liquide est :
ln VV0=α(T-T0)-χT(P-P0)
2)Calculer son volume molaire sousP= 1000barset àT= 293K. Commenter.
3)Une mole d"eau liquide est enfermée dans une bouteille métallique de volumeV0constant.
Par suite d"un incendie, la température passe deT0= 293KàT= 586K. Calculer la pressionPdans le récipient et commenter. Reprendre le calcul pour un gaz parfait et commenter.Rép : 2)V= 9,51.10-4m3soit?
?ΔV V0? ?= 5%.3)P=P0+α(T-T0)χT= 1,8.103bar: cette
pression est très élevée : la bouteille risque d"exploser.4http ://pcsi-unautreregard.over-blog.com/qadripcsi@aol.com
2008-2009Exercices de Thermodynamique
?" Atmosphère! atmosphère!... »T2? ???Ex-T2.1Masse de l"atmosph`ere On travaille avec le modèle d el"atmosphère isotherme avecT= 290K. Le champ de pesanteur est supposé uniforme (g= 9,8m.s-2) et l"air est assimilé à un gaz parfait de masse molaire M= 29g.mol-1. On noteP0= 105Pala pression de l"air au niveau du sol (z= 0) et on choisit un axe verticalOzascendant.1)retrouver la loi du nivellement barométriqueP(z)pour l"atmosphère isotherme. À quelle
altitudez1la pression vaut-elleP02?A.N.
2)En supposant cette loi valable dez= 0à " l"infini » calculer la masseMatmde l"atmosphère
et faire l"application numérique avecRT= 6400km. Rép : 1)z1= 5900m;2)Conseil pour éviter une intégration par partie : remarquer que l"épaisseur de l"atmosphère est telle quez?RT→Matm≈5.1018kg. ???Ex-T2.2Pression atmosph´erique en altitude Calcul de la pression atmosphérique au sommet du Mont Blanc (4807m) dans les deux cas suivants :1)On suppose que la température de l"atmosphère est constante et égale àT0.
2)On suppose que la température varie avec l"altitude suivant la loi :
T=T0-A.zavecA= 6,45.10-3K.m-1
Données :Température à l"altitudez= 0:T0= 290K; pression à l"altitudez= 0:P0=1,013bar; masse molaire de l"air :M= 29g.mol-1.
Rép : 1)P= 0,575.105Pa;2)P(z) =P0?
1-Az T0? MgRA→P= 0,557.105Pa.
???Ex-T2.3Variation de g avec l"altitudeDans le modèle de l"atmosphère isotherme, à la températureT, on considère ici que le champ de
pesanteurgvarie avec l"altitude suivant la relation :g(z) =g0.?RT RT+z? 2 ,RTreprésentant le rayon de la Terre. Au niveau du sol (z= 0), on noteg0le champ de pesanteur etP0la pression. →Montrer que la loi de variationP(z)dans ces conditions s"écrit : lnP(z)P0=-M g0R2TR.T?1RT-1RT+z?
???Ex-T2.4Atmosph`ere polytropique (*) L"air est assimilé à un GP de masse molaireMet on se donne dans l"atmosphère une relation phénoménologique de la forme : P(z) ρ(z)k=Cte, appelée relation polytropique d"indicek.kest uneconstante donnée, ajustable a postériori aux données expérimentales. Le modèle de l"atmosphère
polytropique constitue une généralisation du modèle de l"atmosphèreisotherme pour lequel on
auraitk= 1. Dans la suite on prendk?= 1. Au niveau du sol, enz= 0, on note la pressionP0, la températureT0et la masse volumiqueρ0. →Établir queP(z)est donnée par la relation implicite suivante : k k-1? P 1-1 k-P1-1k0? =-ρ0gz P1k →en déduireT(z)et montrer quedT dzest une constante.A. N. :calculerksachant quedT
dz=-7.10-3K.m-1. qadripcsi@aol.comhttp ://pcsi-unautreregard.over-blog.com/5Exercices de Thermodynamique2008-2009
Rép :T(z) =-k-1kMgzR+T0→k=MgR1dT
dz+MgR= 1,26 ?pouss´ee d"Archim`ede T2? ???Ex-T2.5Ascension d"un ballon de volume constant (*)Un ballon sphérique, de volume fixeV= 3L, est gonflé à l"hélium (M= 4g.mol-1) à la pression
de1baret à la température de293K. L"enveloppe du ballon est en aluminium et a une masse m= 2g. La pression au niveau du sol vautP0= 1baret la température vautT0= 293K. La température varie en fonction de l"altitude selon la loi :T(z) =T0(1-az), aveca= 2.10-2km-1.1)Exprimer la pressionP(z)à l"altitudezen fonction deT0,P0,aet de la constanteK=Mairg
RT0a.2)On lâche le ballon. Jusqu"à quelle altitude s"élèvera-t-il?
Rép : 1)P(z) =P0(1-az)K;2)z=1
a?1-?RT0mP0MairV+MMair?
1 K-1? = 3580m Immergée dans l"eau, une couronne dem= 14,7kga une masse apparente de13,4kg. Cette couronne est-elle en or pur? Donnée :masses volumiques de l"or, de l"argent et du plomb :ρAu= 19,3.103kg.m-3,ρAg=10,5.103kg.m-3etρPb= 11,3.103kg.m-3
Quel volume d"hélium doit contenir une montgolfière pour pouvoir soulever une massem= 800kg (incluant le poids de la nacelle, de l"enveloppe, du chargement, ...)? Donnée :masses volumiques, àT= 273KetP= 1atm:ρair= 1,29kg.m-3etρHe=0,179kg.m-3
???Ex-T2.8´Equilibre d"un bouchon de li`ege Un bouchon de liège cylindrique de hauteurH= 5cmet de sections= 2cm2est placé verti-calement dans une éprouvette graduée également cylindrique, de diamètre légèrement supérieur.
Les frottements sur les parois sont négligés. L"éprouvette contientune quantité d"eau suffisante
pour que le bouchon flotte sans toucher le fond. Données :Masses volumiques :ρeau= 1,00g.cm-3;ρliège= 0,24g.cm-3;ρglace= 0,92g.cm-3.1)Déterminer la hauteurhde liège immergée.
2)On pose sur le bouchon une pièce de monnaie de massem= 6g. Quelle est la nouvelle
hauteur immergéeh??3)On remplace le bouchon par un glaçon cylindrique de même forme. Quelleest la hauteur de
glace immergéeh??? Que se passe-t-il si on pose la pièce précédente sur le glaçon?Rép : 1)h= 1,2cm;2)h?= 4,2cm;3)h??= 4,6cm.
???Ex-T2.9Oscillations d"un demi-cylindre flottant (*) Un demi-cylindre de rayonRflotte à la surface d"un liquide de masse volumiqueρ.1)À l"équilibre, il est enfoncé deR
2dans le liquide. Quelle est sa
masse volumiqueμ?2)Hors équilibre, quelle est la période des petites oscillations ver-
ticales de l"objet?Rép : 1)μ=?
23-⎷
32π?
ρ;2)T0= 2π?
R g?π3⎷3-14?
6http ://pcsi-unautreregard.over-blog.com/qadripcsi@aol.com
2008-2009Exercices de Thermodynamique
.?LiquidesT2? On considère une fosse océanique de profondeurH= 10km. La pression à la surface de l"eauquotesdbs_dbs29.pdfusesText_35[PDF] les 3 états de l'eau
[PDF] controle physique chimie 5eme les etats de l eau pdf
[PDF] liquéfaction
[PDF] ets calendrier 2018
[PDF] calendrier scolaire college st-bernard
[PDF] calendrier cegep drummondville 2017-2018
[PDF] calendrier ulaval 2018-2019
[PDF] calendrier scolaire cegep drummondville 2016-2017
[PDF] calendrier scolaire 2017-2018 drummondville
[PDF] calendrier ets 2017
[PDF] horaire d'ouverture agence royal air maroc casablanca
[PDF] royal air maroc marrakech horaire
[PDF] agence royal air maroc rabat horaire d'ouverture
[PDF] horaire agence ram marrakech
