 Première S Nom : Prénom : TP : extraction et identification de la
Première S Nom : Prénom : TP : extraction et identification de la
TP : extraction et identification de la caféine des feuilles de thé compte-goutte ; cristallisoir ;verre de montre ; plaque de silice : cuve à élution ...
 1S - TP extraction de la caféine du thé
1S - TP extraction de la caféine du thé
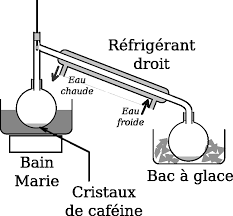
On sépare ensuite la caféine de l'eau grâce à une extraction liquide-liquide et le solvant organique est ensuite évaporé pour permettre d'obtenir des cristaux
 TP:Extraction de la caféine du thé
TP:Extraction de la caféine du thé
Lors de l'extraction liquide-liquide les anions provenant des acides restent dans la solution aqueuse basique
 LA CAFEINE DANS LES BOISSONS ENERGISANTES
LA CAFEINE DANS LES BOISSONS ENERGISANTES
se feront dans un compte rendu. Le candidat doit agir en autonomie et faire A – PREMIERE ETAPE : EXTRACTION DE LA CAFEINE DU CAFE MOULU PAR DECOCTION.
 Contrôle physico-chimique de la caféine obtenue par extraction
Contrôle physico-chimique de la caféine obtenue par extraction
Si le carbone est tertiaire l'approche du Nuˉ est rendue difficile en raison de Le solvant entre lui aussi en compte puisqu'il va faire migrer le composé ; ...
 Extraction de la caféine du thé Dans tout ce qui suit le thé peut être
Extraction de la caféine du thé Dans tout ce qui suit le thé peut être
Le compte-rendu complet devra contenir : - La description du Soxhlet. - La description du protocole effectivement réalisé ;. - La présentation des résultats ;.
 TP 02 : EXTRACTION DE LA CAFEINE DES FEUILLES DE THE
TP 02 : EXTRACTION DE LA CAFEINE DES FEUILLES DE THE
TP 02 : EXTRACTION DE LA CAFEINE DES FEUILLES DE THE. 1.INTRODUCTION. * Origine du café. Selon la légende le café fut remarqué pour la première fois 850 ans
 Extraction de la caféine du thé « Extraire » : Une espèce chimique
Extraction de la caféine du thé « Extraire » : Une espèce chimique
compte-rendu. (troisième séance). Le compte-rendu complet devra contenir : - La description du Soxhlet. - La description du protocole effectivement réalisé ;. - ...
 ECE : Extraction de la caféine
ECE : Extraction de la caféine
Nicolas est fiévreux et dissout un comprimé dans un verre d'eau. Soudain en lisant la notice
 Objectifs : Modéliser le mécanisme dextraction de la caféine par un
Objectifs : Modéliser le mécanisme dextraction de la caféine par un
I. L'EXTRACTION DE LA CAFÉINE PAR LE DICHLOROMÉTHANE Votre compte-rendu devra reprendre les éléments détaillés du protocole que vous avez rédigé avec en ...
 Première S Nom : Prénom : TP : extraction et identification de la
Première S Nom : Prénom : TP : extraction et identification de la
TP : extraction et identification de la caféine des feuilles de thé décanter sur son support; spatule ; compte-goutte ; cristallisoir ;verre de montre ;.
 Polycopié du Cours: Techniques dextraction de purification et de
Polycopié du Cours: Techniques dextraction de purification et de
2) Types d'extraction (solvant aqueuse
 LA CAFEINE DANS LES BOISSONS ENERGISANTES
LA CAFEINE DANS LES BOISSONS ENERGISANTES
questions posées dans l'énoncé (notées Q.) se feront dans un compte rendu. ... Extraire la caféine de la boisson énergisante à l'aide de 15mL du solvant ...
 Extraction de la caféine du thé « Extraire » : Une espèce chimique
Extraction de la caféine du thé « Extraire » : Une espèce chimique
Ce protocole se poursuivra et sera prolongé par des analyses des calculs et la rédaction d'un compte-rendu. (troisième séance). Le compte-rendu complet devra
 1. Extraction de la caféine
1. Extraction de la caféine
Essorer les cristaux sur büchner. VIII. COMPTE RENDU. • Quel est l'intérêt du montage à reflux ? Pourquoi chauffe-t-on ?
 Extraction de la caféine du Red Bull®
Extraction de la caféine du Red Bull®
La caféine est également présente dans le thé (on l'appelle alors théine) le Coca-Cola®
 COMMISSION NATIONALE DES STUPEFIANTS ET DES
COMMISSION NATIONALE DES STUPEFIANTS ET DES
21 févr. 2008 Compte-rendu de la 77ième réunion du 11 décembre 2007 ... la caféine et d'autre part la métabolisation de la théodrénaline en noradrénaline ...
 1S - TP extraction de la caféine du thé
1S - TP extraction de la caféine du thé
On sépare ensuite la caféine de l'eau grâce à une extraction liquide-liquide et le solvant organique est ensuite évaporé pour permettre d'obtenir des cristaux
 LANALYSE DE DROGUES COMME OUTIL DE RÉDUCTION DES
LANALYSE DE DROGUES COMME OUTIL DE RÉDUCTION DES
prélevant les phases organiques des tubes d'extraction Rédaction des comptes rendus de résultats sur la plateforme dédiée.
 [PDF] TP : extraction et identification de la caféine des feuilles de thé
[PDF] TP : extraction et identification de la caféine des feuilles de thé
On la retrouve dans les graines de caféiers et les feuilles de thé Comment extraire la caféine des feuilles de thé ? • molécule de caféine Eau Ethanol C2H6O
 [PDF] ECE : Extraction de la caféine - Académie dOrléans-Tours
[PDF] ECE : Extraction de la caféine - Académie dOrléans-Tours
Nicolas est fiévreux et dissout un comprimé dans un verre d'eau Soudain en lisant la notice il se rend compte que l'Actron® contient de la caféine molécule
 TP Extraction de La Cafeine Des Feuilles PDF Caféine - Scribd
TP Extraction de La Cafeine Des Feuilles PDF Caféine - Scribd
Compte rendu : Question N=° 1 Le rendement : Théoriquement les feuille de thé contiennent 5 en masse de caféine donc :
 Extraction de La Cafeine PDF PDF Caféine Distillation - Scribd
Extraction de La Cafeine PDF PDF Caféine Distillation - Scribd
COMPTE RENDU Quel est lintrt du montage reflux ? Pourquoi chauffe-t-on ? Quel est le rle du rfrigrant ? Quel est le rle de la pierre ponce ?
 [PDF] 1S - TP extraction de la caféine du thé - Physicus
[PDF] 1S - TP extraction de la caféine du thé - Physicus
1 Objectif Le thé contient de la caféine que nous allons extraire en utilisant deux solvants : l'eau et le dichlorométhane Nous allons utiliser le fait
 [PDF] Modéliser le mécanisme dextraction de la caféine par un solvant
[PDF] Modéliser le mécanisme dextraction de la caféine par un solvant
Votre compte-rendu devra reprendre les éléments détaillés du protocole que vous avez rédigé avec en plus des schémas ou photos commentées des étapes de l'
 [PDF] TP : Extraction de la caféine du thé
[PDF] TP : Extraction de la caféine du thé
Les produits naturels contenant de la caféine les plus répandus sont le café le thé et dans une moindre mesure le cacao Le maté et le guaraná sont d'autres
 [PDF] Extraction de la caféine du thé par percolation
[PDF] Extraction de la caféine du thé par percolation
Le compte-rendu devra contenir : - La description du protocole effectivement réalisé ; - La présentation des résultats ; - Les réponses aux questions posées
 [PDF] Extraire la caféine du café - Jallufr
[PDF] Extraire la caféine du café - Jallufr
Dans le cas présent l'extraction est basée sur une propriété de la caféine rencontrée chez de nombreuses molécules qui est la suivante : la caféine est peu

EXTRACTION D'ESPÈCES CHIMIQUES
UTILISATION DE SOLVANTS ORGANIQUES APPROPRIÉS
Objectifs : Modéliser le mécanisme d'extraction de la caféine par un solvant organique en effectuant des
analogies de comportement entre les espèces chimiques mises en jeu. I. L'EXTRACTION DE LA CAFÉINE PAR LE DICHLOROMÉTHANEExtractionSolvant.odtModifié le 15/01/18Page 1 sur 3Document 1 : Décaféination au dichlorométhane - http://www.demus.it/fr/pagina/utilizzo-del-
diclorometano.htm (Site commercial) Uitilisaition du dichlorométhane dans la décaféinaition Le dichlorométhane (ou chlorure de méthylène) est un solvant organique fréquemment utilisé pour la décaféination du café vert ainsi que pour l'extrac- tion de la théine. Au cours du procédé, les grains de café sont en contact direct avec le solvant qui est ensuite éliminé par vaporisation. Le dichlorométhane est très volatile. Son point d'ébullition se situe à 40°C, ce qui facilite son éli- mination au terme du procédé. Il est indétectable sur le café torréfié. Le dichlorométhane utilisé pour la décaféination est de qualité alimentaire et sa pureté est certifiée par le producteur ainsi que par Demus, par le biais d'ana- lyses périodiques et de contrôles, afin de s'assurer qu'il satisfait aux critères de la directive européenne 2009/32/CE du 23 avril 2009 et de l'arrêté ministé- riel italien n.390 du 20 juillet 1987. Son utilisation est réglementée en Europe et aux États-Unis, par le biais des normes ci-après: •Europe: Directive européenne 2009/32/CE du 23 avril 2009, Annexe I, partie II, qui établit une limite maximale de 2 parties par million (mg/kg) dans le café torréfié; •États-Unis: F.D.A. Code des règlements fédéraux, titre 21, chapitre1, sous-chapitre B, part. 173, sec. 173.255 - " Le chlorure de méthy-
lène peut être présent: ... dans le café, en quantité résiduelle, résultant de son utilisation comme solvant... En quantité non supérieure à 10 parties par million (0,001%) dans le café décaféiné torréfié et dans l'extrait de café soluble décaféiné. » Ces limites maximales de dichlorométhane résiduel ont été établies afin d'écarter tout risque pour le consommateur humain. Chez Demus, le contenu de DCM au terme du processus industriel est bien inférieur à cette limite, déjàdans le café vert. Après la torréfaction, à une température supérieure à 200°C,
les résidus de dichlorométhane sont généralement imperceptibles. Les craintes concernant une éventuelle toxicité pour le consommateur sont donc infondées. Par ailleurs, l'industrie pharmaceutique utilise, elle aussi, le dichlorométhane lors de certains procédés de fabrication. Il apparaît même dans la liste des ex-cipients de certains médicaments, bien que présent en faibles concentrations.Document 2 : Décaféination - Extrait de l'article Wikipédia
Extrait de l'ariticle Décaféinaition
La décaféination est l'extraction de caféine de grains de café, de maté, de cacao, de feuilles de thé ou de tout autre produit contenant de la ca- féine. Ce procédé industriel peut faire intervenir : •une extraction par un solvant organique ; •une extraction par un fluide supercritique (du dioxyde de carbone) ; •une extraction à l'eau. La première méthode, qui a été utilisée pen- dant des années, tend à être remplacée par la deuxième pour des raisons de santé (traces rési- duelles de solvants), d'impact sur l'environnement, de coût et de saveur. La dernière est la moins efficace et peut dénaturer le goût. Ces trois procédés sont décrits ci-dessous dans le cas de la décaféination du café.Extraction par des solvants organiques
C'est le procédé classique qui repose sur la solubilité différentielle (coefficient de partage) de la caféine. La caféine du café est dissoute dans le solvant organique, généralement un solvant chloré (chloroforme, trichloréthylène et dichloromé- thane), qui est ensuite éliminé par distillation. L'utilisation du dichlorométhane est réglementée en Europe et aux États-Unis.Des solvants organiques tels que l'acétate
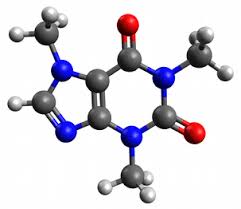
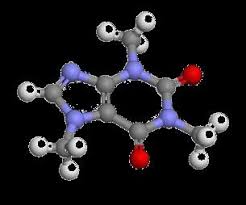
d'éthyle présentent bien moins de risques pour la santé et l'environnement que les solvants aroma- tiques et chlorés utilisés par le passé. Une autre méthode consiste à utiliser les huiles triglycéri- diques obtenues lors de la mouture du café.Illustration 2 : Modèle moléculaire de la
caféineIllustration 1 : Formule semi-développée de la caféineQRCode 1 : Lire la vidéo sur le procédé de décaféination par solvantExploitaition des documents
1.La caféine est-elle une espèce chimique naturelle ou de synthèse ?
2.Quelle est la formule brute de la molécule de caféine ?
3.À partir des documents et de la vidéo, dresser la liste des raisons pour lesquelles le dichlorométhane est
présenté comme un bon solvant pour extraire la caféine des grains de café.4.Pourquoi l'utilisation de solvants organiques tels que le dichlorométhane nécessite un contrôle rigou-
reux du produit en fin de processus ?5.Quelles alternatives au dichlorométhane sont mentionnées dans les documents ? Pourquoi ne sont-elles
pas davantage mises en oeuvre ?6.Que fait-on de la caféine extraite des grains de café ?
II. MÉCANISMES DE L'EXTRACTION PAR SOLVANT - MISE EN OEUVRE D'UN PROTOCOLE ANALOGUE À L'EXTRACTION
DE LA CAFÉINE
On souhaite se représenter les mécanismes à l'oeuvre lors de l'extraction d'une espèce chimique par un
solvant organique en procédant par analogie. Dans le protocole à mettre en place, le rôle de la caféine conte-
nue dans les grains de café est joué par du diiode I2 en solution dans de l'eau (eau iodée). Le dichlorométhane
est remplacé par d'autres solvants organiques moins nocifs pour la santé et pour l'environnement.
1. Quelques données et déifiniitions
Molécule
Solubilité du diiode I2FaibleForteForteForte
Miscibilité avec l'eauNon miscibleNon miscibleMiscibleDensité1,01,330,780,79
Température d'ébullition100 °C40 °C81 °C79 °CSolubilité : La solubilité caractérise la capacité d'une espèce chimique à se dissoudre dans un
solvant pour obtenir une solution. Plus la solubilité est élevée, plus l'espèce chimique peut être dis-
soute en grande quantité. L'espèce chimique dissoute est appelée soluté.Miscible : Cette notion s'applique à deux liquides. Deux liquides sont miscibles s'ils se mé-
langent parfaitement, en toutes proportions, conduisant à un mélange homogène d'une seule phase
(partie). Si on tente de mélanger deux liquides non miscibles, on obtient un mélange hétérogène,
contenant deux phases, où on distingue séparément les deux constituants.Ampoule à décanter : Verrerie utilisée pour séparer les deux phases d'un mélange hétéro-
gène. La décantation consiste à laisser reposer le mélange jusqu'à séparation spontanée des deux
phases : les phases se répartissent en fonction de la densité des liquides. Un robinet permet de re-
cueillir les phases séparément l'une de l'autre.Utilisation : pour une extraction, on introduit les deux liquides, puis on agite robinet fermé et en
maintenant fermement le bouchon. On laisse échapper les éventuelles surpressions en ouvrant detemps à autre le robinet dirigé vers le haut. Une fois la décantation réalisée, on recueille les deux
phases.Température d'ébullition : C'est la température de changement d'état correspondant au pas-
sage de l'état liquide à l'état de vapeur. Plus cette température est basse, plus l'espèce chimique est
volatile et plus elle passe facilement à l'état de vapeur. ExtractionSolvant.odtModifié le 15/01/18Page 2 sur 3Illustration 3 :Un mélange
hétérogène d'huile et d'eauIllustration
4 : Ampoule
à décanter
2. Mise en place du protocole pour réaliser l'objecitif ifixé
Vous disposez d'eau iodée contenant du diiode dissout dans de l'eau ainsi que quelques solvants. Le diiode
en dissout dans l'eau se reconnaît à la teinte jaune-orange de la solution.Vous devrez décrire puis mettre en oeuvre un protocole expérimental permettant d'atteindre l'objectif sui-
vant : obtenir 50 mL d'eau débarrassée du diiode initialement dissout.1. Rédacition du protocole
Votre protocole doit indiquer toutes les étapes que vous comptez mettre en place pour atteindre l'objectif
en répondant impérativement aux questions suivantes :1.Quel solvant allez-vous utiliser ? Pour quelles raisons ?
Vous pouvez procéder à des tests afin de valider votre réponse.2.Comment allez-vous faire pour récupérer l'eau débarrassée du diiode et comment allez-vous pouvoir
vous approcher le plus possible d'une eau sans diiode ?2. Mise en oeuvre et compte-rendu
Votre compte-rendu devra reprendre les éléments détaillés du protocole que vous avez rédigé avec en plus
des schémas ou photos commentées des étapes de l'extraction mise en oeuvre. Vous répondrez par ailleurs aux questions suivantes :1.Quelle observation vous permet d'affirmer que le diiode passe bien dans le solvant organique que
vous avez choisi ?2.Quelle donnée vous permet de repérer à coup sûr la position de l'eau et du solvant organique dans
l'ampoule à décanter ?3.En raisonnant par analogie avec l'expérience que vous venez de réaliser, expliquer en quelques
phrases simples le mécanisme de l'extraction de la caféine par le dichlorométhane.4.Question complémentaire : Avec le matériel dont vous disposez, comment pourriez-vous vérifier les
indications de densité des espèces chimiques utilisée ? Remarque : la densité est liée à la masse volumique ρ=m⏞ massedu corpsV⏟Volume
occupé.d=ρρ0, avecρ0=1000kg⋅m-3=1,00g⋅mL-1. Par exemple, une densité de 1,25 signifie que la
masse volumique est ρ=1,25g⋅mL-1. ExtractionSolvant.odtModifié le 15/01/18Page 3 sur 3quotesdbs_dbs2.pdfusesText_3[PDF] lignine carotte sauvage
[PDF] chromatographie carotte svt
[PDF] phloroglucine
[PDF] tp carotte ts corrigé
[PDF] extraction et dosage de la chlorophylle
[PDF] dosage de chlorophylle par spectrophotométrie
[PDF] tp de dosage de chlorophylle
[PDF] chlorophylle a et b spectre d'absorption
[PDF] chromatographie sur couche mince polarité
[PDF] chromatographie sur couche mince protocole
[PDF] chromatographie sur couche mince définition
[PDF] chromatographie sur couche mince cours pdf
[PDF] chromatographie hplc
[PDF] chromatographie sur papier