 SECONDE 5
SECONDE 5
16 juin 2015 Exercice n°2 : Manger le bon poisson ... qualitative d'un médicament par chromatographie sur couche mince (C.C.M). ... s'exprime en seconde.
 Séparation et identification des espèces chimiques
Séparation et identification des espèces chimiques
Les échantillons A et/ou B contiennent-ils de la menthone? justifier. Exercice 3. On réalise la chromatographie de trois encres. Une encre verte notée V
 Corrigé du Devoir n°5 : chimie
Corrigé du Devoir n°5 : chimie
Exercice 1 : extraction liquide-liquide Exercice 2 : chromatographie : Des élèves de seconde veulent utiliser leurs connaissances acquises en cours de ...
 Exercice - Chimie 6.5 - Purifier
Exercice - Chimie 6.5 - Purifier
Exercice 2 : distinguer mélange et corps Exercice 5 : Chromatographie de colorants alimentaires ... Le premier est rouge le second est vert. Il.
 DS 6 - Seconde - Physique - Chimie
DS 6 - Seconde - Physique - Chimie
lignes entre les exercices. Les schémas devront au moins faire EXERCICE II : Extraction par solvant ... EXERCICE III : Chromatographie sur couche mince.
 DST : Physique-Chimie
DST : Physique-Chimie
Ce sujet comporte 4 exercices de PHYSIQUE-CHIMIE présentés sur 4 pages numérotées de 1 `a 4
 2nd5. Interrogation écrite : 1h. Exercice 1 : Extraction du cinéol. (6
2nd5. Interrogation écrite : 1h. Exercice 1 : Extraction du cinéol. (6
Exercice 2 : Suivi d'une purification par chromatographie sur couche mince (CCM) (50 points). Les vertus médicinales du clou de girofle ont été mises à
 Exercices Exercice I Mélange et masses Lair est un mélange de
Exercices Exercice I Mélange et masses Lair est un mélange de
Exercice V. Chromatographie d'un médicament. Pour déterminer la composition d'une pastille pour rafraîchir l'haleine on réalise une chromatographie sur
 [PDF] chromatographie sur couche mince EXERCICE N 1 - Moutamadrisma
[PDF] chromatographie sur couche mince EXERCICE N 1 - Moutamadrisma
On réalise la chromatographie de trois corps A B et C Le chromatogramme obtenu est le suivant: 1) Faites l'analyse du chromatogramme 2) Donnez la definition
 [PDF] Exercice n°1
[PDF] Exercice n°1
16 jui 2015 · Exercice n°6 : Analyse d'un médicament On a réalisé une analyse qualitative d'un médicament par chromatographie sur couche mince (C C M)
 [PDF] Séparation et identification des espèces chimiques
[PDF] Séparation et identification des espèces chimiques
justifier Exercice 3 On réalise la chromatographie de trois encres Une encre verte notée V une encre violette notée
 [PDF] DS 6 - Seconde - Physique - Chimie - Free
[PDF] DS 6 - Seconde - Physique - Chimie - Free
EXERCICE III : Chromatographie sur couche mince On se propose de vérifier maintenant par chromatographie la présence d'estragole dans la phase
 [PDF] Exercices sur la chromatographie
[PDF] Exercices sur la chromatographie
LA CHROMATOGRAPHIE Exercices sur la chromatographie Exercice 1 Sirop de grenadine On dispose de deux sirops de grenadine S1 et S2 contenant des colorants
 Séparation et identification despèces chimiques - 2nde - Exercices
Séparation et identification despèces chimiques - 2nde - Exercices
Chromatographie – Séparation et identification d'espèces chimiques – 2nde – Exercices – PDF à imprimer · Exercices corrigés à imprimer pour la seconde
 [PDF] DST : Physique-Chimie
[PDF] DST : Physique-Chimie
Ce sujet comporte 4 exercices de PHYSIQUE-CHIMIE présentés sur 4 pages numérotées de 1 `a 4 y compris Exercice 1 Chromatographie de la cannelle
 [PDF] Ch 1 - Exercices - Seconde Scientifique
[PDF] Ch 1 - Exercices - Seconde Scientifique
Exercice I Mélange et masses Exercice II Non miscibles réalise une chromatographie sur couche mince d'une solution S obtenue en
 Série dexercices : chromatographie sur couche mince - DocPlayerfr
Série dexercices : chromatographie sur couche mince - DocPlayerfr
Application à l astrophysique Seconde ACTIVITE I ) But : Le but de l activité est de donner quelques exemples d'utilisations pratiques de l analyse spectrale
Quels sont les trois étapes d'une chromatographie ?
La CCM se déroule en trois étapes : préparation de la cuve, préparation de la plaque, et élution. Un cuve de chromatographie se compose de la cuve et d'un couvercle.Comment comprendre la chromatographie ?
Principe de la chromatographie
Pour réaliser une chromatographie on laisse un liquide (l'éluant) être absorbé (gr? à la capillarité) par une plaque. Sur cette plaque on dépose un échantillon du mélange à analyser ainsi qu'un échantillon des esp?s chimiques dont on souhaite vérifier la présence.Quels sont les différents types de chromatographie ?
Présentation de la technique.La chromatographie d'exclusion.La chromatographie échangeuse d'ions.La chromatographie de partage. Principe. La chromatographie de partage en phase gazeuse. La HPLC (chromatographie liquide de haute performance)La chromatographie d'affinitéConclusion.- b) L'anéthol est au-dessus de l'eau car il a une densité légèrement inférieure à celle de l'eau. c) A 22°C, l'anéthol est liquide car sa température de fusion est de 21°C.
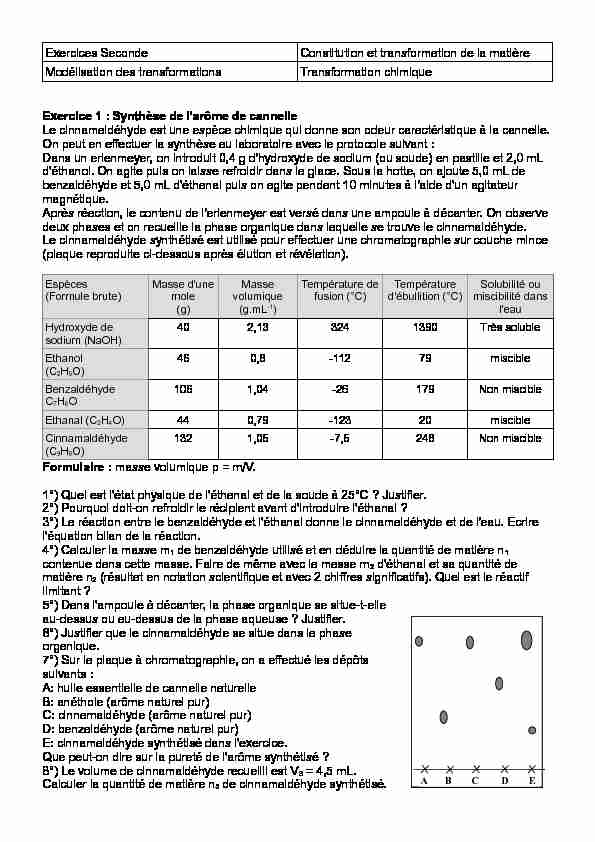 Exercices SecondeConstitution et transformation de la matière Modélisation des transformations Transformation chimique Exercice 1 : Synthèse de l'arôme de cannelle
Exercices SecondeConstitution et transformation de la matière Modélisation des transformations Transformation chimique Exercice 1 : Synthèse de l'arôme de cannelle Le cinnamaldéhyde est une espèce chimique qui donne son odeur caractéristique à la cannelle.
On peut en effectuer la synthèse au laboratoire avec le protocole suivant : Dans un erlenmeyer, on introduit 0,4 g d'hydroxyde de sodium (ou soude) en pastille et 2,0 mL d'éthanol. On agite puis on laisse refroidir dans la glace. Sous la hotte, on ajoute 5,0 mL de benzaldéhyde et 5,0 mL d'éthanal puis on agite pendant 10 minutes à l'aide d'un agitateur magnétique.Après réaction, le contenu de l'erlenmeyer est versé dans une ampoule à décanter. On observe
deux phases et on recueille la phase organique dans laquelle se trouve le cinnamaldéhyde.Le cinnamaldéhyde synthétisé est utilisé pour effectuer une chromatographie sur couche mince
(plaque reproduite ci-dessous après élution et révélation).Espèces
(Formule brute)Masse d'une mole (g)Masse volumique (g.mL-1)Température de fusion (°C)Température d'ébullition (°C)Solubilité ou miscibilité dans l'eauHydroxyde de
sodium (NaOH)402,133241390Très solubleEthanol
(C2H5O) 460,8-11279miscibleBenzaldéhyde
C7H6O1061,04-26179Non miscible
Ethanal (C2H4O)440,79-12320miscible
Cinnamaldéhyde
(C9H8O)1321,05-7,5248Non miscibleFormulaire : masse volumique ρ = m/V.
1°) Quel est l'état physique de l'éthanal et de la soude à 25°C ? Justifier.
2°) Pourquoi doit-on refroidir le récipient avant d'introduire l'éthanal ?
3°) La réaction entre le benzaldéhyde et l'éthanal donne le cinnamaldéhyde et de l'eau. Ecrire
l'équation bilan de la réaction.4°) Calculer la masse m1 de benzaldéhyde utilisé et en déduire la quantité de matière n1
contenue dans cette masse. Faire de même avec la masse m2 d'éthanal et sa quantité dematière n2 (résultat en notation scientifique et avec 2 chiffres significatifs). Quel est le réactif
limitant ?5°) Dans l'ampoule à décanter, la phase organique se situe-t-elle
au-dessus ou au-dessus de la phase aqueuse ? Justifier.6°) Justifier que le cinnamaldéhyde se situe dans la phase
organique.7°) Sur la plaque à chromatographie, on a effectué les dépôts
suivants :A: huile essentielle de cannelle naturelle
B: anéthole (arôme naturel pur)
C: cinnamaldéhyde (arôme naturel pur)
D: benzaldéhyde (arôme naturel pur)
E: cinnamaldéhyde synthétisé dans l'exercice. Que peut-on dire sur la pureté de l'arôme synthétisé ?8°) Le volume de cinnamaldéhyde recueilli est V3 = 4,5 mL.
Calculer la quantité de matière n3 de cinnamaldéhyde synthétisé. A B C D E
9°) D'après l'équation de la réaction et les quantités de matière des réactifs, on aurait pu
recueillir n'3 = 4,9.10-2 mol de cinnamaldéhyde.Calculer le rendement r de cette synthèse r=n3
n'3x100 et proposer une explication du fait que r soit inférieur à 100%.Exercice 2 : Synthèse de l'arôme de lavande
L'éthanoate de linalyle est une espèce chimique présente dans l'huile essentielle de lavande. On peut en effectuer la synthèse au laboratoire avec le protocole suivant : Dans un erlenmeyer on introduit 5,0 mL de linalol et 10,0 mL d'anhydride éthanoïque. On adapte sur l'erlemeyer un bouchon muni d'un long tube de verre (non bouché à son extrémité). On place l'ensemble bain marie bouillant puis on chauffe pendant 35 minutes. On laisse refroidir le contenu de l'erlenmeyer puis, après avoir enlevé le bouchon, on verse un peu d'eau avec précaution pour transformer l'excès d'anhydride éthanoïque en acide éthanoïque. On observe alors 2 phases que l'on verse dans une ampoule à décanter. On élimine la phase aqueuse et la phase organique est lavée à l'eau glacée puis est recueillie dans un petit bécher.Données :
Espèce
(Formule brute)Masse volumique (g.mL-1) Température de fusion (°C)Température d'ébullition (°C)Miscibilité avec l'eauLinalol
(C10H18O)0,8620200Non miscibleAnhydride
éthanoïque
(C4H6O3)1,08-73140miscibleEthanoate de
linalyle (C12H20O2)0,89-20220Non miscible Formulaire : ρ = m/V ; cm = m/V ; F = c(mère)/c(fille) = V(fille)/V(mère).1°) Quels sont les états physiques du linalol et de l'anhydride éthanoïque à la température du
laboratoire (22°C) ? Justifier.2°) Quel est le rôle du long tube de verre qu'on adapte sur l'erlenmeyer ? Pourquoi ne bouche-t-
on pas simplement l'erlenmeyer avec un bouchon hermétique ?3°) En plus de l'éthanoate de linalyle, il se forme de l'acide éthanoïque C2H4O2 . Ecrire l'équation
bilan de la réaction.4°) La masse de linalol dans le mélange réactionnel est de 4,3 g pour un volume du mélange
égal à 15 mL. Que vaut la concentration massique cm en linalol du mélange ?5°) Pourquoi lave-t-on la phase organique après décantation ?
6°) Comment pourrait-on vérifier que l'espèce obtenue est bien celle attendue ?
7°) On a recueilli à la fin V = 4,5 mL d'éthanoate de linalyle. Quelle masse m ce volume
représente-t-il ?8°) Un flacon du commerce contenant un mélange d'huiles essentielles affiche une
concentration en masse cm1 = 50,0 g/L en éthanoate de linalyle. Quelle masse m d'éthanoate de linalyle contient ce flacon de volume V = 200 mL ?9°) On veut diluer la solution que constitue le mélange du flacon pour amener sa concentration
en éthanotate de linalyle à la valeur cm2 = 20 g/L. Quel volume V1 du contenu du flacon doit on
prélever pour préparer un volume V2 = 100 mL de solution diluée ?Corrigé :
Exercice 1 :
1°) La soude est solide car sa température de fusion est supérieure à 25°C, l'éthanal est gazeux
à 25°C car sa température d'ébullition est de 20°C.2°) Si le récipient est à une température supérieure à 20°C, l'éthanal va s'évaporer à son
contact.3°) C7H6O + C2H4O → C9H8O + H2O
4°) La masse de benzaldéhyde utilisée vaut m1 = ρ.V = 1,04x5,0 = 5,2 g.
Une mole de benzaldéhyde a une masse égale à 106 g, d'où une masse de 5,2 g de benzaldéhyde contient une quantité de matière n1 = 5,2/106 = 4,9.10-2 mol. La masse d'éthanal vaut m2 = ρ.V = 0,79x5,0 = 3,95 g.Une mole d'éthanal a une masse égale à 44 g, d'où une masse de 3,95 g d'éthanal contient une
quantité de matière n2 = 3,95/44 = 8,9.10-2 mol. D'après l'équation bilan, une mole de benzaldéhyde réagit avec une mole d'éthanal. Comme n1 < n2 , le réactif limitant est le benzaldéhyde.5°) La phase organique est en-dessous car elle contient le cinnamaldéhyde synthétisé plus
dense que l'eau.6°) Le cinnamaldéhyde n'est pas miscible avec l'eau, il est donc dans la phase organique.
7°) L'arôme synthétisé contient du cinnamaldéhyde car on observe une tache à la même
hauteur que le cinnamaldéhyde pur déposé en C mais il n'est pas pur car on observe une autre
tache sans qu'on puisse identifier cette autre espèce, faute de référence.8°) n3 = 1,05x4,5/132 = 3,6.10-2 mol.
9°) r = 3,6x100/4,9 = 73%. Il est possible qu'on n'ai pas extrait la totalité de l'arôme produit par
la réaction ou que cette dernière ne soit pas totale.Exercice 2 :
1°) A 22°C, les deux espèces sont liquides car θfusion <22°C < θébullition pour les 2.
2°) Il permet de condenser les vapeurs qui sortent de l'erlenmeyer et donc de ne pas perdre de
matière. Il ne faut pas boucher, sinon le récipient risque d'éclater.3°) Linalol + anhydride éthanoïque → éthanoate de linalyle + eau
C10H18O + C4H6O2 → C12H2002 + C2H4O2
4°) Par définition cm = m(linalol)/V(mélange) = 4,3/15.10-3 = 287 g/L.
5°) Pour éliminer les espèces qui n'ont pas réagit.
6°) En mesurant ses températures de changement d'état.
7°) On a m = ρV = 0,89 x 4,5 = 4,0 g.
8°) On m = cm1 . V = 50,0 x 0,200 = 10,0 g.
9°) La conservation de la matière lors de la dilution permet d'écrire : cm1 V1 = cm2 V2 d'où
V1 = cm2 V2 /cm1 = 20 x 100/50 = 40 mL.
quotesdbs_dbs29.pdfusesText_35[PDF] tp chromatographie sur couche mince des acides aminés
[PDF] ccm seconde tp
[PDF] chromatographie sur couche mince du jus d orange
[PDF] chromatographie sur papier whatman
[PDF] chromatographie sur papier tp
[PDF] but de la chromatographie sur papier
[PDF] chromatographie sur papier definition
[PDF] correction tp chromatographie sur colonne
[PDF] chromatographie sur colonne paprika
[PDF] tp sirop de menthe corrigé
[PDF] albinisme transmission
[PDF] albinisme gene responsable
[PDF] allèle responsable de l'albinisme
[PDF] albinisme génétique
