Incompatibilité fœto-maternelle érythrocytaire
Incompatibilité fœto-maternelle érythrocytaire
6 déc. 2001 L'allo-immunisation érythrocytaire fœto-maternelle se mani- feste par l'acquisition d'anticorps qui par une suite de processus
 Prise en charge de lallo-immunisation fœto-maternelle érythrocytaire
Prise en charge de lallo-immunisation fœto-maternelle érythrocytaire
5 mai 2023 Les anticorps anti-Kell ne seront développés que chez la personne immunisée après transfusion ou lors d'une grossesse incompatible. Aucun ...
 prévention de lallo-immunisation rhésus-d fœto-maternelle
prévention de lallo-immunisation rhésus-d fœto-maternelle
CNGOF) C. d'Ercole (Société Française de Médecine Périnatale)
 Accouchement et post-partum
Accouchement et post-partum
○ CNGOF. Incompatibilité foeto-maternelle érythrocytaire. 2001. ○ Miquel E et al. Incompatibilités foetomaternelles érythrocytaires : de la surveillance
 Primo-immunisations rhesus 1 en cours de grossesse
Primo-immunisations rhesus 1 en cours de grossesse
21 août 2012 d'une incompatibilité fœto-maternelle érythrocytaire. Elle doit donc ... incompatibilités sanguine fœto-maternelles ont été publiées par le CNGOF ...
 DOSAGE DE LA BILIRUBINE NON LIEE A LALBUMINE (BNL
DOSAGE DE LA BILIRUBINE NON LIEE A LALBUMINE (BNL
22 juin 2016 RECOMMANDATION DU CNGOF. Patiente RH-1. 2013 ... Prise en charge néonatale des formes sévères d'incompatibilités foeto-maternelles érythrocytaires ...
 Suivi et orientation des femmes enceintes en fonction des situations
Suivi et orientation des femmes enceintes en fonction des situations
fœto-maternelle » CNGOF 2005. 7 Cf. recommandations de santé publique Incompatibilité fœto-maternelle (érythrocytaire et plaquettaire). B. À adapter.
 Transfusions fœtales érythrocytaires : état des lieux sur 4 ans en
Transfusions fœtales érythrocytaires : état des lieux sur 4 ans en
%20TIU%20en%20France.pdf
 Extrait des Mises à jour en Gynécologie et Obstétrique
Extrait des Mises à jour en Gynécologie et Obstétrique
– compatibilité érythrocytaire. En cas d'incompatibilité. Rhésus entre la mère et le fœtus et d'immunisation maternelle la quantité de cellules fœtales
 [PDF] Iso-immunisation Sanguine Fœto-Maternelle (ISFM)
[PDF] Iso-immunisation Sanguine Fœto-Maternelle (ISFM)
En cas d'incompatibilité sanguine fœto-maternelle avérée le risque d'anémie dépend du taux d'anticorps anti-D Le risque est pratiquement nul en dessous de 5
 [PDF] Incompatibilités fœtomaternelles érythrocytaires - CNRHP
[PDF] Incompatibilités fœtomaternelles érythrocytaires - CNRHP
Diagnostic biologique d'une incompatibilité fœtomaternelle érythrocytaire (spécificité nomenclature traditionnelle) pendant la grossesse RAI : recherche d'
 [PDF] Prévention de lallo-immunisation Rhésus D chez les patientes de
[PDF] Prévention de lallo-immunisation Rhésus D chez les patientes de
Si le fœtus a un génotype RhD positif la grossesse est incompatible dans le système RhD et donc la femme à risque d'allo-immunisation
 [PDF] Extrait des Mises à jour en Gynécologie et obstétrique - CNGOF
[PDF] Extrait des Mises à jour en Gynécologie et obstétrique - CNGOF
Brossard Y Parnet-Mathieu F Larsen M In- compatibilités fœto-maternelles érythrocytaires In : Rougier P Transfusion sanguine : une ap- proche sécuritaire
 [PDF] Allo-immunisation foeto-maternelle anti-érythrocytaire
[PDF] Allo-immunisation foeto-maternelle anti-érythrocytaire
19 sept 2019 · RAI D'INTERET MATERNEL (transfusionnel) en fin de grossesse Bilan d'incompatibilité fœto-maternelle chez le nouveau-né
 [PDF] ?????? ?? ?? ??? ??? ? ?????? ????? ?????? ??? ???
[PDF] ?????? ?? ?? ??? ??? ? ?????? ????? ?????? ??? ???
10 oct 2018 · Allo-immunisation foeto-maternelle érythrocytaire CGR : Concentré de Globule Rouge CNGOF : Collège National des Gynécologues et
 Extrait des Mises à jour en Gynécologie et Obstétrique - CNGOF
Extrait des Mises à jour en Gynécologie et Obstétrique - CNGOF
L’allo-immunisation érythrocytaire fœto-maternelle se mani-feste par l’acquisition d’anticorps qui par une suite de processus peuvent entraîner une hémolyse et une anémie fœtales Le but de la prise en charge obstétricale est dans un premier temps d’assurer une prévention efficace de ce type d’affection En
 L’incompatibilité fœto-maternelle dans le système ABO
L’incompatibilité fœto-maternelle dans le système ABO
Incompatibilités foetomaternelles érythrocytaires (IFME) et alloimmunisations Définies par la fixation sur le globule rouge fetal d’alloanticorps contre les antigènes de groupe sanguin d’origine paternelle maternels transmis in utero dirigés Hématie fœtale RhD + ANTICORPS ANTI-D
 Incompatibilités foeto-maternelles érythrocytaires: le nouveau-né
Incompatibilités foeto-maternelles érythrocytaires: le nouveau-né
Les incompatibilités foeto-maternelles érythrocytaires sont les plus fréquentes des maladies hémolytiques du nouveau-né (MHFN) Même si MHFN = « Maladie Rhésus » Ne pas oublier les autres causes d’hémolyse: anomalies de membrane et des enzymes du globule rouge IFME caractérisées biologiquement test de coombs
Le diagnostic et la prise en charge des incompatibilités ftomaternelles érythrocytaires (IFME) restent
uneimportante activité des pédiatres de maternités et des professionnels de la naissance. Si les incom-
patibilités ABO représentent la plus grande cause des maladies hémolytiques néonatales actuellement, lesautres incompatibilités ftomaternelles, beaucoup plus rares, n"ont pas disparu. À côté des IFME de
spécificité RH1 en voie de raréfaction, les incompatibilités RH3, RH4 et KEL1 prennent de l"importance. Lediagnostic de toute incompatibilité du système rhésus et KEL devrait être fait pendant la grossesse et
nonen urgence devant les complications anémiques ftales ou hyperbilirubinémiques postnatales. Ceci
est possiblesi le calendrier de surveillance des agglutinines irrégulières pendant la grossesse est respecté,
lediagnostic évoqué sur tout ictère et/ou anémie néonatals précoce(s) ou prolongé(e)(s). Le diagnostic
desincompatibilités ftomaternelles érythrocytaires repose sur un dialogue multidisciplinaire organisé
ausein de chaque établissement de santé entre les obstétriciens, les néonatologistes, les spécialistes de
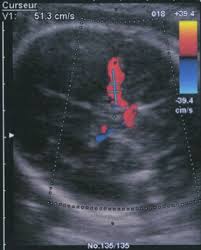
l"immunohématologie périnatale ainsi que le milieu transfusionnel. En effet, de nombreux progrès ont révolutionné ce domaine : en anténatal dans le diagnostic non invasif des incompatibilités (génotypage desgroupes sanguins du ftus sur sang maternel) et celui de leurs complications anémiques ftales (vélo-
cimétrieDoppler de l"artère cérébrale), mais aussi dans la prise en charge postnatale avec les innovations
dela photothérapie, le développement de traitements adjuvants, enfin l"évolution des thérapeutiques
transfusionnelles anténatales et postnatales.2012 Elsevier Masson SAS. Tous droits réservés.
Mots-clés : Incompatibilités érythrocytaires ; Maladie hémolytique néonatale ; Anémie ftale ;
Photothérapie
intensive ; Génotype de groupe sanguin ftal ;Vélocimétrie
Doppler de l"artère cérébrale moyenne ; Recherche d"agglutinines irrégulières et identification ;
Test de Coombs direct ; Transfusion ; Hyperbilirubinémie sévère Plan ?Introduction 1 ?Physiopathologie et épidémiologie 2Antigènes
concernés 2Mécanismes
de développement d"une immunisation et conséquences 2Épidémiologie
5 ?Conséquences de l"immunohémolyse : éléments du diagnostic 5Diagnostic
clinique 5Diagnostic
biologique 8 ?Prise en charge (et surveillance) des IFME pendant la grossesse 11Schéma
de surveillance d"une grossesse immunisée 11Traitement
de l"anémie ftale : transfusions in utero (TIU) 12 ?Prise en charge et surveillance des IFME après la naissance 13Règles
générales 13 En salle de naissance 14Premières
heures 14Après
la première semaine 17 ?Prévention 18Primaire
18Secondaire
: en cas de désir d"un nouvel enfant chez une femme immunisée 19 ?Conclusion 20 ? Introduction Les incompatibilités ftomaternelles érythrocytaires (IFME) sont définies par la fixation d"alloanticorps maternels sur le globule rouge du ftus, anticorps transmis pendant la gros- sesse et qui ont pour cible les antigènes de groupes sanguins du ftus, d"origine paternelle. Les complexes immuns ainsi formés provoquent une immunohémolyse tissulaire. Le syn- drome hémolytique s"exprime de deux fac¸ons chez l"enfant : une anémie qui peut débuter in utero et se prolonge pendant plusieurs semaines après la naissance, et une hyperbilirubiné- mie (donc un ictère) précoce et rapidement croissante après la naissance.EMC - Pédiatrie
1Volume 7 > n
3 > juillet 2012
4-002-R-25?Incompatibilités ftomaternelles érythrocytaires
Les IFME représentent un domaine de l"immunohématologie périnatale qui se manifeste toujours après la naissance, mais parfois aussi pendant la grossesse, mobilisant donc les exper- tises biologiques, obstétricales, pédiatriques et transfusionnelles.L"histoire
de la " maladie rhésus » (terme réservé en théorie aux IFME de spécificité anti-RhD ou anti-RH1, mais par extension appliqué à d"autres spécificités) est très informative : initialement décrite en 1912 sous le nom d"" erythroblastosis foetalis » avec une riche symptomatologie (anasarque, ictère et anémie sévères), elle n"est reliée à une physiopathologie immunologique et au " facteur rhésus » que seulement 30 ans plus tard. La prise en charge de l"anémie ftale se développe 50 ans après ces descriptions. Enfin, dans les années 1960, ce sont affinées des méthodes de diag- nostic de cette IFME RH1, et développés des moyens d"apprécier le risque et le degré d"atteinte ftale ainsi que la prévention. Cette dernière, basée sur l"injection d"immunoglobulines anti- D (IgRh), a permis par sa généralisation, la réduction drastique de l"expression ftale et néonatale de la " maladie rhésus RH1 ».Ainsi,
en 50 ans une pathologie périnatale létale devenait acces- sible au diagnostic, au traitement, et est presque entièrement prévenue.Aujourd"hui
pourtant, les incompatibilités de spécificité anti- RH1 n"ont pas complètement disparu, et si les IFME les plus fréquentes sont actuellement les incompatibilités ABO, celles de spécificité anti-KEL1, -RH4, -RH3 à manifestations anté- et post- natales sont de plus en plus souvent décrites, ce d"autant qu"elles ne sont pas accessibles à une immunoprophylaxie. Le retard de diagnostic de l"incompatibilité érythrocytaire peut encoreêtre
à l"origine d"une mort périnatale (anasarque ftoplacen- taire) ou d"un handicap grave chez l"enfant. Ces complications, aujourd"hui rares, témoignent de la sous-estimation des situa- tions d"IFME par les cliniciens et les biologistes. Pourtant, les moyens de diagnostic (génotypage de groupe sanguin ftal non invasif) et de surveillance (vélocimétrie Doppler du pic systolique de l"artère cérébrale moyenne) ont progressé, de même que les techniques de prise en charge du ftus (transfusion ftale) mais aussi du nouveau-né (photothérapie intensive). Au total, la prise en charge du désordre hématologique périna- tal que représente l"IFME impose une approche multidisciplinaire par des spécialistes de cette période de développement : biolo- gistes experts en immunohématologie périnatale et transfusion, gynécologues-obstétriciens référents dans le domaine anténatal et pédiatres néonatologistes avertis, approche enrichie des progrès récents diagnostiques et thérapeutiques. ? Physiopathologie etépidémiologie
Antigènes concernés
Groupes sanguins impliqués
Parmi les 250 groupes sanguins répertoriés, environ 100 ont été impliqués dans les IFM [1, 2] côté des antigènes privés (présents seulement chez quelques familles) ou publics (absents chez moins de deux sujets sur 1 000), les antigènes le plus fréquemment "symptomatiques »sont ceux de fréquence moyenne (10 % à 90 %) au sein des systèmes ABO,Rhésus,
Kell, Duffy, Kidd et MNS.
Les antigènes des quatre systèmes (ABO, lewis, P, H) sont des antigènes " rapportés » : carbohydrates générés par des glycosyl- transférases exprimés tard pendant la grossesse (avec antigènes P et lewis non retrouvés chez le ftus) et aussi sur d"autres cel- lules que les hématies. En revanche, les autres antigènes cités sont des antigènes intégraux : produits directs des gènes des protéines membranaires. Ils sont spécifiques des hématies et exprimés pleinement dès la vie embryonnaire (RH1, RH4, RH3, KEL1, etc.) [1, 3] Les anticorps dirigés contre les antigènes de groupe sanguin résultent pour la plupart d"une " hétéro-immunisation » anti-A ou anti-B, ou d"une allo-immunisation secondaire à l"exposition au marqueur antigénique " étranger », non présent sur ses propresglobules rouges à l"occasion d"une transfusion ou d"une hémorra- gie ftomaternelle (HFM) (anti-RH1, anti-RH4, anti-KEL1, etc.), souvent occulte. Certains (anti-MNS1, anti-RH3, anti-RH8, etc.) peuventêtre d"origine naturelle.
De l"anticorps à l"immunohémolyse
Induction d"une IFM
Pour induire une IFM, les anticorps doivent : être de type IgG qui sont les seuls anticorps qui traversent le placenta avoir une concentration circulante chez la mère suffisammentélevée
(cf. infra) ; avoir une affinité suffisante pour l"antigène ; être apte à activer, par leur région Fc, les récepteurs des macro- phages.Expression
de la maladie hémolytiqueL"expression
de la maladie hémolytique chez l"enfant, donc du conflit antigène-anticorps de l"IFME, est conditionnée par : la quantité des anticorps dans la circulation maternelle, le flux du transfert ftal des anticorps associés à l"expression antigé- nique cible sur les globules rouges ftaux qui augmentent avec la progression de la gestation ; la spécificité antigénique (manifestations ftales pour RH1, KEL1 et RH4, exceptionnelles avec RH3) mais aussi certaines caractéristiques des anticorps (sous-classe par exemple), et les interactions entre systèmes immunitaires maternel et ftal.Actuellement,
aucun de ces éléments n"est accessible à des tech- niques d"exploration simples, prédictives et de routine.Mécanismes de développement
d"une immunisation et conséquencesDéveloppement des anticorps
Circonstances déclenchantes
Le développement d"anticorps dirigés contre les groupes san- guins chez une femme résulte de deux circonstances principales. La transfusion et la grossesse sont les principales conditions qui peuvent induire le développement d"anticorps et sont à recher- cher à l"interrogatoire. Le développement d"anti-RH1 est possible, même en cas d"immunoprophylaxie à la grossesse précédente, sachant qu"il est souvent difficile rétrospectivement d"affirmer que le traitement a été optimal (délai après l"HFM et adaptation des doses). Toxicomanies ou greffes sont aussi des circons- tances d"immunisation érythrocytaire mais restent exception- nelles.L"origine
transfusionnelle d"une immunisation maternelle est en France très rare du fait de la réglementation transfusion- nelle : respect de la phénocompatibilité des concentrés de globules rouges (CGR) sélectionnés en transfusion et choix de produit KEL : -1 pour tout sujet féminin [4, 5] . Ceci est néanmoins pos- sible pour des femmes ayant des antécédents d"hémothérapies ou ayant séjourné à l"étranger où ces règles transfusionnelles sont d"application récente. Au cours ou décours d"une grossesse Les anticorps antiérythrocytaires peuvent se développer au cours ou au décours d"une grossesse par activation du système immunitaire maternel, après une première étape de sensibilisation par des hématies ftales porteuses de caractéristiques paternelles parvenues dans la circulation maternelle. Ce passage d"hématies correspond à des HFM qui sont spon- tanées et dans ce cas occultes en cours de grossesse, avec une fréquence de 45 % au troisième trimestre. Les HFM peuventêtre
provoquées (fausse-couche, interruption volontaire de gros- sesse, version, mort ftale in utero, accouchement, etc.). Au moment de l"accouchement, chez une femme sur deux l"HFM est de volume supérieur à 1 ml de sang ftal [6] . Certaines don- nées plus récentes donnent des incidences d"HFM minimes encore plus élevées au cours de la grossesse, sachant que le volume de sang pouvant induire une immunisation n"est pas précisément défini [7] 2EMC - Pédiatrie
Incompatibilités ftomaternelles érythrocytaires?4-002-R-25 Le risque de développer des anticorps dépend alors de l"importance de l"HFM et de l"immunogénicité de l"antigène, le plus immunogène des antigènes étant l"antigène RH1 [8] noter que l"hématopoïèse ftale débute dès 3 semaines de gestation et que l"antigène RH1 a pu être identifié sur la sur- face des globules rouges dès 38 jours postconceptionnels [9] . La réponse initiale à un antigène étranger est relativement lente (plusieurs semaines). Une nouvelle exposition au même anti- gène va provoquer une réponse immunitaire rapide en quelques jours.Devenir
des anticorps déjà formés Une fois formés, les anticorps antiérythrocytaires restent pré- sents dans l"organisme maternel ad vitam aeternam. Au cours de toute nouvelle grossesse, les anticorps de type IgG traversent le placenta (après capture par les récepteurs Fc du syncitiotro- phoblaste et transcytose) et vont se fixer sur les globules rouges ftaux incompatibles porteurs de l"antigène correspondant hérité du père.Même
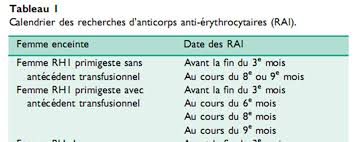
si cela ne correspond pas à la physiopathologie classique de la maladie rhésus, une immunisation peut se développer chez une authentique primigeste, ce qui renforce l"importance du res- pect du calendrier de recherche d"agglutinines irrégulières (RAI) dans le diagnostic des IFME. Conséquences des anticorps antiérythrocytaires maternels Après la traversée du placenta, les anticorps se fixent sur les glo- bules rouges ftaux porteurs de l"antigène cible qu"ils recouvrent. La présence de l"anticorps fixé sur les hématies ftales dès le terme de6 semaines pour les anti-RH1 atteste de la précocité possible
du transfert. Le taux ftal d"IgG va s"accroître progressivement à partir du quatrième mois (10 % du taux maternel) pour atteindre voire dépasser ce taux maternel à terme [3] Les complexes immuns formés se lient aux récepteurs Fc?Rn des macrophages ftaux dans la rate, entraînant leur activation. Une destruction des hématies s"ensuit par phagocytose ou lyse de contact.L"importance
de l"hémolyse croît avec la densité en complexes immuns, mais dépend aussi de la diversité de la région Fc des anticorps (définissant des sous-classes d"IgG) et de la réceptivité des macrophages ftaux. Une hémolyse modérée se manifeste exclusivement en période néonatale par une hyperbilirubinémie (bilirubine produit de dégradation de l"hème). Le processus a débuté avant la naissance, mais la bilirubine formée est éliminée par la mère via le placenta et l"anémie est compensée par une réticulocytose importante. Une hémolyse sévère aboutit à une production accrue de glo- bules rouges par le foie et la rate pour compenser la destruction des globules rouges par conflit antigène-anticorps. Cette produc- tion accrue inclut des perturbations de la circulation portale avec un dème placentaire à l"origine de perturbations de la perfusion placentaire et du développement d"une ascite. Une hépatoméga- lie, un aspect de placenta épaissi, un hydramnios, peuvent être constatés. Enfin, si l"atteinte hépatique progresse, la réduction de production d"albumine va aboutir à une anasarque avec épanche- ments multiples [8]L"immunohémolyse
se complète parfois d"une inhibition de l"érythropoïèse,quotesdbs_dbs22.pdfusesText_28[PDF] Anatomía del globo ocular y de la órbita
[PDF] anatomia basica del ojo humano - ClaseV
[PDF] Appunti di anatomia e fisiologia umana - ITAS quot G Pastori quot
[PDF] ANATOMÍA HUMANA
[PDF] carte anatomia si fiziologia omului pdf
[PDF] Trattato di anatomia umana Volumi 1-3 PDF Download
[PDF] Frederic H Martini, PhD Michael J Timmons, MS Robert - EdiSES
[PDF] ANATOMÍA Y FISIOLOGÍA OCULAR Dr Molina
[PDF] Anatomie artistique / description des formes extérieures du corps
[PDF] Planches anatomiques du bassin et de la hanche réunion amiform
[PDF] Le bassin obstétrical
[PDF] Anatomie de la cavité buccale - L 'UNF3S en 2015, c 'est
[PDF] dossier didac coeurindd
[PDF] Cours de Biologie animale Vertébrés Anatomie Comparée Partie 2