 § 7 (suite) Titrages acide-base
§ 7 (suite) Titrages acide-base
Considérons le titrage d'une solution d'un acide faible tel que l'acide acétique par exemple
 LES TITRAGES ACIDES-BASES
LES TITRAGES ACIDES-BASES
REMARQUE : par analogie dans le cas du titrage d'une base faible par un acide fort
 Fiche de synthèse n°2 : réactions acido-basiques en solution aqueuse
Fiche de synthèse n°2 : réactions acido-basiques en solution aqueuse
Dans le cas d'un acide fort celui-ci étant totalement dissocié dans l'eau
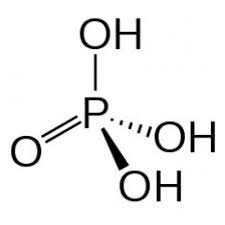 Acide phosphorique
Acide phosphorique
L'acide phosphorique est un triacide minéral. La première fonction est celle d'un acide fort la deuxième celle d'un acide faible et la troisième celle d'un
 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
Les acides faibles fournissent en solution aqueuse une concentration d'ions H3O+ inférieure à celle que fournissent les acides forts à la même concentration
 Fiche de révisions sur les acides et les bases
Fiche de révisions sur les acides et les bases
donc la base la plus forte dans l'eau. Les couples acide faible / base faible ont tous des constantes d'acidité comprises entre 1 et. 14. 10.
 VI..Etude sommaire des mélanges
VI..Etude sommaire des mélanges
2) Acide fort 1 + acide faible 2. On calcule souvent le pH en négligeant l En solution aqueuse les acides forts fournissent intégralement l'acide fort. H3O.
 Chapitre n°…. : Notion dacides et de bases fortes et faibles TP n
Chapitre n°…. : Notion dacides et de bases fortes et faibles TP n
-Identifier le caractère fort ou faible d'un acide. -Calculer une incertitude. Contexte du sujet: Nous désirons vérifier expérimentalement que l'acide
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
L'acide conjugué d'une base faible est un acide faible. Exemples : 1) L — définition d'un acide fort/faible d'une base forte/faible;. — propriétés d ...
 pH et pKa
pH et pKa
l'acide A1 est plus fort que l'acide A2. B) l'acide A1 est plus faible que l'acide A2. C) les acides A1 et A2 sont de force moyenne. 4) Dans la théorie de
 Fiche de révisions sur les acides et les bases
Fiche de révisions sur les acides et les bases
donc la base la plus forte dans l'eau. Les couples acide faible / base faible ont tous des constantes d'acidité comprises entre 1 et. 14. 10.
 Déterminer si un acide est fort ou faible
Déterminer si un acide est fort ou faible
On connait le pH et la concentration de la solution. Pour savoir si l'acide est fort ou faible il faut : 1. Déterminer [H3O+] par la relation [H3O+]=10-
 § 7 (suite) Titrages acide-base
§ 7 (suite) Titrages acide-base
Considérons le titrage d'une solution d'un acide faible tel que l'acide acétique par exemple
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
faible ssi la dissociation est une réaction équilibrée ssi pKa > 0. Dans le cas d'un acide fort totalement dissocié dans l'eau
 Dosages acidobasiques
Dosages acidobasiques
9 févr. 2018 chera par exemple la concentration d'un acide (fort ou faible) dans une solution. Pour réaliser le dosage on fait réagir l'espèce à doser ...
 Fiche de synthèse n°2 : réactions acido-basiques en solution aqueuse
Fiche de synthèse n°2 : réactions acido-basiques en solution aqueuse
Soit un acide faible AH qui réagit avec l'eau selon la réaction d'équation : Dans le cas d'un acide fort celui-ci étant totalement dissocié dans l'eau
 Acide phosphorique
Acide phosphorique
L'acide phosphorique est un triacide minéral. La première fonction est celle d'un acide fort la deuxième celle d'un acide faible et la troisième celle d'un
 Dosage acide faible – base forte
Dosage acide faible – base forte
Dosage acide faible – base forte. Les relations établies classiquement le sont pour : ? un acide suffisamment faible et pas trop dilué.
 pH et pKa
pH et pKa
Une solution contenant un acide fort a un pH inférieur à celui d'une solution Formule générale pour le pH de solutions d'acide/base faible: [H3O+] = Ka.
[PDF] acide faible ph pka
[PDF] acide fort base forte exercice corrigé pdf
[PDF] acide fort et faible ph
[PDF] acide fort ou faible ph
[PDF] acide phosphorique faible
[PDF] acids and bases exam questions
[PDF] acids and bases multiple choice questions and answers pdf
[PDF] acids and bases practice problems
[PDF] acids and bases questions and answers pdf
[PDF] acids and bases sample problems
[PDF] acsm definition of exercise
[PDF] acsm exercise and coronavirus
[PDF] acsm exercise at home
[PDF] acsm exercise guidelines pdf
