 Évaluation du comportement de quelques savons traditionnels en
Évaluation du comportement de quelques savons traditionnels en
Nov 30 2014 Méthodologie et résultats : La concentration micellaire critique (CMC) et le point de Krafft des savons ... Conductivity of Critical Micelle ...
 Licence de Physique Rapport de stage en laboratoire
Licence de Physique Rapport de stage en laboratoire
particulière que l'on appelle la CMC (Concentration Micellaire Critique). conductivité devrait donc être une fonction linéaire de la concentration. Au dessus ...
 Etude de la solubilisation micellaire ionique dun polluant organique
Etude de la solubilisation micellaire ionique dun polluant organique
2.2 Méthodes. 2.2.1. Mesures conductimètriques. La concentration micellaire critique (CMC) des tensioactifs a été déterminée par des mesures de conductivité en
 Synthèse de tensioactifs identification et caractérisation
Synthèse de tensioactifs identification et caractérisation
Jun 17 2019 Il s'agit de la Concentration Micellaire Critique (CMC). La CMC ... Concentration (mmol/L) conductivité (µS/cm). 0. 0. 124
 Mémoire
Mémoire
Figure IV.23 L'évolution de conductivité en fonction de la concentration de d'habitude caractérisée par la concentration micellaire critique (CMC). En ...
 Untitled
Untitled
Lorsque la concentration en SDS est inférieure à la c.m.c. les ions sodium et dodecylsulfate sont libres en solution et la conductance augmente donc propor-.
 Leffet de la température sur les propriétés(CMC) de
Leffet de la température sur les propriétés(CMC) de
les concentrations du tensioactif ionique et de son contre-ion sont modifiées lors de la formation des micelles ce qui influt sur la conductivité de cette
 Évaluation du comportement de quelques savons traditionnels en
Évaluation du comportement de quelques savons traditionnels en
Nov 30 2014 Méthodologie et résultats : La concentration micellaire critique (CMC) et le point de Krafft des savons ... Conductivity of Critical Micelle ...
 Leffet de la température sur la concentration micellaire critique du
Leffet de la température sur la concentration micellaire critique du
Jun 27 2021 Ce travail se concentre sur le CTAB et la modification de sa conductivité électrique dans les différents milieux et la variation de CMC en ...
 Licence de Physique Rapport de stage en laboratoire
Licence de Physique Rapport de stage en laboratoire
Recherche de CMC par conductivité et température de Krafft . particulière que l'on appelle la CMC (Concentration Micellaire Critique).
 Évaluation du comportement de quelques savons traditionnels en
Évaluation du comportement de quelques savons traditionnels en
30 nov. 2014 Methods and Results: The critical micelle concentration (CMC) and the Krafft point of traditional soaps were determined by the conductivity ...
 Principe de mesure de la Concentration Micellaire Critique
Principe de mesure de la Concentration Micellaire Critique
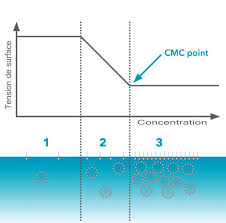
Document 2 – La CMC : Concentration Micellaire Critique? En solution aqueuse ces ions peuvent s'organiser en donnant des agrégats microscopiques.
 LA CHIMIE DU SAVON
LA CHIMIE DU SAVON
La concentration micellaire critique peut être déterminée par mesure de la conductivité de l'eau savonneuse. En effet la conductivité ? d'une solution.
 TP 6 Tensioactif mousses
TP 6 Tensioactif mousses
https://olczyk.pagesperso-orange.fr/physique-chimie/speTS/mat3/TP6_tensioactif_mousse_%C3%A9mulsion.pdf
 Untitled
Untitled
Des études précises de conductivité indiquent que des dimères ou La concentration micellaire critique (abrégée CMC) correspond à la transition entre les.
 Synthèse de tensioactifs identification et caractérisation
Synthèse de tensioactifs identification et caractérisation
17 juin 2019 A. Mesure de la Concentration Micellaire Critique par conductimétrie ... alors considérés comme des ions libres et la conductivité augmente.
 SMARTCOURS
SMARTCOURS
Dans la première partie de la courbe on constate que la conductivité de Donc
 Travaux pratiques
Travaux pratiques
concentration micellaire critique (à une température donnée). c – Expliquer les variations de la conductivité observées. d – Définir et en déduire le point
 Etude de la solubilisation micellaire ionique dun polluant organique
Etude de la solubilisation micellaire ionique dun polluant organique
2.2 Méthodes. 2.2.1. Mesures conductimètriques. La concentration micellaire critique (CMC) des tensioactifs a été déterminée par des mesures de conductivité en
 (PDF) 4 Détermination de la Concentration Micellaire Critique dun
(PDF) 4 Détermination de la Concentration Micellaire Critique dun
25 fév 2019 · PDF Il est souvent utile de connaître la valeur de la Concentration Micellaire Critique (CMC) pour un tensioactif donné et dans des
 [PDF] [PDF] [PDF] 2 MICELLES et CONCENTRATION - Laboratorio FIRP
[PDF] [PDF] [PDF] 2 MICELLES et CONCENTRATION - Laboratorio FIRP
La concentration micellaire critique qui correspond à la zone d'apparition des premières micelles peut-être détectée par de nombreuses méthodes du fait que
 [PDF] Licence de Physique Rapport de stage en laboratoire
[PDF] Licence de Physique Rapport de stage en laboratoire
Recherche de CMC par conductivité et température de Krafft particulière que l'on appelle la CMC (Concentration Micellaire Critique)
 [PDF] Détermination de la concentration micellaire critique et de
[PDF] Détermination de la concentration micellaire critique et de
30 nov 2014 · Methods and Results: The critical micelle concentration (CMC) and the Krafft point of traditional soaps were determined by the conductivity
 [PDF] TP-micellespdf - Normale Sup
[PDF] TP-micellespdf - Normale Sup
L'intersection de ces deux droites permet de déterminer une caractéristique parti- culière du SDS dans l'eau appelée concentration micellaire critique notée
 [PDF] Principe de mesure de la Concentration Micellaire Critique - Prof-TC
[PDF] Principe de mesure de la Concentration Micellaire Critique - Prof-TC
- Fiole jaugée de 50mL 2- La conductivité (?) d'une solution ionique est proportionnelle à la concentration molaire C des ions libres de se déplacer en
 [PDF] Comportement-en-solutions-aqueuses-du-systemepdf
[PDF] Comportement-en-solutions-aqueuses-du-systemepdf
II 2 4 Paramètres influençant la concentration micellaire critique 25 II 2 5 interactions telles que les mesures de viscosité de conductivité
 [PDF] Etude de la solubilisation micellaire ionique dun polluant organique
[PDF] Etude de la solubilisation micellaire ionique dun polluant organique
2 2 Méthodes 2 2 1 Mesures conductimètriques La concentration micellaire critique (CMC) des tensioactifs a été déterminée par des mesures de conductivité en
 [PDF] Synthèse de tensioactifs identification et caractérisation
[PDF] Synthèse de tensioactifs identification et caractérisation
17 jui 2019 · A Mesure de la Concentration Micellaire Critique par conductimétrie alors considérés comme des ions libres et la conductivité augmente
Comment déterminer la concentration micellaire critique ?
Détermination de la CMC
La valeur de la concentration micellaire critique dans un milieu donné dépend notamment de paramètres physicochimiques (T, pH, I) et de facteurs géométriques, comme le rapport entre la surface des têtes polaires des molécules de tensioactif et de la longueur des queues hydrophobes.Comment calculer une CMC ?
log CMC = A - B log S Où S est la salinité, et A et B sont deux paramètres qui dépendent du surfactif et de l'électrolyte.Pourquoi CMC ?
La CMC (pour Concentration Micellaire Critique) correspond à la concentration en tensioactif dans un milieu à partir de laquelle les micelles se forment de façon spontanée. En dessous de celle-ci le tensioactif forme une couche en surface du liquide et le reste est dispersé dans la solution.- Par frottement (lavage manuel ou en machine d'un tissu) les globules de graisse entourés de tensioactif se fractionnent donnant des globules plus petits qui s'entourent aussitôt de tensioactif et ceci plusieurs fois, jusqu'à se détacher de l'étoffe et se répartir dans l'eau de lavage sous forme d'une émulsion qui est
DOSSIER 8
LA CHIMIE DU SAVON
1 re générale - enseignement de spécialité • Constitution et transformation de la matièreLA CHIMIE DU SAVON ObjectifÉtudier des espèces chimiques comme les savons en illustrant leurs propriétés par analyse de la structure des tensioactifs. 1ère générale -
enseignement de spécialitéConstitution et transformation de la matièreThème 2
De la structure des entités aux propriétés physiques de la matière.Partie B
De la structure des entités à la cohésion et à la solubilité/miscibilité. Notions et contenusHydrophilie/lipophilie/amphiphile d'une espèce chimique organique.Compétences mobiliséesS'approprier APP
Analyser / Raisonner ANA/RAI
Réaliser REA
Valider VAL
© Nathan
LE SAVON :
UN PRODUIT QUI VIENT DE LOIN
On retrouve les premières traces de recettes
de savon, en Mésopotamie, sur des tablettes d'argile vieilles de plus de 4000 ans. Les
sumériens fabriquaient leur savon en mélan geant de l'huile végétale avec de l'argile. Mais ce n'est qu'à partir du IIe siècle après J.-C. que les Romains l'utiliseront pour se laver.Les Arabes, quant à eux, le développeront
en y ajoutant des cendres de plantes mari times contenant de la soude. Au IVe siècle, on retrouve une pâte de cendres et de graisse animale sous le nom de " sapo » (savon) qui tirerait son nom du mont Sapo, une mon tagne fictive qui aurait existé selon la légende quelque part près de Rome.Les usages du parfum en Égypte ancienne.© Divain.
David Soissons
1 re générale - enseignement de spécialité • Constitution et transformation de la matièreDOSSIER 8
LA CHIMIE DU SAVON
PARTIE A : Le savon à la graisse d'éléphant La graisse animale (éléphant, canard...) est utilisée dans le savon comme acide gras. Elle remplace les huiles végétales saponifiables. Elle permet de créer aussi cette réaction avec la soude, et ainsi de former un savon. Document 1 : Extrait des comptes rendus des séances de l'Acadé mie des sciences Chimie - Examen de la graisse et des concrétions trouvées dans le corps d'un élé phant femelle, mort récemment à Toulouse (1) par MM. E. Filhol et N. Joly. (Extrait par les auteurs) (Commissaires, MM. Chevreul, Isidore Geo?roy-Saint-Hilaire)" Tous les anatomistes qui ont disséqué des éléphants ont été frappés de la petite
quantité, et même de l'absence complète de graisse qu'ils observaient chez les indi vidus soumis à leur scalpel. Les organes ordinairement le plus chargés de tissus adipeux (épiplons , mésenières, reins ) n'en o?raient aucune trace dans l'éléphant dis- séqué par Perrault. Celui de Blain était dans le même cas. Nous en dirons autant de celui dont Camper a étudié l'anatomie, etc. » " Après les assertions si précises des auteurs que nous venons de citer, on sera peut-être surpris d'apprendre que l'éléphant femelle mort cette année à Toulouse(6 mai 1852) était pourvu d'une grande quantité de graisse, qu'elle s'échappait à l'état
liquide des incisions faites aux muscles par le couteau des équarisseurs, et venait se ?ger à la surface du sang qui s'écoulait des veines coupées en même temps. » " Après avoir saponi?é cette graisse, nous en avons extrait les acides au moyen de l'eau distillée bouillante et de l'acide chlorhydrique ; puis nous avons comprimé for- tement et à plusieurs reprises la masse obtenue entre des papiers à ?ltrer, a?n de séparer l'oléine. La portion solide restée dans le papier était d'une blancheur écla tante, douce au toucher, nacrée, friable, soluble en entier dans l'alcool et dans l'éther, rougissant franchement le tournesol. Puri?ée à l'aide de plusieurs cristallisations dans l'alcool, cette matière était faible à 59,6°. » " L'analyse élémentaire nous conduit aussi à regarder l'acide que nous avons obtenu comme étant de l'acide margarique. En e?et, nous avons trouvé qu'il est formé, sur cents parties, de : - carbone ......... 75,30 - hydrogène ..... 12,35 - oxygène ......... 12,35100,00
" Nous avons fait avec la graisse d'éléphant une très bonne pommade ainsi que du savon à détacher et du savon de toilette. » D'après https://www.mediachimie.org/ressource/étude-de-la-graisse-d'un-éléphant • Constitution et transformation de la matièreLA CHIMIE DU SAVON
APP/RAI Déterminer la formule brute de l'acide margarique. RAI/REA Vérifier que les pourcentages massiques trouvés par le chimiste valident bien la formule brute de l'acide margarique. APP/VAL Justifier qu'une caractéristique supplémentaire réalisée a permis de valider que l'acide obtenu correspondait bien à l'acide margarique.Document 2 : Données
Formule topologique de l'acide margarique :
T fusion, acide margarique = 59 à 61 °CMasse molaire en g.mol
-1 : M(C) = 12,0: M(O) = 16,0 ; M(H) = 1,0. 1 re générale - enseignement de spécialité • Constitution et transformation de la matièreDOSSIER 8
LA CHIMIE DU SAVON
Partie B : Comment agit un savon
En raison de la spécificité de ses molécules, le savon est un agent détergent capable aussi de modifier les propriétés de l'eau. En effet, un corps tensioactif sert à conférer à un liquide un pouvoir mouillant vis à vis de l'eau. On parle de propriété amphiphile des tensioactifs qui est à l'origine de l eur action dans les savons. RAI/VAL Définir le terme amphiphile en le justifiant pour un tensioactif. ANA/RAI Justifier la répartition des tensioactifs en surface puis celle dans les micelles. RAI/REA Schématiser l'eau savonneuse pour une concentration inférieureà la concentration micellaire critique.
RAI/REA Représenter une bulle de savon sachant qu'elle est formée d'une fine couche d'eau enfermant une bulle d'air en surface. Document 4 : La concentration micellaire critique et la moussabilité Pour que le savon soit e?cace pour laver une tâche, il est nécessaire que les micelles se forment en solution. Il faut donc atteindre une concentration en tensioactifs appelée concentration micellaire critique notée CMC. À ce niveau de concentration le pouvoir moussant est maximal. Si l'eau savonneuse est agitée, il se forme alors facilement de la mousse.Document 3 : Les tensioactifs en solution
Les tensioactifs sont des molécules
constituées de deux parties, l'une lipo phile (ou hydrophobe) et l'autre hydro phile. La partie lipophile n'a pas de charge électrique (électrostatique), alors que la partie hydrophile a une cer- taine charge électrique (?gure A).Placés en milieu aqueux, soit ils
se placent à la surface de l'eau, soit, pour ceux qui sont en solution, ils se rassemblent en amas (micelles) comme illustré sur la ?gure B.D'après
https://www.mediachimie.org/ ressource/la-chimie-et-les-produits- d'hygiène-et-de-soins-corporels 65Ils sont utilisés pour modifier la tension de surface de l'eau, af in de contribuer au nettoyage, au mouillage des surfaces, à la formation de mousse et d'émulsion (suspension d'un liquide dans un autre). Selon l'usage, les tensio-actifs peuvent être anioniques, cationiques, amphotères ou non ioniques (
Fig. 9
Encart " Les tensio-actifs »
Les tensio-actifs sont des molécules solubles dans l'eau qui possèdent la propriété de s'agré-
ger aux interfaces entre l'eau et d'autres substances peu solubles dans l'eau, en particulier les corps gras. Ces molécules sont constituées de deux parties, l'une lipophile (qui peut se lier aux matières grasses) et l'autre hydrophile (qui peut se li er à l'eau). La partie lipophile n'a pas de charge électrique (électrostatique), alors que la partie hydrophile a une certaine charge électrique.Composé tensioactif.
Placés en milieu aqueux, les tensio-actifs s'orientent de façon à éviter que leur pa rtie hydro- phobe soit au contact avec l'eau : soit ils se placent à la surface de l'eau, soit, pour ceux qui sont en solution, ils se rassemblent en amas (micelles) par regroupement de leur partie hydrophobe au centre, la partie hydrophile isolant celle-ci à l'extérieur.Figure A : représentation d'un tensioactif
65Ils sont utilisés pour modifier la tension de surface de l'eau, af in de contribuer au nettoyage, au mouillage des surfaces, à la formation de mousse et d'émulsion (suspension d'un liquide dans un autre). Selon l'usage, les tensio-actifs peuvent être anioniques, cationiques, amphotères ou non ioniques (
Fig. 9
Encart " Les tensio-actifs »
Les tensio-actifs sont des molécules solubles dans l'eau qui possèdent la propriété de s'agré-
ger aux interfaces entre l'eau et d'autres substances peu solubles dans l'eau, en particulier les corps gras. Ces molécules sont constituées de deux parties, l'une lipophile (qui peut se lier aux matières grasses) et l'autre hydrophile (qui peut se li er à l'eau). La partie lipophile n'a pas de charge électrique (électrostatique), alors que la partie hydrophile a une certaine charge électrique.Composé tensioactif.
Placés en milieu aqueux, les tensio-actifs s'orientent de façon à éviter que leur pa rtie hydro- phobe soit au contact avec l'eau : soit ils se placent à la surface de l'eau, soit, pour ceux qui sont en solution, ils se rassemblent en amas (micelles) par regroupement de leur partie hydrophobe au centre, la partie hydrophile isolant celle-ci à l'extérieur.Figure B: tensioactif en solution
1 re générale - enseignement de spécialité Constitution et transformation de la matièreDOSSIER 8
LA CHIMIE DU SAVON
Document 6 : Détermination de la concentration micellaire critique du SDSLa concentration micellaire critique
peut être déterminée par mesure de la conductivité de l'eau savonneuse.En e?et, la conductivité
ı d'une solution
traduit la capacité de celle-ci à conduire le courant. Elle est due à la présence en solution d'espèces ioniques mobiles. La mobilité diminue fortement avec la taille de l'espèce ionique.On observe une évolution de la conduc-
tivité d'une solution en tensioactifs en fonction de sa concentration représentée sur le graphique ci-contre où la concentra tion micellaire critique est lue à la rupture de pente.Mode opératoire :
- introduire dans le bécher un volume V 0 = 50 mL d'eau distillée puis y immerger une sonde conductimétrique ; - remplir une burette de solution de SDS à la concentration en mole C 0 = 4,0×10 -2 mol.L 1 - ajouter mL par mL la solution de SDS dans le bécher en relevant la valeur de la conductivité à chaque ajout ; - à l'aide de regressi, tracer la courbe = f(C) avec C concentration en SDS dans la solution. ANA/RAI Justifier si le SDS est un tensioactif anionique ou cationique. ANA/RAI Justifier le changement de pente observé sur le graphique ı = f(C) en décrivant l'état du système dans les deux situations. REA/VAL Réaliser le mode opératoire décrit dans le Document 6 puis déterminer la valeur de la concentration micellaire critique du SDS.Document 5 : Le dodécylsulfate de sodium
Le dodécylsulfate de sodium (SDS) est un
tensioactif ionique fort, couramment uti lisé en biochimie et biologie moléculaire.Il est utilisé dans les produits ménagers
tels que les dentifrices, shampooings, mousses à raser ou encore bains moussants pour ses e?ets épaississants et sa capa cité à créer une mousse. Sa formule topologique est donnée dans la ?gure A.D'après
Figure A : formule topologique du SDS
• Constitution et transformation de la matièreLA CHIMIE DU SAVON
APP Préciser pourquoi le savon de Marseille est très utilisé. RAI/VAL Comparer l'efficacité des deux tensioactifs. APP/RAI Déduire l'effet de la longueur de la chaine carbonée sur la valeur de la concentration micellaire critique. On fera une analyse en précisant les interactions mises en jeu.Document 7 : Le savon de Marseille traditionnel
Le savon de Marseille traditionnel est largement utilisé pour ses propriétés hypoal lergénique et biodégradable. Il ne contient ni colorant, ni adjuvant de synthèse et ni conservateur. Il est souvent fabriqué à partir d'huile d'olive et de soude. Le tensioactif présent est alors l'oléate de sodium de formule topologique : La valeur de la CMC de l"oléate de sodium est de l"ordre du µmol.L -1 • Constitution et transformation de la matièreLA CHIMIE DU SAVON
REA/ANA Réaliser le mode opératoire décrit dans le Document 8 puis déterminer en justifiant l'effet d'une eau dure sur l'efficacité d'un savon. RAI/VAL Interpréter les observations en précisant les équations chimiques des réactions ayant lieu dans le cas de l'eau d'Hépar. APP/RAI Justifier pourquoi les adjuvants permettent de renforcer le pouvoir nettoyant des produits d'hygiène. RAI/REA Proposer puis réaliser (après validation du professeur) un mode opératoire permettant de mettre en évidence l'effet du pH sur l'efficacité du savon. VAL Indiquer l'intérêt de l'ajout de carbonate de sodium dans les produits d'hygiène. Document 9 : Les adjuvants dans les produits d'hygiène Pour réduire la dureté de l'eau et renforcer le pouvoir nettoyant, on ajoute dans les produits d'hygiène di?érents produits :quotesdbs_dbs35.pdfusesText_40[PDF] titrage indirect exemple
[PDF] dosage par étalonnage
[PDF] etalonnage du permanganate de potassium par le sel de mohr
[PDF] couleur des ions mn2+
[PDF] dosage par comparaison premiere es
[PDF] qualité des sols et de l eau bac
[PDF] qualité des sols et de l eau 1ère es
[PDF] dosage par étalonnage conductimétrique
[PDF] dosage par étalonnage terminale s
[PDF] tp dosage par étalonnage avec un conductimètre correction
[PDF] protocole dosage par titrage
[PDF] titrage conductimétrique d'un sérum physiologique correction
[PDF] dosage par étalonnage def
[PDF] tp spectrophotométrie dosage par étalonnage

