 Catalyse hétérogène: une affaire de surface(s)
Catalyse hétérogène: une affaire de surface(s)
Cycle catalytique et catalyse hétérogène. Intermédiaire. Page 5. Sélectivité d'un catalyseur gaz de synthèse. Handbook of Heterogeneous Catalysis Wiley
 La catalyse hétérogène
La catalyse hétérogène
Un cas particulier est la catalyse enzymatique [2-3] qui se déroule à basse température (25-40 °C)
 Phénomènes de surface et Catalyse hétérogène
Phénomènes de surface et Catalyse hétérogène
Donner les bases de la catalyse hétérogène et les différents techniques d'élaboration des catalyseurs. Montrer succinctement la complexité de l' acte
 CATALYSE HETEROGENE. ADSORPTION
CATALYSE HETEROGENE. ADSORPTION
Oct 24 2011 CATALYSE HETEROGENE. Dans les processus de catalyse hétérogène
 Nouveaux matériaux à caractère basique pour la catalyse hétérogène
Nouveaux matériaux à caractère basique pour la catalyse hétérogène
La mise au point de procédés « propres » constitue ainsi un réel enjeu pour la catalyse basique hétérogène. aux multiples applications en catalyse acide ...
 CATALYSE HETEROGENE PAR DES SELS ET SANS SOLVANT III
CATALYSE HETEROGENE PAR DES SELS ET SANS SOLVANT III
CATALYSE HETEROGENE PAR DES SELS ET SANS SOLVANT. III *. SYNTHESE DE COMPOSES CARBONIZES cu$3 INSATURES A. PARTIR D'ETHERS D'ENOLS SILYLES. J. BOYER R.J.P.
 Principes de catalyse hétérogène
Principes de catalyse hétérogène
Thèmes abordés. Le cours donne une vue d'ensemble complète de la catalyse en particulier la catalyse hétérogène. Les familles de catalyseurs et de procédés
 Cours Phénomènes de surface et catalyse hétérogène
Cours Phénomènes de surface et catalyse hétérogène
Q : quantité de catalyseur utilisé. Pour évaluer l'activité d'un catalyseur solide (catalyse hétérogène) on peut soit faire appel à la mesure du rendement
 Matériaux catalytiques et catalyse hétérogène
Matériaux catalytiques et catalyse hétérogène
Mots-clés. Catalyse hétérogène matériaux
 Catalyse hétérogène: une affaire de surface(s)
Catalyse hétérogène: une affaire de surface(s)
La même réacFon avec un catalyseur: sur le nouveau chemin de réacFon. Ea est maintenant faible
 CATALYSE HETEROGENE. ADSORPTION
CATALYSE HETEROGENE. ADSORPTION
24-Oct-2011 Dans les processus de catalyse hétérogène le catalyseur est solide ... hétérogène
 Cours Phénomènes de surface et catalyse hétérogène
Cours Phénomènes de surface et catalyse hétérogène
cinétique chimique dans certaines réactions de catalyse hétérogène. Enfin les enseignants et les masters concernés peuvent y trouver des informations
 Physico-chimie des surfaces et catalyse hétérogène
Physico-chimie des surfaces et catalyse hétérogène
Physico-chimie des surfaces et catalyse hétérogène. Cours et applications. Samir KENOUCHE. Polycopié de cours. Visiter ma page personnelle.
 La catalyse hétérogène
La catalyse hétérogène
La catalyse hétérogène met en présence un catalyseur solide (principalement des oxydes ou des métaux) et des réactifs à l'état gazeux ou liquide. Plus rarement
 Principes de catalyse hétérogène
Principes de catalyse hétérogène
Le cours donne une vue d'ensemble complète de la catalyse en particulier la catalyse hétérogène. Les familles de catalyseurs et de procédés catalytiques
 Matériaux catalytiques et catalyse hétérogène
Matériaux catalytiques et catalyse hétérogène
Mots-clés. Catalyse hétérogène matériaux
 ÉTUDE DES PHENOMENES CATALYTIQUES EN CHIMIE DES
ÉTUDE DES PHENOMENES CATALYTIQUES EN CHIMIE DES
cobalt sur une réaction catalytique hétérogène en soumettant le catalyseur solide à une irradiation préalable. La réaction étudiée est l'oxydation de CO
 REDUCTION SELECTIVE DE COMPOSES CARBO~YLES PAR
REDUCTION SELECTIVE DE COMPOSES CARBO~YLES PAR
PAR CATALYSE HETEROGENE A LA SURFACE DES SELS. J. BOYER R. J. P. C~R~IU*
 Cinetique et catalyse (Collection Genie des procedes de l ecole de
Cinetique et catalyse (Collection Genie des procedes de l ecole de
les réactions hétérogènes catalytiques où le processus réactionnel se produit à une réaction catalytique hétérogène indépendante de la réaction ...
Version PDF - Polycopié de cours Copyright©2016 Samir KenouchePhysico-chimie des surfaces et catalyse hétérogène
Cours et applicationsSamir KENOUCHE
Polycopié de cours
Visiter ma page personnelle
http://sites.univ-biskra.dz/kenouche Version PDF - Polycopié de cours Copyright©2016 Samir KenoucheTable des matièresTable des figures
31 Phénomènes de surface
71.1 Tension de surface et énergie libre de surface
. . . . . . . . . . . . . . . 91.1.1 Tension superficielle et fonctions thermodynamiques
. . . . . . . 111.1.2 Tension superficielle vs température
. . . . . . . . . . . . . . . . 131.2 Surface courbe
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 141.2.1 Équation de Laplace
. . . . . . . . . . . . . . . . . . . . . . . . 141.2.1.1 Première approche
. . . . . . . . . . . . . . . . . . . . 141.2.1.2 Deuxième approche
. . . . . . . . . . . . . . . . . . . . 161.2.2 Équation de Kelvin
. . . . . . . . . . . . . . . . . . . . . . . . . 171.3 Méthodes de mesure de la tension superficielle
. . . . . . . . . . . . . . 181.3.1 Loi de Jurin :ascension et dépression capillaires. . . . 18
1.3.2 Méthode du stalagmomètre
. . . . . . . . . . . . . . . . . . . . 221.3.3 Méthode de l"arrachement de l"anneau
. . . . . . . . . . . . . . 242 Tension de surface et tension interfaciale
302.1 Tension de surface de solutions aqueuses
. . . . . . . . . . . . . . . . . 312.2 Isotherme de Gibbs - concentration superficielle
. . . . . . . . . . . . . 322.2.1 Estimation de l"aire d"une molécule
. . . . . . . . . . . . . . . . 362.2.2 Pression de surface
. . . . . . . . . . . . . . . . . . . . . . . . . 363 Étude physico-chimique de la tensio-activité
413.1 Travail d"adhésion - travail de cohésion
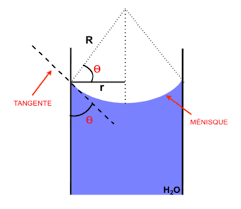
. . . . . . . . . . . . . . . . . . 423.2 Angle de contact - équation de Young
. . . . . . . . . . . . . . . . . . . 423.3 Le mouillage
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 473.3.1 Effet de la gravité
. . . . . . . . . . . . . . . . . . . . . . . . . . 473.4 La détersion par des agents tensioactifs
. . . . . . . . . . . . . . . . . . 483.4.1 Mécanisme de la détersion
. . . . . . . . . . . . . . . . . . . . . 493.4.2 Classification des agents détersifs
. . . . . . . . . . . . . . . . . 493.4.3 Concentration micellaire critique CMC
. . . . . . . . . . . . . . 503.4.4 Température de Krafft
. . . . . . . . . . . . . . . . . . . . . . . 524 Phénomène d"adsorption
564.1 Définition
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 574.1.1 Forces de Van der Waals
. . . . . . . . . . . . . . . . . . . . . . 58 1 Version PDF - Polycopié de cours Copyright©2016 Samir KenoucheTable des matières4.2 Mesure expérimentale
. . . . . . . . . . . . . . . . . . . . . . . . . . . . 604.3 Isothermes d"adsorption
. . . . . . . . . . . . . . . . . . . . . . . . . . 614.3.1 Isotherme de Langmuir
. . . . . . . . . . . . . . . . . . . . . . . 624.3.2 Isotherme de Temkin
. . . . . . . . . . . . . . . . . . . . . . . . 644.3.3 Isotherme de Freundlich
. . . . . . . . . . . . . . . . . . . . . . 664.3.4 Théorie de BET
. . . . . . . . . . . . . . . . . . . . . . . . . . . 664.3.5 Évaluation de la surface spécifique
. . . . . . . . . . . . . . . . 714.3.6 Détermination du rayon des pores
. . . . . . . . . . . . . . . . . 725 Adsorption compétitive et cinétique hétérogène
775.1 Adsorption compétitive
. . . . . . . . . . . . . . . . . . . . . . . . . . . 785.1.1 Généralisation
. . . . . . . . . . . . . . . . . . . . . . . . . . . . 795.2 Adsorption dissociative-compétitive
. . . . . . . . . . . . . . . . . . . . 795.3 Chaleur d"adsorption
. . . . . . . . . . . . . . . . . . . . . . . . . . . . 805.4 Cinétique chimique en catalyse hétérogène
. . . . . . . . . . . . . . . . 815.4.1 Influence de la Température
. . . . . . . . . . . . . . . . . . . . 815.4.2 Influence d"un catalyseur
. . . . . . . . . . . . . . . . . . . . . . 835.5 Modèle de Langmuir-Hinshelwood
. . . . . . . . . . . . . . . . . . . . . 845.6 Modèle de Eley-Rideal
. . . . . . . . . . . . . . . . . . . . . . . . . . . 87 2 Version PDF - Polycopié de cours Copyright©2016 Samir KenoucheTable des figures1.1 Diagramme de phase d"un corps pur, montrant les domaines de stabilité
du solide cristallin, du liquide et de la vapeur. . . . . . . . . . . . . . . 81.2 Origine microscopique de la tension superficielle
. . . . . . . . . . . . . 91.3 Mise en évidence de la tension superficielle
. . . . . . . . . . . . . . . . 101.4 Évolution de la tension superficielle en fonction de la température
. . . 131.5 Tension superficielle en fonction de la température
. . . . . . . . . . . . 141.6 Interface courbe
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 51.7 Surpression de la goutte
. . . . . . . . . . . . . . . . . . . . . . . . . . 161.8 Ascension capillaire pour un liquide mouillant
. . . . . . . . . . . . . . 191.9 Ascension capillaire et angle de contact
. . . . . . . . . . . . . . . . . . 191.10 Dépression capillaire
. . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 01.11 Forces capillaires
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 211.12 Ascension capillaire et forces de surface
. . . . . . . . . . . . . . . . . . 221.13 Goutte en équilibre
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 231.14 Méthode d"arrachement
. . . . . . . . . . . . . . . . . . . . . . . . . . . 241.15 Les différentes étapes de la mesure par la méthode d"arrachement.
. . . 252.1 Tension superficielle des solutions aqueuses (25◦C) : cas des composés
organiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 312.2 Allure théorique de la courbe :γ=f(ln(C)).. . . . . . . . . . . . . . . 34
2.3 Concentration micellaire critique du SDS dans duNaCl. . . . . . . . 35
2.4 Variation de la concentration superficielle (Γs) en fonction de la concen-
tration du soluté . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 363.1 Angle de contact. (A)θ <π2
et (B)θ >π2 . . . . . . . . . . . . . . . . . 433.2 Point triple
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 433.3 Forces mises en jeu à l"interface solide-liquide
. . . . . . . . . . . . . . 453.4 Modèle deOwens-Wendtà deux composantes. . . . . . . . . . . . . . . 46
3.5 Longueur capillaire
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 483.6 Formule topologique du Sodium DodecylSulfate ouSDSde formule
bruteC12H25NaSO4. . . . . . . . . . . . . . . . . . . . . . . . . . . . 483.7 Illustration du mécanisme de la détersion.
. . . . . . . . . . . . . . . . 4 93.8 Configurations des molécules de tensioactifs
. . . . . . . . . . . . . . . 513.9 Diagramme de forme des micelles en fonction du paramètre d"empilement
523.10 Température deKrafftdu Dodécylsulfate de Sodium. . . . . . . . . . 53
4.1 Simulation du potentiel deLennard-Jones(N= 2) avec Matlab. . . . 59
3 Version PDF - Polycopié de cours Copyright©2016 Samir KenoucheTable des matières4.2 Mesure des isothermes par la méthode volumétrique
. . . . . . . . . . . 604.3 Différents types d"isothermes d"adsorption
. . . . . . . . . . . . . . . . 624.4 Influence de la constanteb. . . . . . . . . . . . . . . . . . . . . . . . . 64
4.5 Intervalles énergétiques deTemkin. . . . . . . . . . . . . . . . . . . . . 65
4.6 Principe de remplissage des différentes surfaces selon BET
. . . . . . . 674.7 Influence du nombre de couchesN. . . . . . . . . . . . . . . . . . . . 69
4.8 Influence de la constanteC. . . . . . . . . . . . . . . . . . . . . . . . . 70
4.9 Adsorption multicouches et condensation capillaire
. . . . . . . . . . . 704.10 Mesure de la surface spécifique
. . . . . . . . . . . . . . . . . . . . . . . 715.1 Action d"un catalyseur
. . . . . . . . . . . . . . . . . . . . . . . . . . . 845.2 Cinétique d"une réaction monomoléculaire
. . . . . . . . . . . . . . . . 855.3 Cinétique d"une réaction bimoléculaire
. . . . . . . . . . . . . . . . . . 865.4 Cinétique d"une réaction bimoléculaire selonEley-Rideal. . . . . . . 88
4 Version PDF - Polycopié de cours Copyright©2016 Samir KenouchePréambule Ce polycopié de cours se veut avant tout introductif, dans la mesure où les connaissances exposées sont du niveau du premier cycle universitaire. Il a pour vocation d"initier les étudiants (es) aux concepts fondamentaux des phénomènes de surface. Conscient de garder un caractère purement pédagogique, toutes les notions abordées dans ce polycopié sont strictement conformes au programme officiel. La composition typographique est réalisée au moyen du logicielLatex, sous un environnementLinux. Les différentes illustrations sont soit modifiées ou conçues en utilisant le logicielInkscape0.48.0. Ces notes de cours doivent être prises comme l"un des éléments contribuant au transfert de l"information. Ainsi, l"étudiant doit intégrerd"autres éléments, à l"instar des séances de travaux dirigés et travaux pratiques afin
de compléter ce processus de transfert. Par ailleurs, ces notes de cours sont réparties en cinq chapitres. Le corps de chacun des chapitres se limite à l"exposé des acquisitions de base. Le premier chapitre traite les notions fondamentales des phénomènes de surface, à l"instar de latension superficielle, équation de Kelvin, équation de Laplace, loi de Jurin et autres. Le deuxième chapitre est consacré à l"étude de la tension de surface de solutions aqueuses. Dans le troisième chapitre, il est question de présenter une étude détaillée sur la physico-chimie de la tensio-activité. Le quatrième chapitre est dédié à l"étude des isothermes d"adsorption et à la description des modèles d"adsorption :Langmuir, Temkin, BET, Freundlich. Dans le dernier chapitre, sont exposés les fondements théoriques de la cinétique hétérogène en se basant sur les modèles deLangmuir-Hinshelwoodet deEley-Rideal. Toutefois, chaque chapitre estsuivi d"une série d"exercices à résoudre afin de tester et de consolider sa compréhension.
Dans un autre registre, ce document comporte, sans nul doute, des imperfections. C"est la raison pour laquelle j"ai laissé ce document à la disposition des internautes, intéressés par cette discipline, de me suggérer d"éventuelles remarques et recomman- dations en m"envoyant un mail à l"adresse suivante :)kennouchesamir@gmail.com 5Version PDF - Polycopié de cours Copyright©2016 Samir KenoucheOn entamera ces notes de cours à partir de quelques observations des phénomènes
naturels qui semblent défier les lois de la physique en milieu aquatique.Le lézard Jésus-Christ, est un lézard
présent en Amérique Latine pouvant mesurer jusqu"à80cm(sa queue fait à peu près les deux tiers de son corps). Il se perche dans les arbres près des cours d"eau et se laisse tomber dans l"eau quand il sent le danger venir. Pesant entre2grammes pour un bébé et200grammes à l"age adulte. Ce lézard a la faculté de se mouvoir, à la surface de l"eau, avec une vitesse de1.5m/s.Dans notre vie quotidienne, on observe que
les gouttes et les bulles adoptent spontanément une forme sphérique. On peut donc légitime- ment se poser la question : À quoi est dûe cette forme sphérique?. Intuitivement, sans exposer les détails techniques, on comprend que la forme sphérique présente le plus faible rapportsurface/volume. Ceci explique par ailleurs cette tendance des liquides à diminuerleurs surfaces. Ainsi, à cette échelle, il devient évident qu"il existe une force qui défie
la gravité, en s"opposant à toute augmentation de la surface libre.Dans la nature, certains insectes, tels les
gerris, encore appelés araignées d"eau, ont la faculté de marcher sur l"eau sans s"enfoncer.Ils pèsent en moyenne2grammes. En effet,
les pattes et l"abdomens des gerris sont munis de très nombreux poils microscopiques, très hydrophobes. Donc ces parties hydrophobes ne s"imprègnent pas d"eau et augmentent laquotesdbs_dbs20.pdfusesText_26[PDF] cataracte operation duree
[PDF] cataracte operation video
[PDF] cataracte precaution apres operation
[PDF] cataracte secondaire causes
[PDF] cataracte secondaire forum
[PDF] cataracte secondaire laser
[PDF] cataracte secondaire récidive
[PDF] cataracte secondaire symptomes
[PDF] cate respiratii pe minut sunt normale
[PDF] categorias de la lucha olimpica
[PDF] catégorie 13 fonction publique algerie
[PDF] catégorie age handball
[PDF] categorie age handball 2017
[PDF] catégorie d'age handball 2017-2018

