 ÿþC o n c o u r s d I n t e r n a t b l a n c G a l i e n
ÿþC o n c o u r s d I n t e r n a t b l a n c G a l i e n
21 mars 2010 Le coefficient d'extinction molaire pour le NADHH+ est de 6
 Isomérisation photosensibilisée par des colorants et photoréduction
Isomérisation photosensibilisée par des colorants et photoréduction
1'isomCrisation de la forme cis de l'azo- benzene. Le coefficient d'extinction molaire du bleu de mCthylene 578 nm est 31 600 mol-' 1 cm-l. Nous avons
 Infinity™ Réactif Liquide Stable de LAmylase
Infinity™ Réactif Liquide Stable de LAmylase
Le coefficient d'extinction molaire du pNP dans ce système de réactifs à 410 nm. = 980
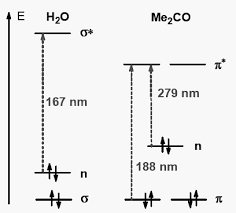 CHAPITRE I-spectroscopie dabsorption UV-visible
CHAPITRE I-spectroscopie dabsorption UV-visible
) et par son intensité reliée au coefficient d'extinction molaire εmax (A = εlC). La position du maximum d'absorption correspond à la longueur d'onde de la.
 Thème 4 – Chapitre 1 – Activité 1 - EXTRACTION DE LA VANILLINE
Thème 4 – Chapitre 1 – Activité 1 - EXTRACTION DE LA VANILLINE
e : coefficient d'extinction molaire en L.mol-1.cm-1 l : longueur du trajet optique (cuve de mesure) en cm. C : concentration molaire de la substance
 III – C Le choix dun couple donneur-accepteur dépend de la
III – C Le choix dun couple donneur-accepteur dépend de la
* la valeur du coefficient d'extinction molaire est donnée pour le pic d'absorption. Sur la base des caractéristiques décrites précédemment les
 Dosage en microplaque de lactivité enzymatique AChE du gammare
Dosage en microplaque de lactivité enzymatique AChE du gammare
16 mai 2020 ε. = coefficient d'absorption molaire du TNB = 00136 mM-1 cm-1. ... optique et du coefficient d'absorption molaire utilisés pour l'expression en ...
 Cinétique de phototransformation de polluants organiques
Cinétique de phototransformation de polluants organiques
11 avr. 2023 Les spectres d'absorption UV/Visible des composés sont présentés dans les figures 2 et 3 et les valeurs des coefficients d'absorption molaire ...
 EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
En déduire la valeur du coefficient d'absorption molaire de CuY2‐ noté εY
 Thèse de doctorat
Thèse de doctorat
L'absorbance maximale utilisée est observée à la longueur d'onde de β78 nm et le coefficient d'extinction utilisé est de 096 L.g-1.cm-1. La masse molaire de la
 Untitled
Untitled
concentration c de l'espèce absorbante à son coefficient d'extinction molaire e(^) et aux propriétés de la cuve. Définir chaque terme et en préciser
 Spectres dAbsorption UV-VIS - OECD iLibrary
Spectres dAbsorption UV-VIS - OECD iLibrary
May 12 1981 ... est caractérisée à la fois par le coefficient d'absorption molaire (coefficient d'extinction molaire) et par la largeur de la bande.
 ÿþC o n c o u r s d I n t e r n a t b l a n c G a l i e n
ÿþC o n c o u r s d I n t e r n a t b l a n c G a l i e n
Mar 20 2010 Le coefficient d'extinction molaire pour le NADH
 Infinity™ Réactif Liquide Stable de LAmylase
Infinity™ Réactif Liquide Stable de LAmylase
Le coefficient d'extinction molaire du pNP dans ce système de réactifs à 410 nm. = 980
 Première manipulation
Première manipulation
En cette longueur d'onde ?iso les coefficients d'absorption molaires ?(?iso
 1. Théorie de Born-Oppenheimer. 2. Domaine de lU.V. 3. Loi de
1. Théorie de Born-Oppenheimer. 2. Domaine de lU.V. 3. Loi de
de la cuve et à la concentration molaire volumique du composé. Le coefficient de proportionnalité s'appelle le coefficient d'extinction molaire ? : D = ?
 Épreuve expérimentale
Épreuve expérimentale
où b est la longueur de la cuve et ? le coefficient d'absorption molaire. Les coefficients d'absorption molaires du bleu de bromothymol sous forme acide.
 Thème 4 – Chapitre 1 – Activité 1 - EXTRACTION DE LA VANILLINE
Thème 4 – Chapitre 1 – Activité 1 - EXTRACTION DE LA VANILLINE
e : coefficient d'extinction molaire en L.mol-1.cm-1 l : longueur du trajet optique (cuve de mesure) en cm. C : concentration molaire de la substance
 Fiche E1- Pollution acide
Fiche E1- Pollution acide
et coefficient d'extinction molaire (L.mol-1.cm-1) et section efficace (cm2.molécule-1) de la molécule (efficacité d'absorption du rayonnement par la
 C Le choix dun couple donneur-accepteur dépend de la technique
C Le choix dun couple donneur-accepteur dépend de la technique
* la valeur du coefficient d'extinction molaire est donnée pour le pic d'absorption. Sur la base des caractéristiques décrites précédemment les fluorophores
 TR00064 Introduction - Thermo Fisher Scientific
TR00064 Introduction - Thermo Fisher Scientific
percent solution extinction coefficients (i e one must convert from 10 mg/ml units to 1 mg/ml concentration units) (A / ? percent) 10 = concentration in mg/ml The relationship between molar extinction coefficient (? molar) and percent extinction coefficient (? percent) is as follows: (? molar) 10 = (? percent) × (molecular
 Déterminer un coefficient d'extinction molaire Méthode - Kartable
Déterminer un coefficient d'extinction molaire Méthode - Kartable
(en mol-1 L cm-1) est le coefficient d’extinction molaire de l’espèce absorbante en solution Ce coefficient dépend de : •la nature de la substance •la longueur d’onde ? de la lumière •la nature du solvant •la température La loi de Beer-Lambert est additive (mais non la transmittance)
 Page : 1/ 8 Introduction aux techniques de luminescence et
Page : 1/ 8 Introduction aux techniques de luminescence et
Un coefficient d’extinction molaire ? (M-1 cm-1) le plus élevé possible C’est la capacité d’un fluorophore à absorber l’énergie apportée par un photon à une longueur d’onde Un rendement quantique (?) élevé C’est la capacité du fluorophore à ré-émettre sous forme de lumière l’énergie absorbée
 Thème 4 – Chapitre 1 – Activité 1
Thème 4 – Chapitre 1 – Activité 1
e: coefficient d’extinction molaire en L mol-1 cm-1 l : longueur du trajet optique (cuve de mesure) en cm C : concentration molaire de la substance absorbante dans le milieu de lecture en mol L-1 Les limites de validité de cette loi sont : - l’utilisation d’une lumière monochromatique ;
Comment calculer un coefficient d'extinction molaire ?
L'expression littérale de varepsilon est : varepsilon = dfrac {A} {l imes C}. L'unité du coefficient d'extinction molaire sera L.mol -1 .cm -1 . On effectue l'application numérique, le résultat étant alors le coefficient d'extinction molaire de l'espèce considérée, pour la longueur d'onde donnée.
Qu'est-ce que le coefficient d'extinction molaire ?
?(?) (lettre grecque epsilon minuscule) est le coefficient d’extinction molaire, il dépend de la longueur d’ onde mais aussi du solvant, du soluté responsable de l’absorption, de la température et dans une moindre mesure de la pression. Son unité est le litre par mole et par centimètre (L. mol -1.cm-1)
Quels sont les rayonnements les plus utilisés dans la liaison chimique?
Les rayonnements les plus souvent utilisés sont l’ultraviolet (UV), la lumière visible et l’infrarouge (IR). Le domaine du visible et de l’UV a été abondamment étudié, et ce depuis longtemps. Mais s’il est indispensable pour une approche expérimentale de la nature de la liaison chimique, il est pauvre en information structurale.