|
Cours Chimie 5eC v2018
Quelle est la différence principale de la combustion du fer et de l'oxydation du fer en rouille ? Exercice C24 : * Combustion du dihydrogène (H2) Une pile à |
|
Cours n°7 : La combustion du fer et du carbone
Le carbone et le fer brûlent dans le dioxygène avec une incandescence (lumière) et un dégagement de chaleur 25 Page 26 III Synthèse Une réaction chimique |
|
La réaction chimique
La réaction entre le fer sur le soufre donne le sulfure de fer de formule FeS Bilan de cette réaction: II- Distinction entre la transformation chimique et |
|
Les cycles du soufre et du fer en 5
sulfure de fer et acide chlorhydrique diminuant la solubilité du gaz sulfure d'hydrogène en solution de par la combustion du sulfure d'hydrogène au fur et |
|
S chimique s réaction les
Fer + Soufre → Sulfure de fer • Equation bilan Fe + S → FeS Remarque : -Le fer et le soufre disparaissent : ils sont les réactifs de cette réaction |
Est-ce que la réaction de soufre et le fer est une transformation chimique ?
Lorsqu'on chauffe un mélange de fer (gris) et de soufre (jaune) en poudre, il se forme une nouvelle espèce chimique dans laquelle il n'est plus possible de séparer le fer du soufre : C'est du sulfure de fer(gris-noir).
Quelle est la réaction de la combustion du soufre ?
La combustion vive du soufre est accompagnée d'une flamme bleue caractéristique.
Cette oxydation produit du dioxyde de soufre (SO2 ou anhydride sulfureux), mélangé à une petite quantité d'anhydride sulfurique (SO3) et de disulfure de carbone (CS2).Quels sont les réactifs lors de la combustion du fer ?
Formule des réactifs : Fe pour le fer et O2 pour le dioxygène.
Formule du produit : Fe3O4 pour l'oxyde magnétique de fer.
La formule Fe3O4 signifie qu'en proportion, on trouve dans ce matériau 3 atomes de fer pour 4 atomes d'oxygène.- Un morceau de fer plongé dans une flamme ne brûle pas.
Il rougit sous son action, puis se recouvre d'une pellicule noire lorsqu'il refroidit.
Ce résidu est de l'oxyde de fer.
C'est le produit de la réaction entre le fer et le dioxygène de l'air sous l'action de la chaleur.
|
Les réactions chimiques
Il y a une transformation chimique ; le Soufre et le Fer disparaîssent et le Sulfure de Fer (FeS) apparaît. Cette réaction n'est pas une combustion car on n'a |
|
2. Réactions chimiques
une combustion. Tu sais déjà que toute combustion néces- site du dioxygène. Pesons 7g de poudre de fer et 4g de poudre de soufre et mé-. |
|
CORRIGÉ du Devoir Surveillé n°1
1 oct. 2015 On referme hermétiquement le flacon. On observe alors une combustion lente du soufre dans l'air avec une flamme bleutée caractéristique. On. |
|
4ch9c.pdf
Que peut-on dire de l'arrangement des atomes avant et après la combustion ? ôe rcuke lii Complète les équations de combustion dLl fer et du soufre :. |
|
MA. 310 – CS 1.0 Détermination du carbone et du soufre : méthode
10 oct. 2006 CENTRE D'EXPERTISE EN ANALYSE ENVIRONNEMENTALE DU QUÉBEC. Détermination du carbone et du soufre : méthode par combustion et dosage par. |
|
Les cycles du soufre et du fer en Cinquième
de ce gaz par combustion supprime-t-elle ce deuxième risque. Il est bon toutefois |
|
S chimique s réaction les
1- le bilan de cette réaction de combustion : Lors de la combustion du On brûle le mélange de limaille de fer et du soufre avec la flamme du bec Bunsen. |
|
Cuivre + soufre ? sulfure de cuivre dichlore + sodium ? chlorure de
La combustion du carbone en présence de dioxygène fournit du dioxyde de carbone. 7 g de fer réagissent avec 4 g de soufre pour former du sulfure de fer. |
|
Rubrique 1523 : Soufre Fabrication industrielle fusion et distillation
Le soufre est inflammable et sa combustion dégage des produits toxiques comme observées avec le fer |
|
Cycles biogéochimiques du Fer et du Soufre dans les systèmes
7 nov. 2017 Cycles biogéochimiques du Soufre et du Fer et interactions ... lors d'éruptions volcaniques mais aussi lors d'activités humaines (combustion. |
|
RÉACTION ENTRE LE FER ET LE SOUFRE - mediatheq?esmadorg
1er cas: si la combustion continue le soufre réagit avec le dioxygène de l’air pour donner du gaz SO2 2ème cas: si la combustion d’arrête le soufre en excès reste à l’état pur c) Masse du sulfure de fer obtenu: m = 56 +32 = 88g d) Nombre de moles de sulfure de fer obtenu: La masse molaire moléculaire du sulfure de fer est 88g |
|
Chapitre 5 les réactions chimiques - AlloSchool
Il y a une transformation chimique ; le Soufre et le Fer disparaissent et le Sulfure de Fer apparait Cette réaction n’est pas une combustion car on n’a pas de dioxygène aux réactifs Bilan Soufre + Fer Sulfure de Fer Réactifs Produits III Lois de réaction chimique : 1) Expérience et résultat : Lors de la réaction entre le Soufre |
Comment calculer la combustion du soufre ?
Les réactifs sont le soufre (S) et le dioxygène (O 2 ). Le corps formé est le dioxyde de soufre (SO 2 ). L'équation-bilan de la combustion du soufre s'écrit : S + O 2 ? SO 2 Cette réaction chimique est exothermique. NB : La combustion du soufre donne une petite quantité de trioxyde de soufre (SO 3) qui apparaît sous forme de fumées blanches.
Quel est le réactif de la réaction entre le fer et le soufre ?
La réaction entre le fer sur le soufre donne le sulfure de fer de formule FeS. -Le fer et le soufre disparaissent : ils sont les réactifs de cette réaction chimique. Le sulfure de fer apparaît, il en est le produit On fait réagir du fer sur du soufre pour obtenir du sulfure de fer. a- Quelle sera le réactif en excès ?
Comment se déroule la combustion du fer ?
Lors de la combustion du fer, plus celui-ci est finement divisé (limaille de fer, laine de fer), plus il se brule facilement. On déclenche la combustion du fer en brulant de la paille de fer dans l’air. Puis on place la paille de fer dans un flacon contenant du dioxygène pur. Au bout d’un moment, la combustion s’arrête car le dioxygène a disparu.
Quel est le réactif excédent du sulfure de fer ?
Par conséquent, si on mélange 56g de fer avec 35g de soufre, le réactif excédent est le soufre. 1er cas : si la combustion continue, le soufre réagit avec le dioxygène de l’air pour donner du gaz SO2. 2ème cas : si la combustion d’arrête, le soufre en excès reste à l’état pur. La masse molaire moléculaire du sulfure de fer est 88g.mol-1,
Quelle est la combustion du fer ?
. Cette réaction chimique est exothermique.
Quelle est la combustion du soufre ?
. Cette oxydation produit du dioxyde de soufre (SO2 ou anhydride sulfureux), mélangé à une petite quantité d'anhydride sulfurique (SO3) et de disulfure de carbone (CS2).
Comment se forme le sulfure de fer ?
. Le sulfure de fer(II) réagit avec l'acide chlorhydrique en donnant du chlorure de fer(II) et du sulfure d'hydrogène : FeS + 2 HCl ? FeCl2 + H2S.
Comment se fait l'oxydation du fer ?
|
2 Réactions chimiques
Tu sais déjà que toute combustion néces- Le fer et le soufre sont deux corps simples Pesons 7g de poudre de fer et 4g de poudre de soufre, et mé- |
|
Cuivre + soufre → sulfure de cuivre dichlore + sodium → chlorure de
La combustion du carbone en présence de dioxygène fournit du dioxyde de carbone 7 g de fer réagissent avec 4 g de soufre pour former du sulfure de fer |
|
Unité 3 : Réactions Chimiques Chapitre 7 : Réactifs et Produits
La combustion du mélange formé par la poudre de fer et la fleur de soufre produit une poudre grise de sulfure de fer a- Un réactif est une substance qui se |
|
1 Le soufre - AC Nancy Metz
SO2 réagit avec H2S pour donner du soufre : SO2 + H2S 3 S + H2 O 1 2 Propriétés physiques et variétés allotropiques Page 1 sur 8 L'Acide sulfurique |
|
CORRIGÉ du Devoir Surveillé n°1 - Chimie en PCSI
1 oct 2015 · À cette température, la constante d'équilibre K° de la réaction de combustion vaut : ° = 4 10+52 On donne la masse molaire du soufre : M |
|
Cours n°7 : La combustion du fer et du carbone - Educonline
La laine de fer s'est transformée pendant qu'elle brûlait La matière présente après combustion n'est plus du fer Changement de couleur et de texture |
|
OBTENTION DE SOUFRE ELEMENTAIRE ET - InfoTerre - BRGM
l'or, et la production d'oxyde de fer - une unité Le fer se trouve volatilisé sous forme de chlorure ferrique et le soufre étape de post combustion des fumées ; |
|
G,&3 -tB;
Que peut-on dire de l'arrangement des atomes avant et après la combustion ? so ol ôe rcuke lii Complète les équations de combustion dLl fer et du soufre : |
Première partie : combustion du fer Consigne 1 5 minutes
Présentation des affiches et animation tableau pour la mise au point _____ Magistral en situation : la combustion du fer ; équation de réaction chimique (conservation des atomes) ; généralisation et autres exemples Réinvestissements : combustions du carbone, du méthane, du utane Voir combustions partie 2
Cours n 7 : La combustion du fer et du carbone
I 1) Expérience 11 G Etape 3 La laine de fer n'est plus chauffée par le courant du courtcircuit Et pourtant, elle brûle encore
Les combustions - ChimieCollège du Centre
2) Exemples : Combustion du fer, de l’aluminium ou du magnésium Quelques exemples surtout pour identifier réatifs et produits et pour s’entraîner à érire un ilan de transformation chimique
ème - sciencesphysiquesdebussyfileswordpresscom
Exercice n°1 : la combustion du fer Le fer brûle pour donner un oxyde de fer (Fe 3 O 4) qui est de couleur noir L’équation de la réaction chimique est la suivante : Fer + Dioxygène → Oxyde de fer 3 Fe + 2 O 2 → Fe 3 O 4 1) Vérifier si le principe de conservation de la matière est vérifié, en complétant le tableau suivant
L 2 LA COMBUSTION du CARBONE et du FER
Leçon n° 2 COMBUSTION DU CARBONE ET DU FER 4ème LIVRE page 19 à 26 I) La combustion du carbone Nous avons fait brûler du charbon de bois (constitué essentiellement de carbone) dans l'air puis dans du dioxygène pur
Activité 1-Rappel : Transformation chimique
Exercice n°1 : la combustion du fer Le fer brûle pour donner un oxyde de fer (Fe 3O 4) qui est de couleur noir L’équation de la réaction chimique est la suivante : Fer + Dioxygène → Oxyde de fer 3 Fe + 2 O 2 → Fe3O4 1) Vérifier si le principe de conservation de la matière est vérifié, en complétant le tableau suivant
Contrôle n°5 - collège, lycée, licence, capes et agrégation
Exercice n°3 : Combustion du fer 1 5 pts 1) On sait que si on veut brûler entièrement 10g de fer, on doit utiliser 5 L de dioxygène Question : On réalise la combustion de 7 g de fer dans 3 L de dioxygène
TGM Chapitre 13 LOXYDORÉDUCTION
La combustion du mélange est amorcée à l'aide d'un ruban de magnésium qu'on allume Mg O fumée blanche 2 Combustion de Mg réduction du fer 2 Al + Fe2O3 Al2O3 + 2 Fe oxydation de l'aluminium moule rempli du mélange de poudres rail rail ruban de magnésium
Chapitre 5 Niveau : Classe 2AC les réaction chimiques
elle, est symbolisée par une flèche Les réactifs de la réaction sont situés à gauche de cette flèche et les produits, à droite C + O 2 CO 2 II Réaction entre le fer et le soufre 1 Expérience On brûle le mélange de limaille de fer et du soufre avec la flamme du bec Bunsen Feu d'artifice : quelle réaction chimique est mise en jeu ?
|
Chapitre II
[PDF] Chapitre II college podensac IMG pdf Chapitre combustion pdf |
|
a) Combustion du carbone
[PDF] a) Combustion du carbone esffm Cours S Chapitre Oxydoreduction pdf |
|
2 Réactions chimiques
[PDF] Réactions chimiquesphysik diekirch e cours e v chimie physique Chap pdf |
|
Le fer
[PDF] Le ferressources univ lemans AccesLibre UM Chimie descriptive fer pdf |
|
Combustion
[PDF] Combustion fsr ac ma cours physique bargach Chap pdf |
|
Notion Sur l oxyde réduction - bankdusavoir
[PDF] Notion Sur l 'oxyde réduction bankdusavoirbankdusavoir pdf pdf partie pdf |
|
ON PEUT FAIRE DES « ETINCELLES » EN CHIMIE #8230;
[PDF] ON PEUT FAIRE DES « ETINCELLES » EN CHIMIE enseignement be download php?do id= |
|
Les atomes
[PDF] Les atomesac grenoble college file Chapitre Les atomes pdf |
|
Découverte de la réaction chimique (PDF) - Inforef
[PDF] Découverte de la réaction chimique (PDF) Inforef inforef be exterieurs divna dec pdf |
|
EQUATION - BILAN D UNE REACTION CHIMIQUE
° Réaction entre le zinc et le soufre ° Combustion du fer dans le dioxygène ° Le zinc métal réagit avec le soufre divisé en formant du sulfure de zinc |
- combustion du fer dans le dioxygène
- oxyde magnétique de fer formule
- combustion du fer 4ème
- equation de combustion du soufre
- la combustion de la paille de fer est elle une transformation chimique
- combustion de l'aluminium
- oxydation du fer dans l'air
- combustion du fer formule

Chapitre 5 : Oxygène et combustions - PDF Free Download
Source:http://slideplayer.fr/4067737/12/images/18/S%20O2%20SO2%20S%20S%20Anhydride%20sulfureux%20Soufre%20Oxyg%C3%A8ne%20O%20O%2032%20g%2032%20g%2064%20g.jpg
la combustion du soufre
Source:http://www2.ggl.ulaval.ca/personnel/bourque/s3/3.40k.jpg
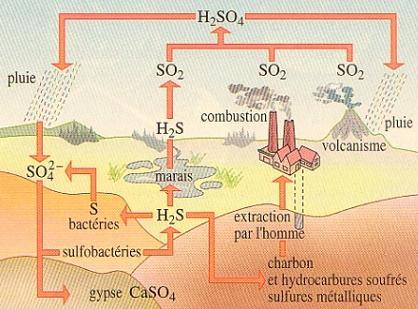
Cycle du soufre
Source:http://pravarini.free.fr/Images/CycleSoufre.jpg

Gaz-H2S
Source:http://maths-sciences.ac-rouen.fr/ressources/sciences/odyssee21/combusoufre2.gif

Les équations bilan
Source:http://mdevmd.accesmad.org/mediatek/pluginfile.php/2752/mod_page/content/4/image3.jpeg

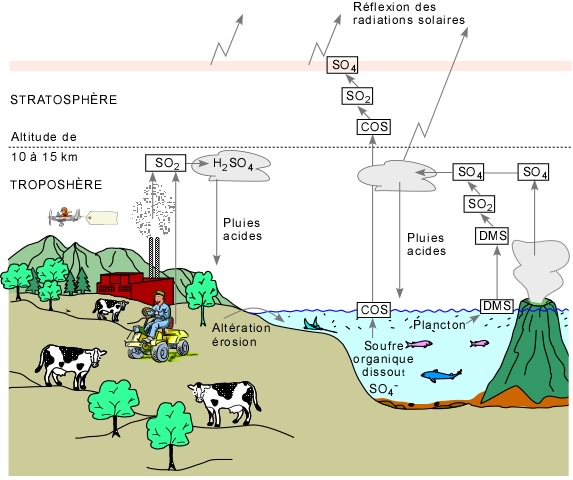
CGM: La combustion du soufre et les pluies acides
Source:https://omer7a.obs-mip.fr/var/plain_site/storage/images/service-educatif/media/images/m4res_cycles-1/72759-1-fre-FR/M4Res_CycleS-1_fancybox.jpg
oxyde magnétique de fer formule
Chapitre II
- oxydation du fer dans l'air
- combustion de l'aluminium
- combustion du fer équation
- combustion du fer wikipedia
- combustion du fer et du soufre
- oxyde de fer fe2o3
- equation de combustion du soufre
- formule chimique de l'alumine
combustion du fer dans le dioxygène tableau d avancement
Chapitre II
- combustion du fer 4ème
- combustion du fer formule
- la combustion de la paille de fer est elle une transformation chimique
- combustion de l'aluminium
- oxydation du fer dans l'air
- equation de combustion du soufre
- oxyde magnétique de fer formule
- combustion du fer et du soufre
combustion du fer wikipedia
Combustion
- cours de combustion pdf
- cours de combustion 1ere partie
- la combustion pdf
- calcul exces d'air combustion
- combustion stoechiométrique
- combustion stoechiométrique gaz naturel
- equation combustion hydrocarbure
- réaction de combustion complète
oxyde de fer fe2o3
Le fer
- les oxydes de fer
- corrosion du fer en milieu acide
- synthèse des nanoparticules d'oxyde de fer
- cours sur les oxydes
- les oxydes de fer pdf
- diagramme d'ellingham du fer et de ses oxydes
- diagramme d ellingham du fer corrigé
- magnetite propriété