Comment s'effectue la combustion du fer dans le dioxygène ?
L'oxyde ferrique est un produit de la réaction chimique entre le fer et le dioxygène.
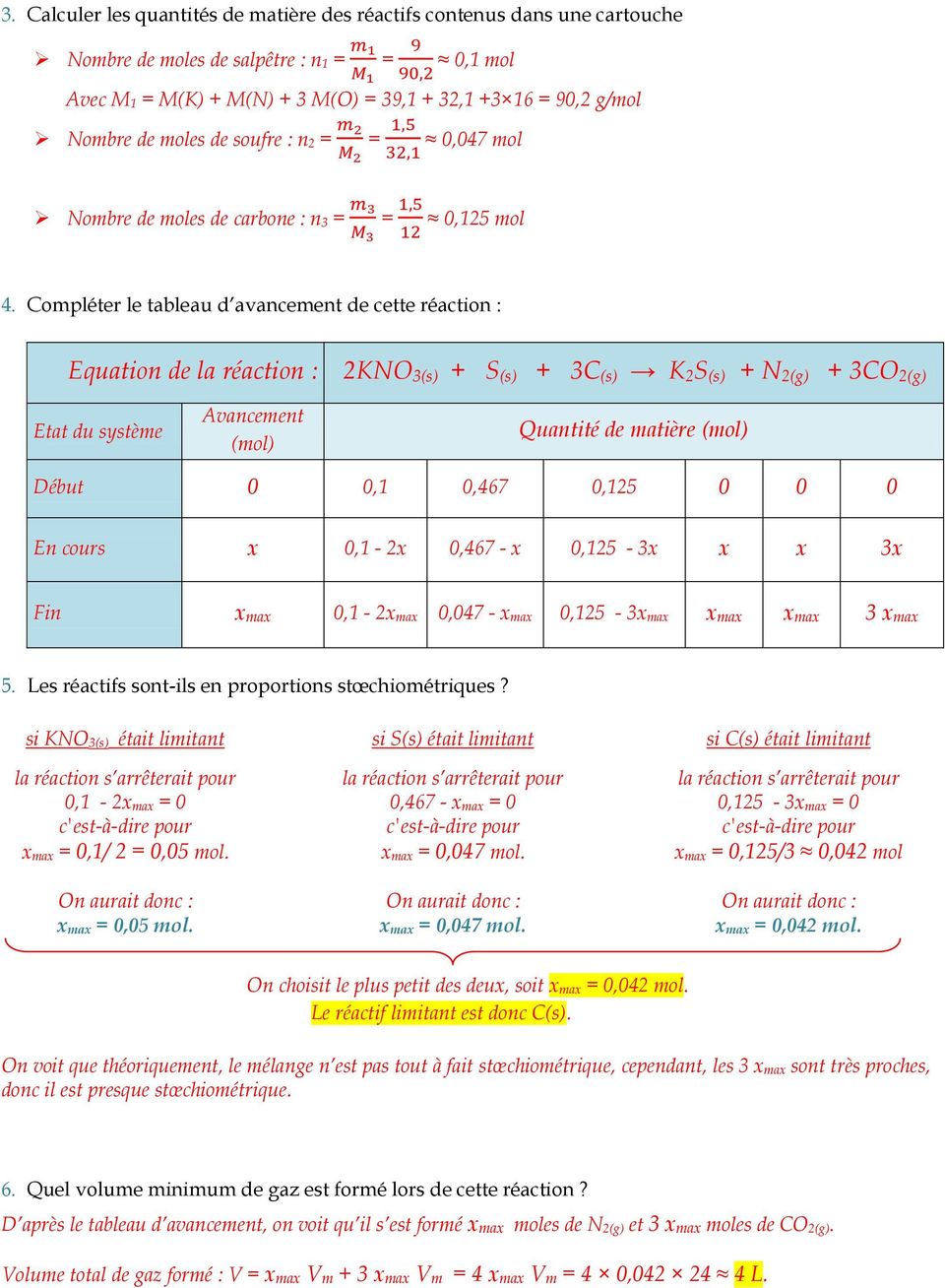
L'équation-bilan de la réaction s'écrit : 4 Fe + 3 O 2 → 2 Fe 2O 3.
La formation de la rouille dégage de la chaleur, mais la lenteur de la réaction ne permet pas de la détecter : la chaleur disparaît peu à peu dans l'air.Quelle est l'équation de l'oxydation du fer ?
Sur la surface du métal, du fer (état d'oxydation : 0) est oxydé pour passer à l'état d'oxydation II : Fe + 2OH− → Fe(OH)2 + 2e−, pendant que le dioxygène de l'air (degré d'oxydation 0) est réduit en ion hydroxyde : 2H2O + O2 + 4e− → 4OH−.
Pourquoi la masse augmente lors de la combustion du fer ?
Les réactifs de cette réaction chimique, sont le fer et le dioxygène, le produit est un oxyde de fer.
L'augmentation de masse est de 0.9 g.
Elle est due à l'union d'atome d'oxygène provenant du dioxygène de l'air avec les atomes de fer.- Interprétation : la combustion du fusain nécessite la présence de réactifs (carbone et dioxygène), le carbone est le combustible, le dioxygène est le comburant.
Ils sont consommés au cours de la combustion.
Un nouveau produit apparaît : le dioxyde de carbone.
|
Le tableau davancement en Première S.
29 sept. 2008 = 1 ?. 1. 5. × 2=06mol. Exercice : on réalise la combustion de 3mol de propane dans 5mol de dioxygène. Faire un bilan de matière à l'état ... |
|
1) Transformation chimique : 2) Etat initial et état final : 3) Modélisation
Dans un tableau d'avancement donné on doit écrire l'équation de la réaction La combustion du fer Fe solide dans le dioxygène O2 gazeux produit l'oxyde ... |
|
CORRIGÉ du Devoir Surveillé n°1
1 oct. 2015 11 Pts Exercice : combustion de S et formation de ... 2) Proposer un tableau d'avancement explicite l'avancement étant noté ?. Que. |
|
Reaction chimique - Thermodynamique - Cinétique
Le calcul du rendement ou taux d'avancement ? est le réactif limitant : On peut donc obtenir au plus 1035g de Fer. ... combustion dans l'air. |
|
Comment résoudre un exercice en utilisant un tableau d
Méthode : pour résoudre un exercice comportant un tableau d'avancement il faut On réalise la combustion du magnésium par du dioxygène dans un flacon de ... |
|
Exercices de révisions : Physique-chimie
Exercice n°3 : Quantité de matière et tableau d'avancement. Il s'agit de la réaction de combustion du 11-diméthylhydrazine avec pour comburant |
|
Rédiger un exercice
Comprendre et construire un tableau d'avancement Vous disposez de 5 mol de dihydrogène gazeux de formule H2 et de 2 mol de dioxygène. |
|
EXERCICES DAUTOMATISATION EXERCICES
Ce solide peut être obtenu en faisant réagir à chaud du métal fer avec du dioxygène. L'équation de la réaction est donnée dans le tableau d'avancement |
|
Série dexercices sur le tableau davancement
Faire le bilan de matière à la fin de la réaction . 5. 6) Calculer la masse du dioxygène formée et celle d'oxyde de fer formée. 7) Est –on dans |
|
Tableau davancement
La quantité de dioxygène nécessaire à la combustion est telle qu'à l'état final il n'en reste plus. (proportions stœchiométriques). On en déduit : 2. O n - |
|
I-Transformation chimique réaction chimique : 1 - AlloSchool
La combustion du fer Fe solide dans le dioxygène O 2 gazeux produit l’oxyde de fe magnéti ue Fe 3 O 4 1) Eci e puis é uilib e l’éuation de la éaction 2) T ace le tableau d’avancement de la éaction pou un mélange initial constitué de 3mol de fe et 4mol de O 2 ----- |
|
Série d'exercices sur le tableau d'avancement - AlloSchool
il se forme du dioxyde de fer de formule Fe 3 O 4 On fait réagir 2232g de fer et 128g de O 2 On donne : M (Fe)=558g/mol M (O) =16g/mol 1) Ecrire l'équation de la réaction 2) Déterminer les quantités de matière initiales des réactifs 3) Faire le tableau d'avancement de la réaction 4) Déterminer x max et le réactif limitant |
|
Exercices sur l'avancement de la réaction
Exercices sur l'avancement de la réaction 1 Exercice Soit la combustion complète du propane C3H8 dans le dioxygène donnant du dioxyde de carbone et de l'eau 1 Écrire l'équation de cette réaction en utilisant les nombres stoechiométriques entiers les plus petits possibles 2 Préparer des tableaux d'évolution pour les 2 systèmes ci dessous |
|
Chapitre 6 Avancement d’une réaction chimique Exercices
Exercice n°1 : Tableau d’avancement / Combustion de l’aluminium Lors de la combustion de l’aluminium dans le dioxygène il se forme de l’oxyde d’aluminium ou alumine de formule A?2O3(s) 1 Écrire l’équation de la réaction Dans l ‘état initial le système contient 024 mol d’aluminium et 024 mol de dioxygène 2 |
Qu'est-ce que la combustion du fer dans le dioxygène ?
La combustion du fer dans le dioxygène est une réaction chimique au cours de laquelle du fer et du dioxygène réagissent ensemble et disparaissent pour produire un corps nouveau : l’oxyde de fer. Quel est le produit de la combustion du fer?
Quels sont les effets du dioxygène sur la combustion?
Si la quantité de dioxygène est insuffisante, la combustion devient incomplète et produit du monoxyde de carbone. ?Le monoxyde de carbone est un gaz incolore et inodore. Il se fixe sur les globules rouges et empêche le dioxygène que nous avons inspiré d’être délivré à nos cellules.
Comment savoir si la combustion du Fusain a du dioxyde de carbone ?
Analyse du contenu du récipient où s’est réalisée la combustion, test à l’eau de chaux. L’eau de chaux se trouble, le test est donc positif et indique la présence de dioxyde de carbone. La combustion est plus vive dans le dioxygène pur (100 % de dioxygène) que dans l’ air (21 % de dioxygène): Le dioxygène est nécessaire à la combustion du fusain
Comment savoir si la combustion est plus vive dans le dioxygène pur que dans l’air ?
La combustion est plus vive dans le dioxygène pur que dans l’air. Au bout de quelques instants la combustion devient de moins en moins vive puis s’arrête. Une partie du fusain a disparu pendant la combustion. Etape 5: Analyse du contenu du récipient où s’est réalisée la combustion, test à l’eau de chaux.
Comment écrire le bilan de la combustion ?
. Le corps formé est l'oxyde magnétique de fer (Fe 3O 4).
. L'équation-bilan de la combustion du fer s'écrit : 3 Fe + 2 O 2 ? Fe 3O 4.
. Cette réaction chimique est exothermique.
Qu'est-ce que la combustion du fer ?
. La première réaction se produit quand la quantité de dioxygène disponible (ou le flux entrant) est faible, la seconde quand elle est élevée.
. Dans des situations intermédiaires les deux réactions peuvent se produire concurremment.
|
Le tableau davancement en Première S - Aix - Marseille
29 sept 2008 · Déterminer l'état final sans faire de tableau d'avancement Exemple 2 : soit la réaction du dioxygéne avec le dihydrogène qui produit de l'eau Le tout Exemple-exercice 1 : on s'intéresse à la réaction des ions fer III Fe3+ Exemple 1 : en reprenant la combustion du propane du paragraphe précédent, |
|
Exercices de révisions : Physique-chimie
Exercice n°2 : Quantité de matière et tableau d'avancement Le diiode Il s'agit de la réaction de combustion du 1,1-diméthylhydrazine avec pour comburant, le b) Calculer la quantité de dioxygène formé au cours de cette transformation |
|
CORRIGÉ du Devoir Surveillé n°1 - Chimie en PCSI
1 oct 2015 · 11 Pts Exercice : combustion de S et formation de SO2 1) Calculer les quantités de matière initiales de soufre, de dioxygène et de diazote 2) Proposer un tableau d'avancement explicite, l'avancement étant noté ξ Que |
|
Tableau davancement
On peut commencer à dresser le tableau d'avancement : Cu2+ La quantité de dioxygène nécessaire à la combustion est telle qu'à l'état final il n'en reste plus |
|
TABLEAUX DAVANCEMENT ET BILAN DE MATIERE
Si on travaille avec le volume minimal de dioxygène, il ne restera plus de fer ni de dioxygène à l'état final On se sera donc placé dans les proportions |
|
1ère STI2D - 1ère STL - Académie de Strasbourg
Savoir écrire l'équation d'une réaction de combustion Activités de découverte du tableau d'avancement expérimentées lors d'une séance de en demi- classe On notera N la quantité de matière dioxygène initialement présente 1 Montrer |
|
Accompagnement personnalisé n 1 - Enseignement des Sciences
LA QUANTITE DE MATIERE ET LES TABLEAUX D'AVANCEMENT Le combustible est l'espèce chimique qui brûle : le gaz propane C3H8 (cf titre de l' exercice) Fer : n = m / M = 25,0 / 55,8 = 0,448 mol Unité / CS / Arrondi Dioxygène : p |
|
équation de réaction, tableau davancement et le bilan - AlloSchool
7) Dans le tableau d'avancement, on indique pour les réactifs et les produits: On considère la réaction entre le fer Fe(s) et le dioxygène O2(g), il se forme du On réalise la combustion complète, dans un bécher, de 4 mmol de méthane CH4 |
|
Ré visions sur lé bilan duné transformation chimiqué Exércicés sur
H2O (combustion complète) brûler de manière incomplète 26 g de glucose ( sucre) dans le dioxygène de l'air 1 Dresser le tableau d'avancement de cette réaction Si on fait brûler du fer métallique, il se forme un solide noir appelé oxyde |
|
الجزء الاول: الشغل الميكانيكي و الطاقة - Physique Chimie - dataelouardi
Série N°6-Suivi d'une transformation chimique-Tableau d'avancement Exercice 2 3- Déterminer la quantité d'aluminium à faire réagir pour obtenir 1 kg de fer Les produits de la réaction sont ceux de la combustion dans le dioxygène des |
Première partie : combustion du fer Consigne 1 5 minutes
Première partie : combustion du fer Consigne 1 individuel (5 minutes) Hypothèse On fait brûler de la laine de fer dans l’air ; après la combustion la masse va être :
Cours n 7 : La combustion du fer et du carbone
I 1) Expérience 11 G Etape 3 La laine de fer n'est plus chauffée par le courant du courtcircuit Et pourtant, elle brûle encore
ème - sciencesphysiquesdebussyfileswordpresscom
Exercice n°1 : la combustion du fer Le fer brûle pour donner un oxyde de fer (Fe 3 O 4) qui est de couleur noir L’équation de la réaction chimique est la suivante : Fer + Dioxygène → Oxyde de fer 3 Fe + 2 O 2 → Fe 3 O 4 1) Vérifier si le principe de conservation de la matière est vérifié, en complétant le tableau suivant
L 2 LA COMBUSTION du CARBONE et du FER
Leçon n° 2 COMBUSTION DU CARBONE ET DU FER 4ème LIVRE page 19 à 26 I) La combustion du carbone Nous avons fait brûler du charbon de bois (constitué essentiellement de carbone) dans l'air puis dans du dioxygène pur
Chapitre 4 : Les combustions - Physique - ChimieCollège du
Dans une combustion, les réactifs sont le combustible et le comburant Bilan de la combustion du carbone: arone + dioxygène → dioxyde de arone Produit 2) Exemples : Combustion du fer, de l’aluminium ou du magnésium Quelques exemples surtout pour identifier réatifs et produits et pour s’entraîner à érire un ilan de transformation
Contrôle n°5 - Physagreg
Exercice n°3 : Combustion du fer 1 5 pts 1) On sait que si on veut brûler entièrement 10g de fer, on doit utiliser 5 L de dioxygène Question : On réalise la combustion de 7 g de fer dans 3 L de dioxygène
Activité 1-Rappel : Transformation chimique
Nous allons dans la suite travailler sur 3 réactions chimiques : - La combustion du fer ; - L’autoprotolyse de l’eau ; - La combustion du méthane Réactifs Produits Doc 1 : Rappel Doc 2 : Principe de conservation de la matière
Leçon 5 La réaction chimique - AlloSchool
combustion de carbone et du méthane dans l'air et la combustion du fer dans le dioxygène - les apprenants comparent l'état initial et l'état final - d'identifier le combustible et le comburant - d'identifier les produits formés - de dresser un bilan de la transformation Dans un second temps, les apprenants analyseront un
Chapitre 3 Oxydation des matériaux dans l’air
la paroi du tube, l’eau de chaux se trouble, en plus il y a dégagement du CO ; 4 Déduction: Les atomes qui constituent les molécules du papier sont les atomes d’hydrogène et des atomes du carbone II La combustion du plastique dans le dioxygène de l’air Les produits de la combustion incomplète du plastique sont : CO 2 et CO et H 2
| Chapitre II |
|
la combustion - Free
[PDF] la combustion Freemariepierrot free lycee ddoc presentation combustion pdf |
|
Le tableau d avancement en Première S - Aix - Marseille
[PDF] Le tableau d 'avancement en Première S Aix Marseille spc ac aix marseille avancement livre tabav ereS pdf pdf |
|
tableau d avancement - Lycée Jean Vilar
[PDF] tableau d 'avancement Lycée Jean Vilar jeanvilar depot physique tableauavancement pdf |
|
La réaction chimique - TaalimPro
[PDF] La réaction chimique TaalimPro taalimpro Cours%%Réaction%Chimique pdf |
|
Chapitre 7 #967; : Les tableaux d avancement
[PDF] Chapitre Les tableaux d 'avancementperso inforoutes golestin physique cours chimie chapitre pdf |
|
Accompagnement personnalisé n 1 - Enseignement des Sciences
[PDF] Accompagnement personnalisé n Enseignement des Sciences sciences physiques cpge e monsite ap ts tableau d avancement correction pdf |
|
Devoir n° 3
[PDF] Devoir n° grossheny free pcschwi pcjbs prem devoir DS pdf |
|
fiche élève : tableau d avancement chimique
[PDF] fiche élève tableau d 'avancement chimiquejawher e monsite fiche eleve tableau d avancement chimique pdf |
|
érie d exercices N°18 - Achamel
) Ecrire l 'équation chimique de la combustion complète de ce gaz ) Réaliser le tableau d 'avancement et déterminer le volume de gaz mol de dioxygène O(g) il se forme de l 'oxyde de fer FeO(s) et du dioxyde de soufre SO(g) |
- combustion du fer 4ème
- combustion du fer formule
- la combustion de la paille de fer est elle une transformation chimique
- combustion de l'aluminium
- oxydation du fer dans l'air
- equation de combustion du soufre
- oxyde magnétique de fer formule
- combustion du fer et du soufre

Tableau d'avancement - forum physique chimie - 308227
Source:https://www.ilephysique.net/img/forum_img/0265/forum_265257_2.jpg
Réaction de combustion tableau d'avancement - forum physique
Source:https://docplayer.fr/docs-images/40/10472590/images/page_4.jpg

Tableaux d avancement évaluation - PDF Free Download
Source:https://media.kartable.fr/uploads/finalImages/final_5d5d68be928051.57644777.png

Le suivi d'une transformation chimique - 1ère - Cours Physique
Source:https://guy-chaumeton.pagesperso-orange.fr/scphysiques2010/1sqcm/images16/img1C.gif

QCM N° 16 Stockage et conversion de l'énergie combustion et
Source:https://kronos-images.schoolmouv.fr/1-spc-c14-img03.png

Modélisation de l'évolution d'une réaction chimique : Fiche de
Source:http://www.frammery.com/Patator/Images/Tableau%20d'avancement%202.jpg
combustion du fer wikipedia
Combustion
- cours de combustion pdf
- cours de combustion 1ere partie
- la combustion pdf
- calcul exces d'air combustion
- combustion stoechiométrique
- combustion stoechiométrique gaz naturel
- equation combustion hydrocarbure
- réaction de combustion complète
oxyde de fer fe2o3
Le fer
- les oxydes de fer
- corrosion du fer en milieu acide
- synthèse des nanoparticules d'oxyde de fer
- cours sur les oxydes
- les oxydes de fer pdf
- diagramme d'ellingham du fer et de ses oxydes
- diagramme d ellingham du fer corrigé
- magnetite propriété
formule chimique de l'alumine
Une étape de l 'élaboration de l 'aluminium - Physique Chimie ? Saint
- etapes élaboration de l'aluminium
- de la bauxite ? l'aluminium corrigé
- extraction de l'alumine de la bauxite correction tp
- fabrication de l'aluminium schéma
- séparation des éléments aluminium et fer présents dans la bauxite
- production de l'aluminium par électrolyse
- tp bauxite spé
- alumine structure
combustion du zinc
Chapitre II
- combustion du fer dans le dioxygène
- combustion de l'aluminium
- combustion du fer 4ème
- combustion du fer et du soufre
- la combustion de la paille de fer est elle une transformation chimique
- combustion du fer formule
- equation de combustion du soufre
- combustion du fer dans le dioxygène tableau d avancement