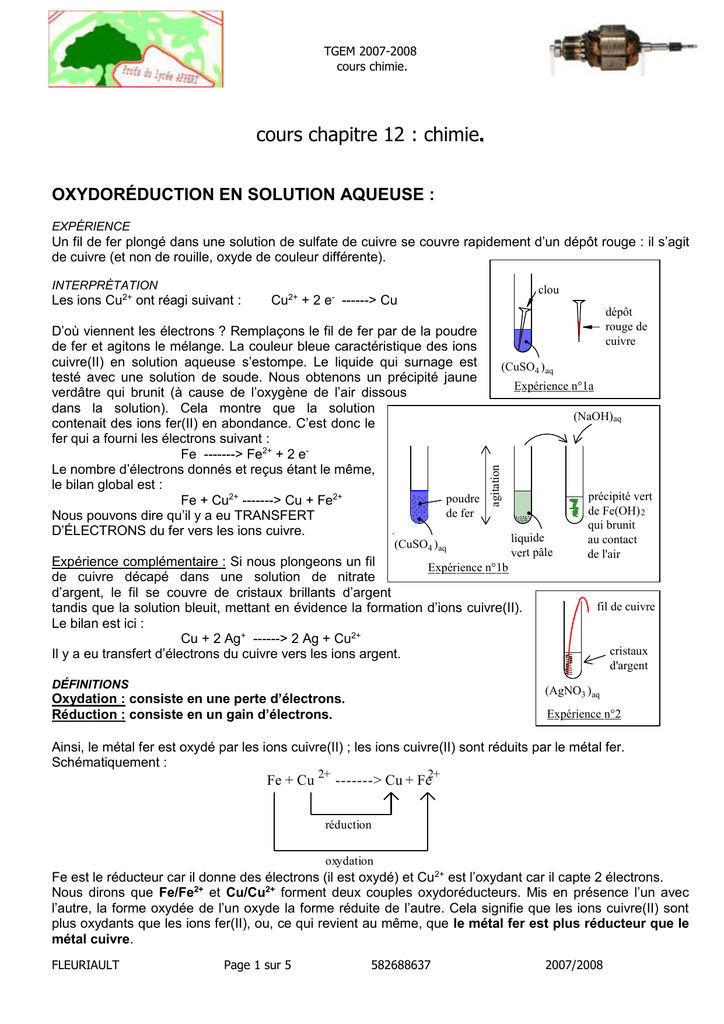
C'est quoi un oxydant et un réducteur ?
Un oxydant est une espèce chimique capable de capter des électrons alors qu'un réducteur est une espèce chimique capable de les céder.
Pour les couples complexes, il est nécessaire d'écrire la demi-équation électronique associée pour déterminer la nature des deux espèces.C'est quoi la réduction en chimie ?
Une réduction
est une réaction au cours de laquelle un réactif capture (prend) un ou des électron(s).
Dans cette réaction, le cuivre métallique est la forme réduite et l'ion Cu2+ est la forme oxydée du couple rédox Cu2+/Cu.Quels sont les réducteurs ?
Les types de réducteurs les plus couramment utilisés dans le secteur industriel sont les réducteurs roue et vis.
Néanmoins, ces dispositifs sont suivis de près par les réducteurs à engrenages cylindriques.
Par ailleurs, les réducteurs à renvois d'angles, à couple conique et pendulaires sont également très populaires.- Les couples redox
Un oxydant et un réducteur forment un couple redox si on peut passer de l'un à l'autre par gain ou perte d'électrons.
Par convention, un tel couple est noté Ox / Red.
L'ion Cu2+ et l'atome de cuivre Cu forment un couple redox noté : Cu2+ / Cu.
|
Chapitre CO-PC1. Seconde période Plan du cours Oxydoréduction
24 mai 2016 En chimie organique l'élément central est le carbone. La con |
|
Les réactions doxydo-réduction
on peut toujours associer un réducteur avec un oxydant : ces 2 espèces forment un « couple oxydant/réducteur ». exemples : couple du cuivre : Cu2+ / Cu. |
|
Chimie organique
REDUCTION PAR NABH4 REDUCTEUR CHIMIOSELECTIF DES ALDEHYDES ET CETONES. 19. 2.1. BILAN GENERAL. 19. 2.2. SCHEMA REACTIONNEL. |
|
On obtient un couple oxydant / réducteur: H+ / H2
Une réduction est un gain d'électrons : un oxydant est réduit subit une réduction. Des couples à connaitre : Page 2. ChiMie. L'oxydo-réduction |
|
POTENTIEL STANDARD DUN COUPLE OXYDANT / RÉDUCTEUR
Notions et contenus Couple oxydant / réducteur (redox). Réaction d'oxydo-réduction. Pile anode |
|
Oxydant Réducteur E0 (Volt)
Table des potentiels standard Ox+ne-?Red à 25°C et à p=101kPa. Oxydant. Réducteur E0 (Volt). 2NO2. -+6 H++4 e-. N2O(g) +3 H2O. |
|
Chapitre 3 :Oxydoréduction
On appelle réducteur/réduit un élément de faible électronégativité. L'oxydant est un accepteur d'électrons le réducteur un donneur d'électrons. |
|
Chimie - Chapitre 9 : Réactions doxydoréduction Ce quil faut retenir…
amphotère : Une espèce pouvant agir en tant qu'oxydant ou en tant que réducteur est dite amphotère. Exemple : l'eau. Couple : H+/ H2 : 2 H+ + 2 e- = H2. H+ |
|
Première générale - Oxydo-réduction - Exercices - Devoirs
Définir un oxydant et un réducteur et le réducteur du couple Zn(aq) ... Première générale - Physique Chimie spécialité - Année scolaire 2022/2023. |
|
Oxydo-réduction - 1°) Couple oxydant- réducteur 1.1)Réaction entre
Chapitre IV Chimie : oxydo-réduction 1.2)Définition du couple oxydant-réducteur ... Le cuivre a donné des électrons il est donc réducteur. |
|
Fiche de synthèse n°3b Oxydants et réducteurs
Un réducteur est une espèce chimique (atomes ions molécules) capable de perdre un ou plusieurs électrons C'est une espèce qui contient un élément dont le |
|
Chapitre 3 :Oxydoréduction - Melusine
On appelle oxydant/oxydé un élément de forte électronégativité On appelle réducteur/réduit un élément de faible électronégativité L'oxydant est un accepteur d |
|
Les réactions doxydo-réduction - Physique - Chimie
? Le réducteur d'un couple (noté 1) peut participer à une réaction chimique avec l'oxydant d'un autre couple (noté 2) ? Au cours de cette réaction le |
|
1 Généralités sur loxydo-réduction
Préparation Olympiades Internationales de Chimie 2019 Chimie des solutions (partie 2) : Réactions d'oxydo-réduction Table des matières Introduction |
|
Plan du cours Oxydoréduction en chimie organique
24 mai 2016 · Une réduction en chimie organique se traduit par une diminution du nombre d'oxydation moyen des atomes de carbone mardi 24 mai 16 Page 9 En |
|
Chimie analytique 2éme année pharmacie -Les réactions d
Un réducteur est une espèce chimique (molécule ou ion) capable de céder un ou plusieurs électrons lors d'une réaction chimique Définition d'une oxydation : |
|
POTENTIEL STANDARD DUN COUPLE OXYDANT / RÉDUCTEUR
Réaction d'oxydo-réduction Pile anode cathode Chimie et développement durable / composition des systèmes chimiques Notions et contenus Oxydo-réduction / |
|
Chapitre 3 : Oxydation et Réduction – Exercices
Classe: 3ème - Matière: Chimie - Date: Mars 2020 Chapitre 3 : Oxydation et Réduction – Exercices Exercice 1 : En suivant l'exemple calculer le nombre |
|
Loxydo-réduction
L'oxydo-réduction I - Les réactions redox Définitions Une réaction chimique qui modifie le degré d'oxydation d'un des éléments est une réaction redox |
|
Cours-chimie-en-solutionpdf
Cours de chimie en solution : Partie II REACTIONS OXYDOREDUCTION Au cours de la réaction : l'oxydant est réduit et le réducteur est oxydé |
C'est quoi la réduction en chimie ?
Une réduction
est une réaction au cours de laquelle un réactif capture (prend) un ou des électron(s). Dans cette réaction, le cuivre métallique est la forme réduite et l'ion Cu2+ est la forme oxydée du couple rédox Cu2+/Cu.C'est quoi le pouvoir réducteur ?
Le pouvoir réducteur d'un métal définit sa tendance à vouloir donner ses électrons et à s'oxyder. Une réaction oxydoréduction spontanée survient lorsque celle-ci s'effectue naturellement, sans l'apport d'une forme d'énergie extérieure. La tendance à donner des électrons varie d'un métal à l'autre.Comment identifier un réducteur ?
Si l'esp? chimique a capté des électrons, c'est un oxydant. Si l'esp? chimique a cédé des électrons, c'est un réducteur.- un réducteur est un corps chimique capable de céder un ou plusieurs électrons. Une forte concentration d'adoucissant peut aussi diminuer la force du réducteur. De l'acide thioglycolique en grande concentration (11% maxi) est plus actif pour la réduction mais aussi plus allergisant.
C'est quoi un oxydant et un réducteur ?
. C'est une esp? qui contient un élément dont le nombre d'oxydation peut diminuer.
. Un réducteur est une esp? chimique (atomes, ions, molécules) capable de perdre un ou plusieurs électrons.
C'est quoi le pouvoir réducteur ?
. Une réaction oxydoréduction spontanée survient lorsque celle-ci s'effectue naturellement, sans l'apport d'une forme d'énergie extérieure.
. La tendance à donner des électrons varie d'un métal à l'autre.
Comment savoir qui est l'oxydant et le réducteur ?
. C'est gr? à ces phénomènes de réduction ménagée, c'est-à-dire une réduction lente et continue de l'oxygène, que le vin évolue et se conserve aussi bien en bouteilles, à l'abri d'une oxydation forte qui ferait vieillir trop vite le vin.
|
DOCTEUR 3m CYCLE EN CHIMIE Spécialité: Chimie Nucléaire par
Comme il a été dit en introduction, la chimie des atomes chauds concerne les processus primaires, par lesquels un atome ou un ion énergétique se stabilise dans |
|
Que faire avec un doctorat en chimie ? - Association Bernard Gregory
25 mar 2010 · regards d'un docteur en chimie pour trouver un emploi se portent sur la R&D des grands groupes s'il envisage une carrière dans l'industrie |
|
Épreuve de Physique - Chimie MP - e3a-Polytech
−→B à l'intérieur du conducteur parfait est forcément un champ stationnaire On se propose de modéliser le supraconducteur par une boucle de courant |
|
THÈSE DOCTEUR EN CHIMIE - Univ-Tlemcen
THÈSE Pour obtenir le grade de DOCTEUR EN CHIMIE Spécialité : Chimie et Physico-chimie Organique Macromoléculaire Par Mme Soraya BELKAID ép |
|
Guillaume RENAUDIN Docteur en Physique et Chimie de la Matière
1994-1998 Doctorant au Laboratoire de Chimie du Solide Minéral (UMR 7555) de l'Université Henri Poincaré de Nancy I, sous la direction du Professeur O |
|
PHYSIQUE-CHIMIE - concours Centrale-Supélec
Commenter ce résultat expérimental en termes de contrôle cinétique ou thermodynamique Partie II - Matériau magnétique conducteur à basse fréquence On |
|
PROGRAMMES DE CHIMIE DES CPGE MAROC - elbilia sup
3 Programme de chimie de la voie PCSI-PSI Approche théorique 23 ducteur d 'un couple et l'oxydant d'un autre couple couple redox On introduit les |
|
Le Soleil : un sacré producteur délectricité (PDF - Mediachimie
en couches minces à partir de procédés chimiques Les cellules photovoltaïques à colorants Ces cellules concrétisent bien l'apport de la chimie dans le domaine |
Faculté de Médecine Pierre-et-Marie-Curie
Réducteur : espèce susceptible de perdre des électrons Une réaction d’oxydo-réduction ou "redox" est le siège d’une transformation avec échange d’électrons : A chaque oxydant correspond un réducteur, et inversement Ils forment ensemble un couple oxydo - réducteur ou couple redox noté oxydant/réducteur Exemple : I2 / I
Chapitre Piles Chimie 2 - WordPresscom
Couples oxydant/réducteur, réactions d’oxydo-réduction 1 Couples oxydant/réducteur oxydant/réducteur est constitué espèces chimiques conju-: ox et un réducteur noté red r, l’oxydant est situé à e t est une capable gagner plusieurs élec-s Un réducteur est une espèce chimique capable de rdre un ou plusieurs élec-s
Oxydoréduction – corrigé des exercices Table des matières
Lycée Denis-de-Rougemont OS Chimie - Corrigé Redox - 8 - HNO 3 est l'oxydant Cu est le réducteur Sur les 4 HNO 3, 2 sont réduits Les 2 autres HNO 3 libèrent leur nitrate sans échange d'électron pour former le Cu(NO 3) 2 CuO est l'oxydant NH 3 est le réducteur HNO 3 est l'oxydant Sb est le réducteur
RECUEIL D’EXERCICES PREMIERE S1 S2 CHIMIE
PREMIERE PARTIE : CHIMIE ORGANIQUE Série 1 : Généralités sur la chimie organique Série 2 : Les alcanes Série 3 : Les chaînes carbonées insaturées : alcènes et alcynes Série 4 : Le benzène Série 5 : Les composés oxygénés DEUXIEME PARTIE : ELECTROCHIMIE Série 6 : Notion de couple oxydant – réducteur
Chimie 2 : Transformations lentes ou rapides
TS Cours – Chimie 2 : Transformations lentes ou rapides ? Page 8/8 Connaissances : Écrire l'équation de la réaction associée à une transformation d'oxydoréduction et identifier dans cette équation les deux couples mis en jeu Définir un oxydant et un réducteur Savoir-faire :
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
CHIMIE Série S Fiche Cours Plan de la fiche I - Définitions II - Méthodologie I - Définitions Un P Demi pile : ensemble des deux formes d’un couple oxydant réducteur; dans le
Réaction d’oxydoréduction
Le couple oxydant / réducteur s’écrit donc ici : MnO 4 – / Mn 2+ III S’agit-il d’une oxydation ou d’une réduction ? Quand on établit une demi-équation électronique, il faut veiller à l’écrire dans le bon sens en fonction de la transformation chimique que l’on considère (Il faut donc bien lire l’énoncé)
1 Suivi de l’évolution d’un système chimique
L’espèce pouvant fournir des électrons lors de l’échange est appelée réducteur L’espèce pouvant gagner des électrons lors de l’échange est appelée oxydant II 1 b Bilan d’une réaction d’oxydoréduction Pour écrire l’équation-bilan d’une réaction d’oxydoréduction, il faut : • Identifier les réactifs
S Exercice : décomposition de leau oxygénée
Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons Un réducteur est une espèce chimiques capable de céder un ou plusieurs électrons 2-2) Équation de la réaction de H2O2 avec MnO4-: réduction de MnO4-: MnO 4-(aq) + 8H + (aq) + 5e-= Mn2+ (aq) + 4H2O(l) ×2 oxydation de H2O2 : H2O2(aq) = O2(g) + 2H + (aq
TP2 – Mettre en œuvre des transformations modélisées par des
a) Oxydant et réducteur Identifier dans l’expérience 2) les oxydants et les réducteurs Les représenter sous forme de couples oxydant-réducteur b) Equation chimique Ecrire les demi-équations électroniques associées aux couples déterminés précédemment Etablir l’équation de la réaction
|
Oxydant : définition Réducteur : définition - Univ-lille1
[PDF] Oxydant définition Réducteur définition Univ lillepasseport univ lille chimie chimie oxydoréduction Oxydo reduction pdf |
|
reduction en chimie organique - Eduscol
[PDF] reduction en chimie organique Eduscoleduscol education rnchimie chi viel red en chi pdf |
|
ACIDE / BASE OXYDANT / REDUCTEUR
[PDF] ACIDE BASE OXYDANT REDUCTEURclemspcreims free Chimie AB OxRed pdf |
|
Chimie-Exercices page 129-corrigé_oxydo-réduction
[PDF] Chimie Exercices page corrigé oxydo réduction lyc boisdamour ac poitiers Chimie Exercices page corriges oxydo reduction pdf |
|
Chapitre 19 Oxydo-Réduction en chimie organique Ce que je dois
[PDF] Chapitre Oxydo Réduction en chimie organique Ce que je dois lgtbellevue chapitre oxydoreduction en chimie organique |
|
Réactions d oxydo-réduction
[PDF] Réactions d 'oxydo réduction meine mathe de Chimie eModules bc oxydoreduction pdf |
|
réactions d oxydo-réduction - L UNF3S en 2015, c est
[PDF] réactions d 'oxydo réduction L 'UNFS en , c 'estunfs cerimes media paces gauchard pierre alexis p pdf |
|
classification qualitative des couples oxydant réducteur - Fastef
[PDF] classification qualitative des couples oxydant réducteur Fastef fastef ucad sn articles fiches pc fiche pedagogique pdf |
|
Chapitre 3 :Oxydoréduction
[PDF] Chapitre Oxydoréductionmelusine eu syracuse immae mpsi physique chimie pdf |
|
Programme de chimie: Niveau : 10 1- Notion Sur l oxyde réduction
août Oxydant Réducteur Oxydation Cours de chimie Thème réaction d ' oxydoréduction avec transfert O Titre Importance industrielle de la |
- oxydant reducteur equation
- oxydant reducteur exercice
- oxydation définition chimie
- oxydant exemple
- oxydant reducteur cours
- demi equation oxydant réducteur
- couple oxydant réducteur
- un oxydant est une espèce chimique capable de
cours chimie

cours chimie

![cours chimie cours chimie]()
cours chimie
![Chimie des solidespdf </b></h3></figcaption>
<p>Source: Liaison chimique </p>
</figure>
<figure style=]()
![PDF) CV marie girardot 9 mo - Université de Neuchâtel</b></h3></figcaption>
</figure>
<figure>
<img
data-src=]()
9 mo - Université de Neuchâtel
![PDF) CV marie girardot </p>
</figure>
</div>
<br/>
<br/>
<script>
var imgs = document.querySelectorAll( PDF) CV marie girardot </b></h3></figcaption>
<p>Source: Amine B - Academiaedu]()
cours chimie

9 mo - Université de Neuchâtel

mon drive
google drive - Rencontre et Loisirs
- mode d'emploi google drive pdf
- google drive mode opératoire
- tutoriel google drive pdf
- tutoriel google docs
- google drive tutorial français
- google drive mode d'emploi
- tutoriel google drive francais
- google drive en francais
tutoriel google docs pdf
Tutoriel quot Google docs quot
- comment utiliser google docs
- google docs en français
comment utiliser google docs
1 Utiliser google drive et google docs
- tutoriel google drive pdf
- formation google drive
- google drive tutorial français
- aide google drive
- google drive mode d'emploi
- https drive google com drive recent
- enregistrer dans drive
- windows google drive
dropbox
Dropbox User Guide