|
Chimie-des-solutions-examens-corrigés-06pdf
a- Calculer les coefficients de dissociation a et a' des acides AH et A'H respectivement Que peut-on conclure au sujet de la force des deux acides? b- |
|
Coefficient de dissociation dun acide
Lorsqu'on introduit un acide AH dans de l'eau il y a une réaction d'équation AH + H2O = A- + H3O+ L'acide AH se dissocie alors pour former des ions H3O+ DOC1 |
|
Kp = (PNO2 )2/PN2O4 Kp= 4α2P/(1-α2) α = (Kp/4P+Kp)1/2 AN P
Corrigé des exercices 4 et 5- série 2 Exercice 4 A 300K la 2- Donner l'état d'avancement de la réaction en utilisant le coefficient de dissociation |
|
«EXERCICES ET PROBLEMES CORRIGES DE
1 Exprimer la constante d'équilibre Kp en fonction du coefficient de dissociation α et de la pression totale P du mélange gazeux 2 |
Comment on calcule le coefficient de dissociation ?
On peut alors calculer le degré de dissociation à partir de la conductivité de chaque solution, en utilisant l'équation d'Onsager, et à partir de là, en employant la loi de dilution d'Ostwald, la constante de dissociation peut être calculée par la formule : K = 2C/l - où C est la concentration en moles par litre et est
Quel est le coefficient de dissociation ?
Le coefficient de dissociation est une mesure de la proportion de la substance qui se dissocie réellement.
Mathématiquement, nous lui attribuons le symbole �� et il équivaut à la quantité de substance dissociée divisée par la quantité totale de substance dissociée et non dissociée.Comment calculer le coefficient de dissociation de l'acide acétique ?
Pour l'acide acétique CH3-COOH, Ka = 1,8 × 10-5 M, ce qui donne pKa = 4,75.
- Si on augmente la concentration de l'acide faible, le degré de dissociation diminue, comme le suggère la loi de dilution d'Ostwald : Le seul facteur qui produira l'effet opposé est une augmentation de la dilution.
Cela réduira la concentration de l'acide faible et augmentera le degré de dissociation.
|
Interro no2 (14-12-2009) corrigé-type
1) Calculez le coefficient de dissociation α lorsque 02 mol de N2O4 (g) sont introduites dans un récipient de 10 dm3 préalablement vide. 2) Calculez la |
|
Coefficient de dissociation dun acide
[H3O+] : concentration des ions H3O+ dans la solution en fin de réaction. C0 : concentration initiale de l'acide avant sa réaction avec l'eau. |
|
«EXERCICES ET PROBLEMES CORRIGES DE
Préciser l'influence du gaz inerte sur l'équilibre de dissociation de PCl5. Exercice III. B. 9. Coefficient de dissociation. Calculer à 2500K le coefficient de |
|
Module CHIM 102A : DS n°1 (durée : 1 heure)
f) Calculer le coefficient de dissociation de l'acide méthanoïque dans cette solution. − α = = a. [HCOO ]. 004. C. On prendra Ke = 10-14. Exercice n°6 : /4 |
|
EXERCICES INCONTOURNABLES
Le corrigé n'est utile qu'apr`es une réflexion approfondie. C'est un travail de Le coefficient de dissociation α d'un acide correspond au rapport de la quan-. |
|
Travail dirigé 9 : Léquilibre chimique
- coefficient de dissociation. - Loi d'Avogadro et loi de Dalton. - principe de Le Châtelier. - la notion de rendement de réaction. Exercices : 1. Expression Kc |
|
Exercice II : Solution aqueuse dun acide faible Enoncé
2- Calculer pour chaque concentration le coefficient de dissociation de l'acide nitreux. Correction : 1- Les deux équilibres à considérer dans les 3 cas ... |
|
Polycopié Biophysique Cours et Exercices corrigés 2ème année
28 mars 2020 Exemple5: Sachant que la concentration molaire de CaCl2 = 2 mole/l avec un coefficient de dissociation α =1. Calculer la concentration ... |
|
Travail dirigé bis : les acides et les bases
f) calculer le coefficient de dissociation de cet acide à cette concentration. Comparer le résultat à celui de l'exercice 2.4. (R.: 71 %). 2.6. Parmi les ... |
|
Introduction à léquilibre chimique Introduction à léquilibre chimique
Exercice 1 : Manipulation de constantes d'équilibre. [♢00]. On donne les 4 - Calculer le coefficient de dissociation à l'équilibre α = ξéq/n0. Que ... |
|
Interro no2 (14-12-2009) corrigé-type
1) Calculez le coefficient de dissociation ? lorsque 02 mol de N2O4 (g) sont introduites dans un récipient de 10 dm3 préalablement vide. |
|
Coefficient de dissociation dun acide
[H3O+] : concentration des ions H3O+ dans la solution en fin de réaction. C0 : concentration initiale de l'acide avant sa réaction avec l'eau. |
|
Module CHIM 102A : DS n°1 (durée : 1 heure)
Module CHIM102A : DS n°1 (durée : 1 heure) : CORRIGE. Exercice n°1 : /2 f) Calculer le coefficient de dissociation de l'acide méthanoïque dans cette ... |
|
Fiche de synthèse n°2 : réactions acido-basiques en solution aqueuse
= ?2 C0. (1 ? ?). Ka est une constante donc : Pour deux acides faibles de même concentration le coefficient de dissociation sera plus élevé pour l'acide. |
|
Exercice II : Solution aqueuse dun acide faible Enoncé
10-5 mol.l-1. 2- Calculer pour chaque concentration le coefficient de dissociation de l'acide nitreux. Conclure. On rappelle que le |
|
F = [ ] ]f = [ ]
Exercice ? : Solution aqueuse d'ammoniac : Si l'ammoniac était totalement dissocié d'après l'équation précédente |
|
EXERCICES INCONTOURNABLES
Il est déconseillé de regarder le corrigé d`es la premi`ere Le coefficient de dissociation ? d'un acide correspond au rapport de la quan-. |
|
Travail dirigé 9 : Léquilibre chimique
coefficient de dissociation. - Loi d'Avogadro et loi de Dalton. - principe de Le Châtelier. - la notion de rendement de réaction. Exercices :. |
|
CHIM105B – DS1 – Corrigé
b) Donner l'expression de la conductivité ? de ces solutions en fonction de la concentration initiale c en acide fluorhydrique du coefficient de dissociation ? |
|
Introduction à léquilibre chimique Introduction à léquilibre chimique
Exercice 1 : Manipulation de constantes d'équilibre 4 - Calculer le coefficient de dissociation à l'équilibre ? = ?éq/n0. |
|
Interro no2 (14-12-2009) corrigé-type - AFO
1) Calculez le coefficient de dissociation ? lorsque 02 mol de N2O4 (g) sont introduites dans un récipient de 10 dm3 préalablement vide |
|
EXERCICES INCONTOURNABLES - Dunod
Le coefficient de dissociation ? d'un acide correspond au rapport de la quan- tité d'acide dissociée sur la quantité d'acide initiale Rappel : Le coefficient |
|
Corrigé- Série 2- Travaux dirigés de Chimie des Solutions Aqueuses
Corrigé- Série 2- Travaux dirigés de Chimie des Solutions Aqueuses Exercice 1 : La dissociation de l'acide est totale: HCl + H2O H3O+ + Cl- |
|
Chimie-des-solutions-examens-corrigés-06pdf - F2School
a- Calculer les coefficients de dissociation a et a' des acides AH et A'H respectivement Que peut-on conclure au sujet de la force des deux acides? |
|
Coefficient de dissociation dun acide
Lorsqu'on introduit un acide AH dans de l'eau il y a une réaction d'équation AH + H2O = A- + H3O+ L'acide AH se dissocie alors pour former des ions H3O+ DOC1 |
|
TD N°8-2 PDF PDF Acide acétique Acide - Scribd
Calculer le coefficient de dissociation ? et le pH d'une solution normale d'acide Examen CB21 31 Mai 2012+Corrige web-exercices-precipitation pdf |
|
Module CHIM 102A : DS n°1 (durée : 1 heure)
Module CHIM102A : DS n°1 (durée : 1 heure) : CORRIGE Exercice n°1 : /2 f) Calculer le coefficient de dissociation de l'acide méthanoïque dans cette |
|
Kp = (PNO2 )2/PN2O4 Kp= 4?2P/(1-?2) ? = (Kp/4P+Kp)1/2 AN P
Corrigé des exercices 4 et 5- série 2 Exercice 4 2- Donner l'état d'avancement de la réaction en utilisant le coefficient de dissociation ? de N2O4 |
|
Exercice II : Solution aqueuse dun acide faible Enoncé - Free
10-5 mol l-1 2- Calculer pour chaque concentration le coefficient de dissociation de l'acide nitreux Conclure On rappelle que le |
|
Exercices : cinétique macroscopique corrigés
Chapitre 3 Exercices : cinétique macroscopique corrigés Page 2 Exercice 1 : diverses lois de vitesse Nous voyons que le coefficient directeur vaut 1 |
Comment calculer le coefficient de dissociation ?
On peut alors calculer le degré de dissociation à partir de la conductivité de chaque solution, en utilisant l'équation d'Onsager, et à partir de là, en employant la loi de dilution d'Ostwald, la constante de dissociation peut être calculée par la formule : K = 2C/l - où C est la concentration en moles par litre et estQuel est le coefficient de dissociation ?
Le coefficient de dissociation est une mesure de la proportion de la substance qui se dissocie réellement. Mathématiquement, nous lui attribuons le symbole �� et il équivaut à la quantité de substance dissociée divisée par la quantité totale de substance dissociée et non dissociée.Comment savoir l'acide le plus dissocie en solution ?
Les acides ayant les pKa les plus bas sont les plus forts, les plus dissociés ; le pH de leurs solutions sont les plus faibles à une concentration donnée.- Pour deux acides faibles de même concentration, le coefficient de dissociation ?? sera plus élevé pour l'acide qui a le ?????? le plus petit donc pour l'acide le plus fort.
Comment calculer le coefficient de dissociation ?
. Le degré de dissociation peut être calculé en divisant la quantité de substance dissociée par la quantité totale de substance, la quantité pouvant être donnée en nombre de molécules ou en moles.
Quel est le coefficient de dissociation ?
. Le degré de dissociation est défini comme la proportion de la substance qui est dissociée, et il est généralement exprimé sous forme décimale.
. Le degré de dissociation est souvent donné par le symbole �� (alpha).
Comment calculer le coefficient de dissociation d'un acide faible ?
. L-1, on a ? = 0,095 = 9,5% .
. Cela signifie que pour 100 moles d'acide, moins de 10 d'entre elles seront dissociées.
Comment tester la loi de dilution d'Ostwald ?
. De même, ? tend vers 1 si et seulement si Kb/C augmente, or Kb est une constante, donc la base est d'autant plus protonée qu'elle est diluée .
|
Corrigé- Série 1 - Université Chouaïb Doukkali
Corrigé- Série 1- Travaux dirigés de Chimie des Solutions Aqueuses Exercice 1 : 1) Calculer la (1) Déterminer le coefficient de dissociation de cet acide |
|
Module CHIM 102A : DS n°1 (durée : 1 heure)
Module CHIM102A : DS n°1 (durée : 1 heure) : CORRIGE Exercice n°1 : /2 f) Calculer le coefficient de dissociation de l'acide méthanoïque dans cette solution |
|
Exercice II : Solution aqueuse dun acide faible Enoncé - Free
10-5 mol l-1 2- Calculer pour chaque concentration le coefficient de dissociation de l'acide nitreux Conclure On rappelle que le |
|
EXERCICES INCONTOURNABLES - Dunod
Il est déconseillé de regarder le corrigé d`es la premi`ere difficulté Apr`es avoir rappelé la définition du coefficient de dissociation d'un acide, donner sa valeur |
|
TD 4 : autour de léquilibre chimique
EXERCICE 1 : dissociation du bromure de cuivre(II) On considère la Calculer la valeur du coefficient α de dissociation de HI à l'équilibre (Le coefficient de |
|
Exercices : cinétique macroscopique corrigés
Nous voyons que le coefficient directeur vaut 1 Conclusion : l'ordre de la réaction est bien 1 Exercice 3 : loi d'Arrhénius Svante Arrhénius La constante de |
|
Correction TD4 - PCSI-PSI AUX ULIS
Correction TD C1 2015/2016 Exercice 1 : Décomposition de l'eau oxygénée 1 D'après L'ajout d'une courbe de tendance permet de déterminer le carré du coefficient de corrélation Exercice 4 : Dissociation du chlorure de sulfuryle 1 |
|
Cours et exercices de chimie des solutions - Elearning-ESGEE
On définit le coefficient de dissociation de l'acide comme le rapport de la 6- Chimie MPSI ; cours, méthode et exercices corrigés ; Le nouveau précis Bréal |
|
Équilibres en phase homogène et hétérogène Exercice 1
Exercice 1: Formalisme de la constante d'équilibre vers un nombre minimal de moles gazeuses) → le coefficient de dissociation α diminue 4) ∆rH° |
|
Grandeurs de réaction Equilibres chimiques correction Exercice 1
Exercices MathSpé PC 2012-2013 C Saury PC Exercice 1 : fait en TD Exercice 2 : 2) coefficient de dissociation du bromure de nitrosyle : 2NOBr (g) = 2NO |
SOLUTIONS AQUEUSES ; CONDUCTIMÉTRIE - corrigé des exercices A
II Conductimétrie et constante de dissociation 1 • NaCℓ est un composé ionique, totalement dissocié en solution ; la conductivité molaire n'est donc pas diminuée par le coefficient de dissociation α = 1 On suppose en outre que la solution à C = 10-3 mol L-1 est assez diluée pour que Λ ≈ Λ 0 Dans ces conditions, la
Interrogation II de Chimie générale (décembre 2010) : Corrigé
1) Calculez le coefficient de dissociation α lorsque 0,2 mol de N 2O 4 (g) sont introduites dans un récipient de 10 dm3 préalablement vide 2) Calculez la pression totale à l'équilibre 3) On introduit 0,1 mol d'Ar (gaz inerte pas de réaction) dans le système à l'équilibre en maintenant le volume constant
Cours et exercices de chimie des solutions
La valeur de la force ionique permet de calculer le coefficient d’activité de chaque ion (qui ici est identique, car la charge de chaque ion est la même en valeur absolue) : Coefficient de dissociation (d’ionisation) Un électrolyte est un composé chimique qui, à l’état fondu ou dissous, peut subir l’électrolyse, c’est-à-dire,
exercices supplémentaires en chimie analytique
Exercice N°1 : 1 Calculer la concentration molaire d’une solution d’acide nitreux HNO2 de normalité N, dans les trois cas suivants : N1= 10-1 N ; N 2= 10-2 N ; N 1= 10-5 N 2 Calculer pour chaque concentration le coefficient de dissociation α de l’acide nitreux et le pH correspondant Conclure Donnée : pKa =3,2 Exercice N°2 : 1
Corrigé de la série N°2 ; équilibre d’acido-basique Exercice N°1
Corrigé de la série N°2 ; équilibre d’acido-basique Exercice N°1 : 1/Les équations de dissociation, les couples acides/bases et le pH des solutions suivantes a) Solution acide chlorhydrique (HCl) Ca= 10-2 mol/L : L’équation de dissociation: Les couples acides/bases mis en jeu sont : HCl/Cl-et
Mise en fab Physique-chimie BCPST1 4e édition
`al’´ etudiant de v´erifier que les principales capacit´es sont maˆıtris´ees Ces exercices viennent compl´eter le travail effectu´e en classe Travailler un exercice n’est pas une tˆache aussi simple qu’elle n’y paraˆıt La premi`ere ´etape est de lire l’´enonc´e dans son int´egralit´e, d’en noter les termes qui
Les orbitales moléculaires
ou l'enthalpie standard de la réaction de dissociation de H 2 (cf chapitre thermochimie) est: D(H 2) = + 4,74 eV C'est : 2E(H) E(H 2 à Re) Pour dissocier la molécule H 2 en ses 2 atomes, il faut fournir à la molécule 4,74 eV Les 2 électrons de la liaison sont à séparer
Chapitre II: La solubilité
10-17 constante de dissociation de complexe : K2([Zn(OH)4] 2-) =4,5 10-16 K 3([Zn(NH3)4] 2+) =1 10-9 Quels sont les pH d'apparition et de disparition du précipité Quelle qté de base a t'il fallu ajouter pour juste redissoudre le précipité ? A la place de la soude on ajoute de l'ammoniaque concentrée Quelle est la qté minimale
Exercice VIII-14
Exercice VIII-14 : Etude thermochimique de la synthèse de l’ammoniac Industriellement, la synthèse de l’ammoniac se fait selon l’équilibre : N2() ()g + 3H2 g →← 2NH3 g 1-Calculer l’enthalpie standard de réaction ∆rH° à 298 K 2-Calculer l’enthalpie de réaction ∆rH° à 770 K La réaction est-elle exothermique ou
|
Interro no2 (14-12-2009) corrigé-type
[PDF] Interro no ( ) corrigé type afo ulg ac be fb ens CorrigeTD pdf |
|
Exercice II : Solution aqueuse d un acide faible Enoncé
[PDF] Exercice II Solution aqueuse d 'un acide faible Enoncé pmb opac css doc num php?explnum id= |
|
td chimie_2 chapitre 3
[PDF] td chimie chapitre saaddahlebbllida esy es td%chimie %chapitre% pdf |
|
Module CHIM 102A : DS n°1 (durée : 1 heure)
[PDF] Module CHIM A DS n° (durée heure)ressources univ lemans AccesLibre UM Pedago semS pdf |
|
acide base - Faculté des Sciences de Rabat
[PDF] acide base Faculté des Sciences de Rabat fsr ac ma TD%acide%base%%Fevrier% pdf |
|
COURS ET EXERCICES DE CHIMIE DES - E - Learning
[PDF] COURS ET EXERCICES DE CHIMIE DES E Learning elearning univ bejaia dz mod resource view php?id= |
|
Chimie PCSI - Decitre
[PDF] Chimie PCSI Decitre decitre media pdf pdf |
|
corrigé - L UTES
[PDF] corrigé L 'UTES lutes upmc modules resources LCcorrsept pdf |
|
c- K °= #8719; ai
[PDF] c K °= aipcsi chimie damas e monsite medias correction td pdf |
|
Exercices supplémentaires en chimie analytique - E - Learning
Exercices supplémentaires en chimie analytique Calculer pour chaque concentration le coefficient de dissociation de l 'acide Corrigé de l 'exercice N ° |
- coefficient de dissociation wikipedia
- équilibres chimiques exercices+corrigés
- coefficient de dissociation de l acide acétique
- degré de dissociation

exercices corrigés: Réactions Acide-Base en solutions aqueuses FSR
Source:https://imgv2-2-f.scribdassets.com/img/document/52338762/original/e671d37e8c/1612377068?v\u003d1
Corrigé+s
Source: Concentration molaire

Thermo%20global by Ahmed Bénchir - issuu
Source:https://docplayer.fr/docs-images/40/6544693/images/page_2.jpg
Les acides et les bases Corrigés des exercices Table des matières
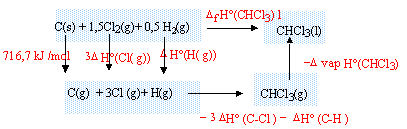
Source:https://2.bp.blogspot.com/-RPuSCnnMMFo/V8laTM5W_cI/AAAAAAAAAYg/pR7OTHOg0wkizND0FUuY2B_mwM10kaMoACPcBGAYYCw/s1600/thermo11chimie.gif

Exercices et TD corrigés Thermochimie smpc S1 PDF SMP1- SMC1- SMA1
Source:https://i.ytimg.com/vi/uQ4ukgqAr7A/maxresdefault.jpg

Exercice thermochimie s1-Kp en fonction du coefficient de
Source:https://i.ytimg.com/vi/4OeQIdI1ofs/mqdefault.jpg
pka h2so4
pKa de divers couples acido-basiques
- pka nh3
- pka acide formique
- pka h2o
- pka naoh
- pka ethanol
- pka ch3cooh
- pka acide phosphorique
- pka hydroxyde de sodium
exemple de ice breaking
Icebreakers (Jeux pour briser la glace)
- ice breaker jeu entreprise
- jeu pour briser la glace
- icebreaker créativité
- activité brise glace préscolaire
- jeu pour faire connaissance adulte
- jeux de cohésion d'équipe
- jeux brise glace soirée
- activité brise glace petit groupe adulte
fonction d'une caissière
Fiche poste de caissier - CGT Groupe Casino
- fiche de poste caissier comptable
- les qualités d'une caissière
- les taches d'un caissier de banque
- compétences pour caissière
- fiche de poste caissier banque
- que fait une caissière
- qu'est ce qu'un caissier
- qualités d'un bon caissier de banque
qualités d'un bon caissier de banque
CAISSIER / CAISSIERE PROFIL DE QUALIFICATION
- comment etre une bonne caissière
- les taches d'un caissier de banque
- les taches d'un caissier
- fiche de poste caissier comptable
- les qualités d'une caissière
- fiche de poste caissier banque
- fiche de poste d'une caissière
- qu'est ce qu'un caissier