|
1 Orbitales des ions hydrogénoïdes
Z où Z est un nombre naturel φ (β) 1s et φ (β) 2s sont respecti- vement les orbitales de l'ion hydrogénoïde de nombre atomique Z laquelle l'énergie |
|
Classification périodique des éléments
(a) Calculer la valeur de l'énergie des quatre premiers niveaux d'énergie des ions He+ et Li2+ et les comparer à celles de l'atome d'hydrogène Déterminer |
|
Corrigé de la série de TD N 2 Exercice 1 Exercice 2
- La longueur d'onde correspondante à l'ionisation : Énergie de l'ion hydrogénoïde : En=‐136×(Z)2/n2 Ionisation de Be3+ (Z =4) dans son état fondamental (n = |
|
Exercice n°1 : (8 points) Ici absorption de λ à partir du niveau n=2
Énergie de l'ion hydrogénoïde : E = -‐136*(Z)2/n2 Ionisation de Be3+ (Z Quelle est l'orbitale atomique associée aux nombres quantiques n=2 ; l=2 et m=0 |
|
Exercices corriges de structure de la matiere et de liaisons chimiques
Calculer en eV et en joules l'énergie des quatre premiers niveaux de l'ion hydrogénoïde Li2+ sachant qu'à l'état fondamental l'énergie du système noyau- |
|
Hydrogénoı̈des et méthode de Slater
Un hydrogénoïde ou atome hydrogénoïde est un ion monoatomique ne possédant qu'un seul électron comme l'hydrogène Il a donc une structure électronique |
|
UE 4TBX310U
Soit un système hydrogénoide dont l'énergie d'ionisation est 217 6 eV • Quelle est la plus petite valeur possible du nombre quantique • Dessiner sur un |
Quelle énergie en eV Faut-il fournir à l'atome d'hydrogène dans son état fondamental pour l ioniser ?
L'atome d'hydrogène ne peut absorbe ou émettre qu'un photon d'énergie bien définie. où n est un entier (il s'agit des différents niveaux), et E0 l'énergie nécessaire pour ioniser l'atome d'hydrogène à partir de son niveau fondamental, (valeur est égale à 13,6 eV).
Quelle énergie en eV Faut-il fournir pour ioniser l'ion He+ ?
L'énergie d'ionisation est l'énergie de la réaction suivante : H(g) --> H+(g) + e-.
Ei=EH+-E1=13,6 eV.
Un ion hydrogénïde posséde un électron et Z protons : il a la même structure électronique que l'atome d'hydrogène.Comment calculer l'énergie d'un hydrogénoïde ?
Les niveaux d'énergie d'un ion hydrogénoïde sont similaires à ceux de l'atome d"hydrogène : on a : En = - R Z2/n2, où Z est le nombre de charges de l'élément considéré, Z-1 étant la charge de l'ion hydrogénoïde correspondant.
- Attention, le premier niveau d'énergie (niveau fondamental) est parfois noté E0.
Lorsque n --> l'électron est non lié ou encore libre, l'atome H est ionisé.
E = 0.
|
Niveaux dénergie de latome dhydrogène
Li2+ est un ion hydrogénoïde. Energie de l'électron dans l'état fondamental : E Li2+ = -136 (Z / n)² avec n |
|
Classification périodique des éléments
Les ions He+ et Li2+ sont-ils hydrogénoïdes ? Quel est l'ion hydrogénoïde correspondant à l'élément carbone ? 2. Les énergies de l'état fondamental |
|
Exercice n°1 : (8 points) Ici absorption de ? à partir du niveau n=2
Li2+ est un hydrogénoïde. Be3+ est un hydrogénoïde car il possède un seul électron. c) Définir l'énergie d'ionisation. La calculer pour l'ion Be3+. A quelle |
|
Atomistique : exercices
L'énergie d'ionisation de l'atome d'hydrogène à partir de son état fondamental |
|
Niveaux dénergie des hydrogénoïdes
Quels sont les ions hydrogénoïdes du lithium (Li Z=3) et à l'hélium (He |
|
Atomistique : exercices
Quelle est l'énergie d'ionisation de l'atome d'hydrogène dans cet état excité (en eV et en 3) Les ions Be+ et Li2+ sont-ils des systèmes hydrogénoïdes ? |
|
Energie des atomes polyélectroniques et coefficient décran
4 mars 2005 Un calcul tout aussi simple donne les niveaux d'énergie des ions hydrogénoïdes c'est-à-dire des ions constitués d'un noyau de charge Z |
|
Ions hydrogenoides et transitions electroniques
Il est demandé dans une premiere question de calculer en eV l'énergie de désexcitation de l'ion Li2+ depuis son état initial ni (Li2+)=6 |
|
DEUG S
Quelle est la longueur d'onde maximale de la radiation capable d'arracher un Le modèle de Bohr donne l'énergie de l'électron d'un ion hydrogénoïde de ... |
|
Énergie dionisation — Wikipédia
Le potentiel d'ionisation ou énergie d'ionisation d'un atome ou d'une molécule est l'énergie qu'il faut fournir à un atome neutre pour arracher un électron |
Comment calculer les niveaux d'énergie ?
Les niveaux d'énergie de He+ et de Li2+, s'obtiennent en appliquant ta formule, et en remplaçant Z par 2 pour l'hélium et par 3 pour le lithium, en choisissant à chaque fois une valeur de n qui te convient, comme n=1 pour commencer. Puis n = 2. Vas-y !
Comment calculer le niveau d’énergie d’un atome d’hydrogène ?
1-1.1 L’atome d’hydrogène est initialement à son état fondamental (n = 1) 1-1.2 L’atome d’hydrogène est à l’état excité correspondant au niveau d’énergie (n = 2). 1-2 Faire le schéma du diagramme des niveaux d’énergie de l’atome d’hydrogène en utilisant l’échelle : 1 cm pour 1 eV. On ne représentera que les six premiers niveaux.
Comment calculer les niveaux d’énergie d’un atome de lithium ?
La figure représente un diagramme très simplifié des niveaux d’énergie de l’atome de lithium de numéro atomique Z=3, de formule électronique K 2 L 1. On considère les quatre transitions représentées sur le diagramme. Les longueurs d’ondes correspondantes sont l 1 = 671 nm ; l 2 = 812 nm ; l 3 = 323 nm et l 4 = 610 nm.
Quelle est la longueur d'onde d'un ion hydrogénoide ?
Un ion de lithium peut il émettre une onde de longueur d'onde 75 nm entre ces mêmes niveaux ? Un ion hydrogénoide est un ion n'ayant qu'un seul électron : dans la 1ere question, tu dois donc trouver les ions du lithium et de l’hélium qui n'ont qu'un seul électron.
| Les niveaux d’énergie - Le Site Web de Jeff O'Keefe |
| Chapitre 2 : Spectre des Hydrogénoïdes et Modèle de BOHR |
| E SPECTRE DE RAIES DE L HYDROGÈNE ET CONSTANTE DE RYDBERG |
| 1) Quantification de l'énergie d'un atome |
| TD1 Atomistique Orbitales Méthodes de Slater Energie d ionisation |
| Searches related to quelle est la valeur en ev du niveau d+énergie fon filetype:pdf |
|
Exercice n°1 : (8 points) Ici absorption de λ à partir du niveau n=2
Li2+ est un hydrogénoïde Be3+ est un hydrogénoïde car il possède un seul électron c) Définir l'énergie d'ionisation La calculer pour l'ion Be3+ A quelle |
|
Atome dhydrogène et hydrogénoïdes
de son caractère fondamental et historique (la mécanique quantique s'est en grande partie l'on a associé aux niveaux d' énergie de l'hydrogène atomique), son étude présente de -les ions ne contenant qu'un électron (He+, Li2+, U91+ ) mais on constate qu'elle prend des valeurs notables dans un intervalle de θ |
|
Exercice III-8 : Calcul des potentiels dionisation des alcalins - Free
1b- De quel atome neutre l'ion Li2+ est-il isoélectronique ? Calculer en eV l' énergie de l'ion Li2+ dans son état fondamental En déduire la valeur de I3 en eV 1c- Calculer la valeur de I2 en eV Commenter les valeurs relatives de I1, I2, I3 autres électrons de niveau n 1b- L'ion Li2+ est isoélectronique de l' hydrogène E |
|
Hydrogénoı̈des et méthode de Slater
Un hydrogénoïde ou atome hydrogénoïde est un ion monoatomique ne possédant qu'un seul Par contre, contrairement à l'hydrogène, la charge de son noyau est +Ze (où Z est le numéro L'énergie de l'électron d'un hydrogénoïde est donnée par l'expression : La valeur de σi est résumée dans le tableau suivant |
|
Sans titre - Unithequecom
Cette valeur est une constante, appelée « célérité », et notée c A ce niveau, nous sommes donc en mesure de déterminer l'énergie transportée par Quelle est l'énergie transportée par un photon dont la longueur d'onde est l'ion 3Li2+ Considérons l'électron de l'atome d'hydrogène dans son état fondamental |
|
UE 4TBX310U - ATOMISTIQUE TRAVAUX DIRIGÉS
15 VII-2 Fonction d'onde 2pz des ions d'hydrogénoïdes Donner l'expression des niveaux d'énergie (en eV) de l'atome d'hydrogène en fonction du nombre quantique principal n Quelle est la valeur (en m-1) de la constante de Rydberg pour Li2+ II-2 On considère l'atome d'azote dans son état fondamental |
|
QUANTIFICATION DE LÉNERGIE DES ATOMES
On dit également ion hydrogénoïde : c'est un atome ou un ion qui ne Si le système atomique pouvait prendre toutes les valeurs énergétiquement L'atome d'hydrogène est constitué d'un noyau, et d'un électron de masse m qui décrit Ces états sont appelés niveaux d'énergie ou état quantiques niveau fondamental |
mise en valeur des énergies renouvelables en tunisie
(8 ) Nous supposerons toutefois que le niveau des pertes atteindrait 10 en 2030 La production nationale de l’électricité serait alors de 22 TWh en 2020 et de 35 TWh en 2030 Ce niveau de production suppose également que les échanges avec les pays voisins se maintiendraient à leur niveau actuel de 2,8 de la production nationale d
en cas de difficulté
Valeur : E 3 = - 4,98 eV Tous les niveaux d'énergie autres que le niveau "Fondamental" sont dits "excités" Ici , il n'y a que 10 orbites possibles donc il y a 10 niveaux d'énergie correspondants (de E 0 à E 9) Et il y un 11ème niveau (niveau 0 eV) qui correspond à la situation où l'électron a quitté l'atome : c'est l'état "ionisé"
Chapitre 21 Deux siècles d’énergie
a Les flèhes représentent des hangements de niveau d’énergie de l’ato me b La flèche représente l’asorption d’un photon par l’atome c La flèche représente l’émission d’un photon par l’atome d Cet atome peut émettre ou a sorer des photons dont l’énergie est E = 2,71 eV 5
Les orbitales moléculaires
est plus stable que les 2 H séparés car son niveau d'énergie est plus bas L'énergie de stabilisation ∆E de l'orbitale liante est inférieure, en valeur absolue, à l'énergie de déstabilisation ∆E* de l'orbitale antiliante ∆E* ∆E 13,6 eV E p Re = 74 pm (13,6 2,37= 15,97)eV
Examen de Physique Classe: S E et LH Première exercice
m de valeur = 3500 N À une date t 1, la voiture a parcouru une distance de 150 m et sa vitesse atteint la valeur 25 m/s On désigne par (S) le système (voiture, Terre) et on prend comme niveau de référence de l'énergie potentielle de pesanteur, le plan horizontal passant par le centre de gravité de la voiture
11 Bandes dénergie - pagesperso-orangefr
une bande interdite (Gap) La différence entre semi-conducteur et isolant est due à la valeur énergétique E Gap de cette bande interdite, voisine de 1 eV pour les semi-conducteurs et de 6 eV pour les isolants Remarque : L’électronvolt (eV) est une unité d’énergie : 1 eV = 1,6 10-19 J 1 2 Interaction de la lumière avec la matière
Exercices d’énergie potentielle - énergie mécanique
Exercices d’énergie potentielle - énergie mécanique Exercice 1 : Sara, debout sur un pont, lance verticalement vers le haut une pierre de masse I=70 La pierre s’élève jusqu’à une hauteur de 10 I au-dessus du pont de lancement puis
Exercices corrigés atomistique pdf
35 Quelle est la probabilité qu’un électron soit présent dans un état fondamental entre deux sphères concentriques d’un rayon de 0,5 a0 et 1,5 a0 (on donne : )? 36 COURS Quelle est la valeur de la fonction y(n,l,m) sur le noyau lorsque nos 1, 0 et m0?
Niveau : 1ére BAC Année scolaire Physique Chimie
3-2 En déduire la valeur de la masse d'eau Exercice 4 1 Un cube de 25 g de glace se trouve initialement à la température de 0,0 °C On le place dans un verre en contact avec l'atmosphère à 20 °C Calculer sa variation d'énergie interne lors de la fusion, l'eau de fonte étant à 0 °C Commenter le signe du résultat 2
La réglementation thermique
La résistance thermique R d’une paroi rénovée doit être supérieure ou égale au niveau minimal réglementaire, qui dépend de la zone climatique VALEURS VALABLES DU 1ER JANVIER 2018 AU 31 DÉCEMBRE 2022 Type de paroi opaque Résistance thermique minimale R de l’ensemble paroi + isolant en m 2 K / W zone climatique H1 zone climatique H2
|
Exercice n°1 : (8 points) Ici absorption de #955; ? partir du niveau n=2
[PDF] Exercice n° ( points) Ici absorption de ? partir du niveau n= chimie u strasbg data Elemchim CC corr pdf |
|
Exercice III-8 : Calcul des potentiels d ionisation des alcalins Enoncé
[PDF] Exercice III Calcul des potentiels d 'ionisation des alcalins Enoncétimogiant free cours Physique Chimie C EX ATO CA pdf |
|
Exercices sur quot;niveaux d énergie quot; - SharePoint
[PDF] Exercices sur quot niveaux d énergie quot SharePoint physiquechimie sharepoint Sa niveaux%d%énergie pdf |
|
atome et mécanique de Newton : exercices - chimiephysiquema
[PDF] atome et mécanique de Newton exercices chimiephysique ma chimiephysique ma ExerciceAtomeMecNewTSM pdf |
|
Rappels de cours : #957;= h #8710;E #8722; = #963; n 1 2 1 R #955; = #957; 1 c #8722; =
[PDF] Rappels de cours = h E = n R = c =merry lctn uhp nancy gmonard dokuwiki lib fetch php? |
|
Niveaux d énergie - p l a f o r g
[PDF] Niveaux d 'énergie p l a f o r g plaf phycats docs ancien A Niveaux d energie pdf |
|
Contrôle Continu 1 - L UTES
[PDF] Contrôle Continu L 'UTES lutes upmc modules resources c cc V FF pdf |
|
Cours 1 - Structure électronique , Atomistique (1)
[PDF] Cours Structure électronique , Atomistique () tsp filedepot download |
|
Atome d hydrogène et quot;hydrogénoïdes quot;
[PDF] Atome d 'hydrogène et quot hydrogénoïdes quot liphy ujf grenoble IMG pdf chapitre pdf |
|
Quantification de l énergie des électrons dans les atomes - Eduscol
Ce chapitre introduit la notion de quot quantification quot de l 'énergie et est une Pour l ' atome d 'hydrogène, chaque orbite de niveau n a pour énergie n , E = n ( en eV) et L 'énergie d 'ionisation est l 'énergie ? fournir pour faire passer l ' électron de l 'état fondamental L 'étude des hydrogénoïdes (de formule générale ZX |
- energie d'ionisation de li2+
- ion hydrogenoide definition
- energie d'ionisation ion hydrogenoide
- hydrogenoide energie
- hydrogénoïde exercice
- hydrogénoïde modèle de bohr
- hydrogénoïde formule
- ions hydrogenoide exemple
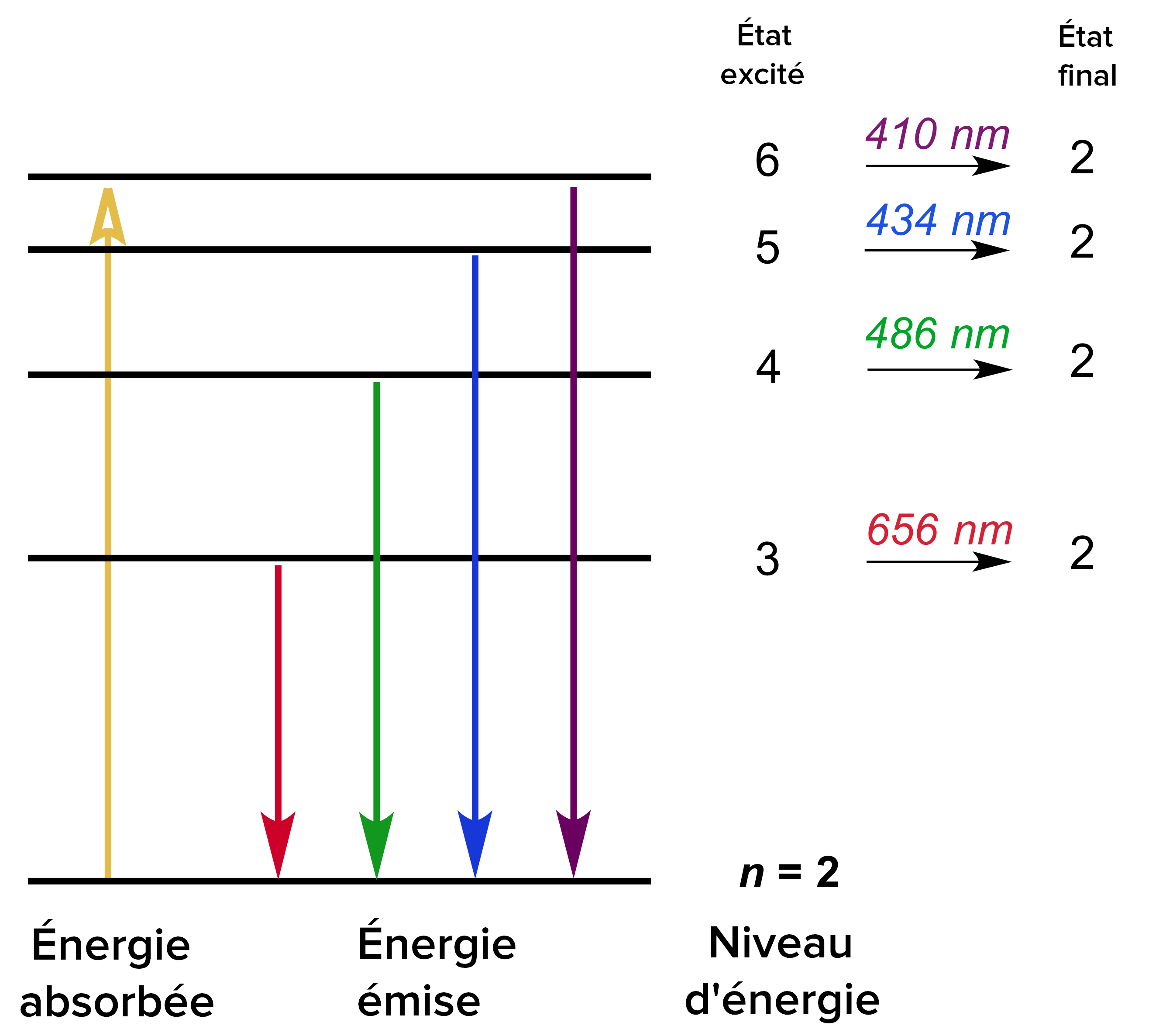
emc2 - Niveaux d'énergie de l'atome d'hydrogène - Emission et
Source:https://cdn.kastatic.org/ka-perseus-images/284680f3cfc3e6865da65171d8a72ccfd6c75a14.png
Modèle de Bohr de l'atome d'hydrogène (leçon)
Source: Khan Academy

Physique_21_PROBLEME_RESOLU_21_A
Source:http://physique.chimie.pagesperso-orange.fr/Images/H_niveaux_bis.GIF

Physique_21_PROBLEME_RESOLU_21_A
Source:https://www.fichier-pdf.fr/2014/04/24/exercice-corrige-spectre-1/preview-exercice-corrige-spectre-1-1.jpg
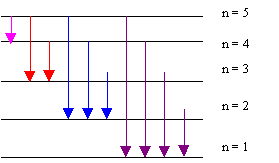
exercice corrigé spectre (1) - Fichier PDF
Source:http://www.chimie-briere.com/TD2002-03/ATOMES/serie2/Image87.gif

SERIE 2 - Spectre de l'Hydrogène et des Hydrogénoïdes
Source:http://physique.chimie.pagesperso-orange.fr/Images/H_emission.GIF
quantifié definition
Définition et quantification du ruissellement de l 'eau de pluie et des
- définition de la limite d'une fonction
- principe convertisseur analogique numérique
- démontrer une limite par définition
- limite par definition exercice
- convertisseur analogique numérique cours
- convertisseur analogique numérique pdf
- pas de quantification can
- echantillonnage quantification et codage d'un signal
caricature femme au travail
Images correspondant ? caricature femme au travail filetype:pdf
- caricature femme au foyer
- caricature drole femme
- dessin humoristique égalité homme femme
dessin humoristique égalité homme femme
Images correspondant ? dessin humoristique égalité homme femme filetype:pdf
- video discrimination homme femme
- photolangage
caricature femme au foyer
Les stéréotypes de la femme dans la caricature de Dilem Ali - Corela
- caricature femme au travail
- devenir femme au foyer
- dessin humoristique égalité homme femme
- prestation femme au foyer
- caricature drole femme
- mere au foyer droit
- prime femme au foyer caf
- statut mère au foyer