|
49 IV 1 INTRODUCTION Les dépôts par électrolyse est une
Les dépôts par électrolyse est une méthode pour produire un revêtement sur un métal pour le protéger à l'oxydation à haute température ou à la corrosion dans |
|
ANNALES SCIENCES PHYSIQUES 3ème
1) a- Il s'agit de l'électrolyse de l'eau 2- a) Equation bilan équilibrée oxydation 3MnO2 + 4Al 2Al2O3 + 3Mn Réduction b) Corps oxydé : Aluminium (Al) |
|
TD3: Corrosion et moyens de protection (correction)
1- Quel est le métal qui se dépose sur le fer ? R 1: Le metal qui xe depose sur la bague est obtenu par réduction du cation métallique present dans la solution |
|
Thème : Piles et électrolyses Fiche 4
Dans le cas de la solution de sulfate de cuivre (II) il y a l'ion cuivre (II) et l'eau 2) Le dépôt métallique correspond à du cuivre il y a réduction de |
|
Thème : Piles et électrolyses Fiche 4
Les ions sulfate ne participent pas aux réactions électrochimiques On observe un dépôt métallique sur l'une des électrodes et un dégagement gazeux sur l'autre |
|
Traitement de surface des métaux par un dépôt électrolytique
C'est une méthode qui donne au laiton l'aspect du cuivre par galvanoplastie la méthode consiste à recouvrir ce métal par du cuivre en utilisant l'électrolyse |
|
ةدامل ءايزيفلا و ءايميكلا
On constate au cours de l'électrolyse un dépôt de Nickel sur la cathode et dépôt métallique de plomb sur l'électrode (A) et un dégagement gazeux de |
Quels sont les matériaux métalliques ?
On classe généralement les alliages en deux catégories : les alliages ferreux et les alliages non ferreux.
Quelles sont les deux types d'alliage ?
La galvanoplastie est un processus consistant à utiliser l'éléctrodéposition pour recouvrir un objet d'une fine couche de métal.
Les ingénieurs utilisent une électrolyse contrôlée pour transférer la couche de métal désirée depuis une anode (la pièce contenant le métal à plaquer) vers une cathode (la pièce à plaquer).Qu'est-ce que la Galvano ?
On y retrouve principalement le plomb, le zinc, l'étain, le chrome et plusieurs autres.
Les métaux précieux, tels que l'or, l'argent et le platine ainsi que les métaux semi-précieux comme le titane, le cuivre, le nickel et l'aluminium se retrouvent également dans cette famille.
|
Dépôts électrochimiques de tantale à partir dune électrolyte liquide
20 mai 2015 IV.3.5 – Dépôt électrolytique du tantale par tension pulsée . ... approprié pour l'électrodéposition du tantale métallique. |
|
1 COMMISSARIAT A LENERGIE ATOMIQUE ETUDE DE
TROISIEME PARTIE. 1 - FORMATION D'ALLIAGES METALLIQUES DE SUm-'ACE PAR ELECTRO-. DEPOSITION. 78. 1.1 - Alliage béryllium-nickel. 30. 1.1.1 - Electrolyse de |
|
Physique-chimie
Thème 4 : galvanoplastie dépôt métallique sur un objet Schéma du montage expérimental permettant de réaliser un dépôt électrolytique de cuivre sur. |
|
Les ions métalliques en classe de Quatrième
a) La solution de sulfate de cuivre est réutilisable puis- qu'elle ne subit pas de modification au cours de l'électrolyse. b) Le dépôt obtenu sur la cathode |
|
Etude de lévolution de la texture cristallographique des couches
24 avr. 2018 Directeur du Laboratoire de Métallurgie Physique et Chimique pour ... Le dépôt électrolytique d'un métal se produit lorsque l'électrode sur. |
|
Chapitre 4 :La corrosion
Pour le métal on passe ainsi d'un nombre d'oxydation 0 à un nombre d' H : on a un dépôt de cuivre sur le zinc : ... C'est une protection physique. |
|
Thèse DOCTEUR Etienne BRUN Influence des paramètres d
8 nov. 2014 microballons métalliques obtenus par électrolyse ... telles que le dépôt physique sous vide (PVD) ou encore le dépôt électrolytique. |
|
OXYDANT et REDUCTEUR réduction et oxydation
Les ions ainsi formés migrent puis sont réduits au niveau de la cathode où se forme le dépôt métallique. d- placage métallique électrolytique. |
|
Document de référence sur les meilleures techniques disponibles
d'autres traitements physiques des surfaces tels que le dépôt de métaux en phase Zingage et dépôt de zinc-nickel électrolytique continu de l'acier. |
|
§ 8 (suite) Equation de Nernst
est la méthode industrielle de dépôt électrolytique d'un métal sur un support conducteur. Le principe en est une électrolyse. L'anode est constituée d'un |
I. Etude d'un CAS
1. Réaction spontanée entre le cuivre (métal) et le dibrome en solution aqueuse. Dans un tube à essais, on met en présence de la tournure de cuivre (Cu) et du dibrome (Br2) en solution aqueuse ([Br2]i=1,0.10-2 mol.L-1). La solution initialement jaune (couleur du dibrome en solution aqueuse) se colore progressivement en bleu (couleur d'une solution ...
II. Exemple et Applications de l'électrolyse
1. Remarque Les réactions qui peuvent se produire aux électrodes lors d'une électrolyse sont en général nombreuses. Toutes les espèces chimiques en solution, le solvant et les électrodes susceptibles de donner lieu à une oxydation ou à une réduction peuvent à priori participer aux transformations chimiques. A notre niveau, on demande simplement d'ê...
III. Les Accumulateurs
1. Définition. Un accumulateur est un système chimique. Il peut: 1. Fournir de l'énergie électrique à un circuit extérieur lorsqu'il évolue de façon spontanée. Il fonctionne alors en générateur et fait passer dans ce circuit extérieur un courant dont le sens est imposé par la transformation chimique spontanée. L'accumulateur se décharge. 2. Fonctio...
Qu'est-ce que le dépôt électrolytique ?
- Dépôt électrolytique de l’or et de l’argent. RÉSUMÉ. Le dépôt électrolytique de l'or et de l'argent permet l'obtention d'une couche métallique sur un substrat conducteur, par réduction cathodique des formes oxydées en solution de ces deux métaux.
Comment fonctionne l’électrolyse ?
- Une application très courante de l’électrolyse est la recharge de l’accumulateur. Un accumulateur est capable de fonctionner en pile (décharge) ou en électrolyseur (charge). Dans un accumulateur, les réactions aux électrodes sont inversables : les réactions traduisant la charge et la décharge sont inverses l’une de l’autre.
Qu'est-ce que le dépôt électrolytique d'or et d'argent ?
- Le dépôt électrolytique de l'or et de l'argent permet l'obtention d'une couche métallique sur un substrat conducteur, par réduction cathodique des formes oxydées en solution de ces deux métaux. Cet article a pour objet d'apporter une aide dans le choix du type de revêtement sur la base des propriétés recherchées.
Qu'est-ce que Le cuivrage d'un objet par électrolyse ?
- Cuivrage d’un objet par électrolyse Téléchargez ce sujet en format pdf en cliquant ici. Le cuivrage est une technique permettant de recouvrir d’une fine couche de cuivre des pièces d’acier soumises à l’oxydation par l’air ambiant. Cette couche de cuivre s’oxyde à l’air à la place de l’acier et forme une couche protectrice.
|
DS no8 Piles, accumulateurs & électrolyse Exercice 1 – La pile sous
Comment évoluent les concentrations des ions mé- talliques dans chacun des béchers? 1 6 En déduire le sens du mouvement des ions présents dans le pont |
|
Physique--Chimie\ MP - concours Centrale-Supélec
3 avr 2012 · tallique ou sous forme oxydée, et si on le récupère dans les boues solides de fond de cuve ou dans la solution électrolytique II Le cuivre |
|
Électrochimie - Agrégation de chimie
les concours pour l'enseignement supérieur(CAPES de physique-chimie) et plus généralement Elle est construite par électrolyse très lente afin de talliques Lorsque cette oxydation a lieu en milieu non aqueux, il s'agit de corrosion sèche |
|
Complexes cobalt-oxime pour la production dhydrogène
18 jui 2012 · 1 4 Production d'hydrogène par électrolyse de l'eau différents mécanismes naturels (physiques, chimiques ou biologiques) mettent en jeu des tallique Elles comprennent trois dπ (z2, x2-y2, xy) et une dσ (xz) Au plus |
|
THÈSES
LE GRADE DE DOCTEUR FS SCIENCES PHYSIQUE S PA R Lucien ANDRIEUX Mais l 'étude systématique de l'électrolyse des oxydes dissous dans l'anhydride RECHERCHES' ST?R L 'rLECTROLYSE DES OXYDES MI TALLIQUES |
|
Cours de chimie Ecole polytechnique - Les Annales des Mines
plongent deux électrodes reliées à m e source d'éleétricité, l'électrolyse se produit dès que la différence de potentiel and electrodes atteint une valere E dite force |
|
Cours délectromagnétisme – femto-physiquefr
Grandeurs et constantes physiques tallique aiguille mé- tallique isolant FIGURE 1 2 – Plus la baguette se rap- Solution électrolytique (KOHaq, NaClaq , ) |
|
Cours de Physique 3BC
En physique, une force est représentée par un vecteur Un vecteur possède tallique situé à l'intérieur du capteur de température Le bimétal est sèche- cheveux c) un fer à repasser d) un ventilateur e) l'électrolyse de l'eau 5 Quelle est la |
|
Cellule électrochimique pour lélectrolyse de leau liquide ou vapeur
[0005] Il est connu que l'électrolyse d'eau permet la production posé sur l' anode, par voie physique, par projection tallique poreuse 2 dans l' aluminosilicate |
|
PROBLEME DE PHYSIQUE
Ce procédé consiste à immerger la pièce en fer à revêtir, dans une solution de sulfate de nickel et à effectuer une électrolyse, la pièce en fer étant placée en |
Série électrolyse
de 50 de la production mondiale de zinc sont obtenus par électrolyse d’une solution de sulfate de zinc acidifiée à l’acide sulfurique Les ions sulfate ne participent pas aux réactions électrochimiques On observe un dépôt métallique sur l’une des électrodes et un dégagement gazeux sur l’autre A Etude de la transformation
EXTRAITS DES SUJET PAR SABOUR
par électrolyse Données : La masse molaire du cuivre : M(Cu) = 63,5 g mol = 9,65 104 c morl La constante de Faraday : On réalise l'électrolyse d'une solution de bromure de cuivre Il de formule utilisant deux électrodes El et E2 en graphite, il se forme ainsi du dibrome au voisinage de El et dépôt de cuwre au voisinage de E2 0,25 3- 0,75
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Certains métaux sont préparés par électrolyse d’une solution aqueuse les contenant à l’état de cations Plus de 50 de la On observe un dépôt métallique sur l’une des
Elaboration du zinc par électrolyse bac la réunion 03
obtenus par électrolyse d'une solution de sulfate de zinc acidifiée à l'acide sulfurique Les ions sulfate ne participent pas aux réactions électrochimiques On observe un dépôt métallique sur l'une des électrodes et un dégagement gazeux sur l'autre Q1 a) Schématiser l'électrolyseur, en précisant le nom de
Chimie : Théme : électrolyse ( 5 points )
t, on constate que la cathode se recouvre d’un dépôt de cuivre métallique et au voisinage de l’anode , il se forme le gaz de dibrome Br2 a°) Sur le schéma du diapositif d’électrolyse précédent , indiquer par des flèches , le sens de déplacement des anions et celui des cations lorsque l’interrupteur k est fermé ( 1 pt )
TP-cours de Chimie n°11 EXEMPLES D ELECTROLYSE
− quel peut être l'intérêt du recouvrement d'une pièce de fer par du zinc ? B 2 Vérification • Au bout de 20 minutes, ouvrir le circuit, extraire la cathode de l’électrolyseur avec précaution, la rincer à l’eau distillée et la sécher doucement • Déterminer la masse du dépôt métallique Comparer à la valeur attendue
Protection du fer par électrozingage 1 Réaliser le protocole
Les dépôts sont obtenus par divers procédés : immersion dans un bain de métal liquide, dépôt électrolytique L’électrozingage est la protection d'un objet par dépôt d'une couche de zinc grâce à une électrolyse La nature métallique du revêtement implique qu'il doit jouer un rôle électrochimique
Chapitre 3 2011 - 2012 Lélectrolyse
Ils se font par électrolyse à anode soluble (l’anode se dissout au fur et à mesure de l’électrolyse) L'électrolyte contient les cations du métal à déposer La cathode est constituée de l'objet (métallisé) à recouvrir ¾ La recharge des accumulateurs de voiture ou de téléphone sont des applications courantes de l'électrolyse
Niveaux: SM PC SVT Matière: chimie PROF :Zakaryae Chriki
On fait déposer une couche métallique sur des métaux tels que le fer , le cuivre, l’acier pour les protéger contre les corrosions ou les rendre plus résistant ou améliorer leur aspect L’objectif de cette partie consiste à étudier le recouvrement d’une lame de fer par une couche de nickel à l’aide de l’électrolyse
8 دحوملا ينطولا ناحتملاا ايرولاكبلل
plus de 50 de la production mondiale de zinc est obtenue par électrolyse d’une solution de sulfate de zinc acidifié par l’acide sulfurique On observe un dépôt métallique sur l’une des électrodes et le dégagement d’un gaz sur l’autre électrode données : 1 96500 F C mol 1; M g mol(Zn) 65,4 1
|
Dépôts électrochimiques de tantale ? partir d une électrolyte liquide
[PDF] Dépôts électrochimiques de tantale ? partir d 'une électrolyte liquide tel archives ouvertes tel document |
|
CORRIGE SUJET BAC S 2010 FRANCE physique - Tout pour le bac
[PDF] CORRIGE SUJET BAC S FRANCE physique Tout pour le bac toutpourlebac CORRIGE SUJET BAC S FRANCE physique chimie exo specialite electrolyse pdf |
|
spe protection du fer par électrozingage nom
[PDF] spe protection du fer par électrozingage nomtatullisab free laboratoire PE electrozingagecor pdf |
|
Ressources pour la classe de troisième - Physique et Chimie
[PDF] Ressources pour la classe de troisième Physique et Chimiespc ac amiens document d accompagnement de troisieme pdf |
|
TRAITEMENT DE SURFACE DU LAITON :
[PDF] TRAITEMENT DE SURFACE DU LAITON memoirepfe fst usmba ac ma get pdf |
|
Exercices corrigés de Spécialité Physique-Chimie Terminale S
[PDF] Exercices corrigés de Spécialité Physique Chimie Terminale S chaurand professeur Exercices%de%Spe cialite %TS pdf |
|
Electrolyse
[PDF] Electrolyse esffm fileadmin S Chapitre Electrolyse pdf |
|
Notions élémentaires sur les cellules électrochimiques - Electrochimie
[PDF] Notions élémentaires sur les cellules électrochimiques Electrochimieelectrochimie minatec grenoble inp CTDnot pdf |
|
Guide du professeur collège 3 ème - Carrapidecom
[PDF] Guide du professeur collège ème Carrapide carrapide academy telecharger infoministere guide prof col pdf |
|
recherche des mecanismes microstructuraux qui regissent les
sept Les propriétés des dépôts de chrome électrolytique Dépôts bruts de chromage réalisés sur des substrats en acier de nuance XC Si de nombreuses recherches sont effectuées sur la cristallisation des dépôts physiques Le troisième chapitre concerne les propriétés macroscopiques des |
- tp protection du fer par electrozingage
- electro zingage galvanisation
- tp corrosion et protection du fer
- protection du fer par etamage
- electrozincage d'une pièce en acier
- electrozingage industriel
- exercices électrolyse corrigés
- electrozingage de l'acier
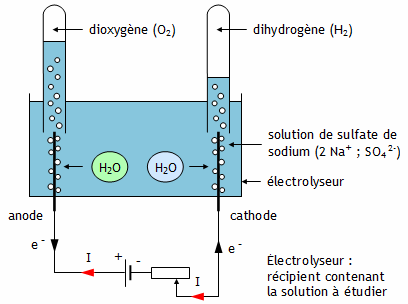
Chimie3E: Électrolyse et synthèse de l'eau
Source:https://www.editions-petiteelisabeth.fr/images/calculs/1_electrolyse_3_1.png?1475930620

Calculer le volume de dioxygène formé à l'anode et le volume de
Source:https://e.educlever.com/img/2/0/5/8/20581.gif

L'électrolyse un exemple de transformations forcées - Maxicours
Source:http://web%C3%A9ducation.com/wp-content/uploads/2020/04/Cours-electrolyse-pdf.png
Cours électrolyse bac pdf - Web Education
Source:https://upload.wikimedia.org/wikipedia/commons/f/f5/Schemas_electrolyse_h2o.svg
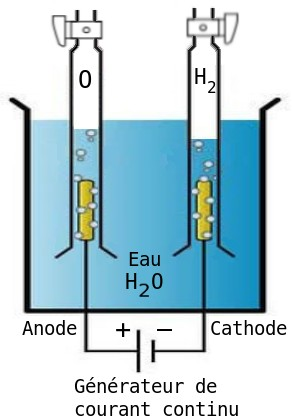
Électrochimie — Wikipédia
Source:http://s2.e-monsite.com/2010/04/11/01/resize_550_550//lectrolyse.png

46) ÉLECTROLYSE POUR MOTEUR THERMIQUE
Source:https://images-schoolmouv-cours.s3.eu-west-1.amazonaws.com/t-fnx-spc-c11-img01.png
dépouillement questionnaire excel questions ouvertes PDF Cours,Exercices ,Examens
Analyser les questions ouvertes dans les sondages - Hal
- traitement des questions ouvertes
- dépouillement question ouverte
- comment analyser les questions ouvertes
- exemple d'analyse de questionnaire
- dépouillement questionnaire question ouverte
- comment faire le dépouillement d'un questionnaire
- comment faire une analyse d un questionnaire
- interprétation des résultats d'un questionnaire
dépouillement questionnaire question ouverte PDF Cours,Exercices ,Examens
Analyser les questions ouvertes dans les sondages - Hal
- comment analyser les questions ouvertes
- exemple d'analyse de questionnaire
- comment analyser les resultats d'un questionnaire
- tableau de dépouillement statistique
- comment faire le dépouillement d'un questionnaire
- traitement des questions ouvertes
- dépouillement questionnaire sous excel gratuit
- logiciel dépouillement questionnaire gratuit
depreciation Bac +2 Comptabilité
4- Les provisions - Achamel
- plan comptable marocain pdf
- plan comptable marocain bilan
- plan comptable general marocain
- plan comptable marocain detaillé
- plan comptable marocain simplifié
- plan comptable marocain xls
- plan comptable marocain explication comptes
- plan comptable marocain excel
dépréciation des créances clients PDF Cours,Exercices ,Examens
LES DEPRECIATIONS DES CREANCES Objectif(s) : Evaluation des
- tableau creances clients
- provision pour créances douteuses fiscalité
- provision pour créance douteuse
- exercice corrigé créance douteuse
- tableau client douteux excel
- dépréciation des comptes clients actif ou passif
- tableau creance douteuse xls
- tableau des créances douteuses excel