|
Atome dhydrog`ene
3) En utilisant les notes de cours dessiner les quatre premiers niveaux d'énergie de l'atome d'hydrogène en indiquant leur nom ( ) ainsi que leur degré de |
|
Leçon – Latome dhydrogène LearnAlbertaca
L'élève pourra également calculer les niveaux d'énergie les rayons et les données relatives aux transitions et indiquer comment le modèle de Bohr explique les |
|
Chapitre 2 :Quantification de lénergie de latome dhydrogène
d'énergie m E et l'état final (n) d'énergie n E C) Diagramme des niveaux d'énergie de l'atome d'hydrogène Les états sont indexés par * N ∈ n d' |
|
Chapitre 55b – Le spectre de lhydrogène et le modèle de Bohr
atome d'hydrogène dans le niveau n (m) n : Niveau d'énergie quantifié de l'atome d'hydrogène ( N ∈ n ) 1 E : Énergie fondamentale de l'atome d'hydrogène |
|
Chapitre II Latome dhydrogène
Ainsi la composante selon z du moment cinétique de l'électron dans l'atome d'hydrogène ne peut prendre que les valeurs entières positives négatives ou nulle |
|
Niveaux dénergie de latome dhydrogène (1997)
atome d'hydrogène pour l'ioniser 3 2 Réaliser le schéma du diagramme des niveaux d'énergie de l'atome d'hydrogène en utilisant l'échelle : 1 cm pour 1 eV |
|
NIVEAUX DENERGIE DE LATOME
III Niveau d'énergie de l'atome d'hydrogène : 1 Expression de l'énergie : Les énergies de l'atome d'hydrogène sont données alors par la relation : = − |
|
Latome dhydrogène
L'atome d'hydrogène et ses niveaux d'énergie Unités caractéristiques de la physique atomique rayon de Bohr Rydberg ϵ = E/E (1ρ d2 dρ2ρ − l(l + 1) ρ2 + 2 |
|
Latome dhydrogène
niveaux s niveaux d niveaux p Niveaux d'énergie de l'atome d'hydrogène Pour une valeur donnée de l'énergie on peut avoir La dégénérescence du niveau |
Comment calculer l'énergie de l'atome d'hydrogène ?
À partir de cette description, Bohr calcula l'énergie d'un électron dans le è niveau d'énergie de l'hydrogène : E ( n ) = − 1 n 2 × 13 , 6 eV .
Pourquoi Dit-on que les niveaux d'énergie de l'atome d'hydrogène sont quantifiés ?
L'énergie ne peut prendre que certaines valeurs (à la différence des planètes et satellites): on dit qu'elle est quantifiée.
Ce sont des états liés de l'électron au noyau.
Attention, le premier niveau d'énergie (niveau fondamental) est parfois noté E0.L'hydrogène : premier de la classe
De tous les éléments chimiques, l'hydrogène est le plus léger car il possède la structure atomique la plus simple : son noyau se compose d'un unique proton et son atome ne compte qu'un électron.
Il tient donc la première place dans la classification périodique de Mendeleïev.
|
Chapitre 2 :Quantification de lénergie de latome dhydrogène
L'électron de l'atome d'hydrogène ne possède qu'un nombre limité d'états accessibles. Chaque état possède une énergie invariante (quantification des niveaux |
|
Latome dhydrogène
Les états ayant une même valeur de ont même énergie : ils sont dégénérés. On introduit le nombre quantique principal. Page 4. niveaux s niveaux d niveaux |
|
Chapitre 5.5b – Le spectre de lhydrogène et le modèle de Bohr
? Un photon est absorbé par l'atome d'hydrogène lorsque l'électron augmente de niveau d'énergie. (nombre quantique n augmente). ? Un photon est émis de l' |
|
Chapitre 2 Latome dhydrogène isolé
On obtient ainsi les orbitales atomiques 1s; 2s 2p; 3s |
|
Spectroscopie de latome dhydrogène. Vers une mesure absolue de
Oct 24 2001 maires sur le calcul des niveaux d'énergie de l'atome d'hydrog`ene. ... laser hélium-néon asservi par absorption saturée sur une raie de ... |
|
????? ??????? ???????? ??????
En 1913 Bohr élabore une théorie de structure de l'atome et montre qu'on peut associer |
|
UNIVERSITE LIBANAISE FACULTE DE GENIE
Deuxième exercice: [6 pts]: Atome d'hydrogène. A- Niveaux d'énergie. La figure ci-contre montre le diagramme énergétique de quelques niveaux. |
|
Exercice 1 (7 points) Polymères et Environnement Exercice 2 (7
L'éthène (C2H4) constitue des éléments carbone et hydrogène est l'unité utilisée carbone a 2 niveaux d'énergie et l'atome d'hydrogène a un seul niveau. |
|
Applied spectroscopy
Niveaux d'énergies selon la théorie des perturbations très similaire aux énergies des niveaux n = et n = de l'atome d'hydrogène. |
Quels sont les niveaux d'énergie d'un atome ?
Comment calculer les niveaux d énergie ?
. On a alors ?E = hf.
. Quand il passe d'un niveau A à un niveau inférieur B, l'électron va émettre un photon d'énergie égale à ?E.
Quelle est l'énergie d'ionisation de l'atome d'hydrogène ?
|
Chapitre 2 :Quantification de lénergie de latome dhydrogène
Chaque état possède une énergie invariante (quantification des niveaux d' énergie de l'hydrogène) Postulat optique : La transition entre deux états accessibles s' |
|
Hydrogénoı̈des et méthode de Slater
Un hydrogénoïde ou atome hydrogénoïde est un ion monoatomique ne Par contre, contrairement à l'hydrogène, la charge de son noyau est +Ze (où Z est le numéro L'énergie de l'électron d'un hydrogénoïde est donnée par l'expression : |
|
Cours4pdf
Atomes I Atome à deux électrons électron 2 électron 11 12 12 noyau +Ze Pour l'hydrogène, l'affinité électronique est la réaction inverse de la formation de Au contraire, les orbitales de valence ont des niveaux d'énergie proches de la |
|
Lumière et énergie - Sciences Mont Blanc
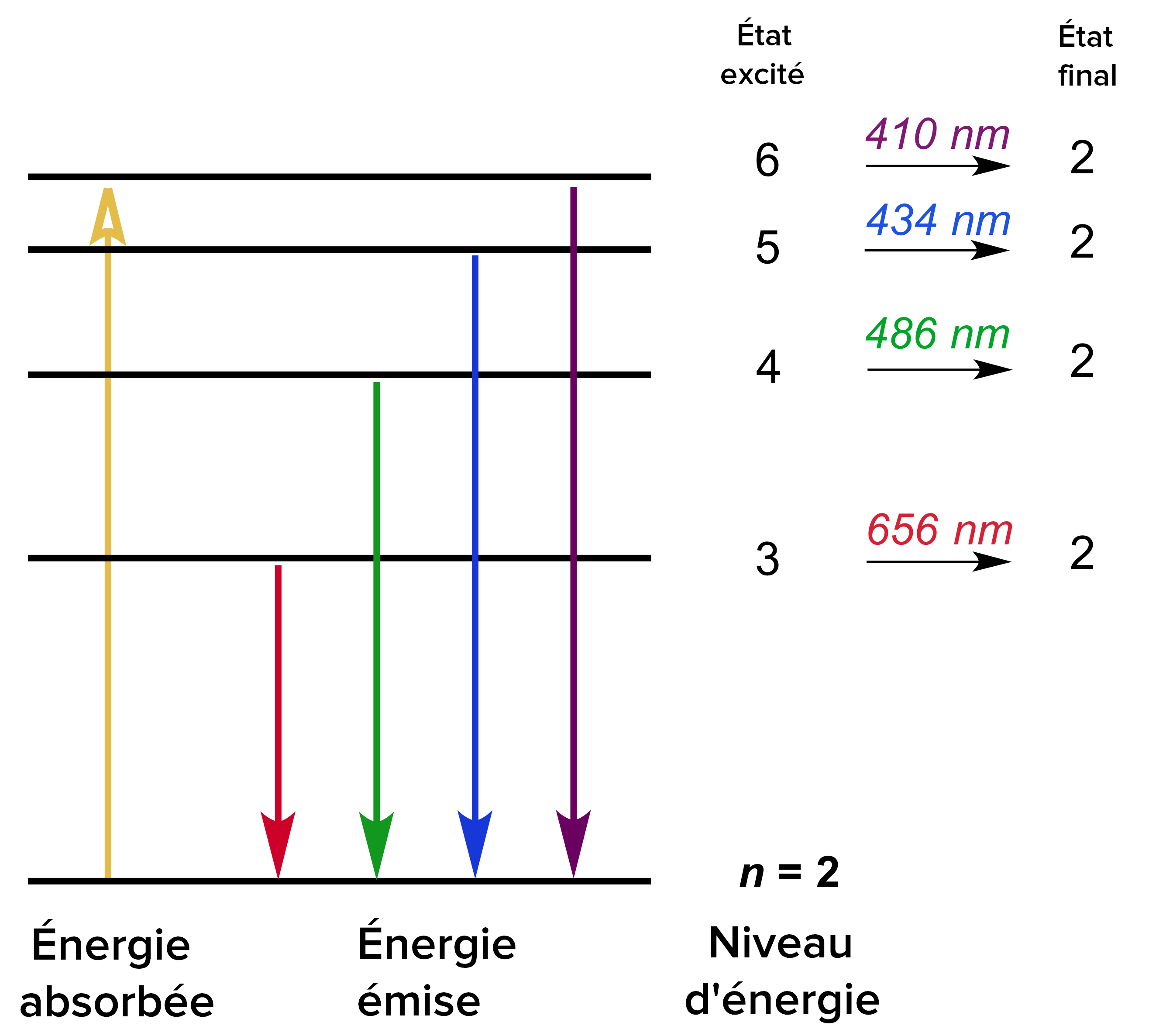
Exemple : Calculer l'énergie des photons pour une radiation de fréquence ν de 6, 00×10 14 Hz (lumière bleue) E 1) Les différents niveaux d'énergie d'un atome : Postulat: spectre de l'hydrogène à 434, 486 et 656 nm La photosphère |
|
UE 3 : Physique Fiche de cours & QCM - Tutorat Associatif Toulousain
d'atomes car sinon, sans dimension, la fraction cherchée pourrait être trouvée combustibles de fusion nucléaire (noyaux d'hydrogènes entre autres) situe sur des niveaux d'énergies discrets et quantifiés appelés couches nucléaires |
|
Exercices résolus de Chimie Physique - 3ème édition - Cours
D) Il faut une énergie infinie pour porter un électron au niveau correspondant à n ∞ Si un atome d'hydrogène dans l'état fondamental absorbe un photon de |
|
6 CO2 + 12 H2O C6H12O6 + 6 O2 + 6 H2O
Chapitre 1 : Energie et cellule vivante chloroplastes sont concentrés au niveau du parenchyme palissadique localisé à la face supérieure de la feuille ce qui |
|
ENERGIE: 13 ACTIVITÉS à FAIRE EN CLASSE - EducaPoles
Certaines énergies peuvent être stockées (pétrole, gaz, hydrogène), mais n'est pas le cas de l'électricité, atomique, est l'énergie qui lie ensemble les |
NIVEAUX D’ENERGIE DE L’ATOME
f,d III Niveau d’énergie de l’atome d’hydrogène : 1 Expression de l’énergie : Les énergies de l’atome d’hydrogène sont données alors par la relation : a d=− al dm (avec a l=jn,o pq) d∈st∗ et désigne le nombre quantique principal qui représente le numéro de la couche électronique dans laquelle se situe l’électron
CHAPITRE VII NIVEAUX DÉNERGIE DES ATOMES À N ÉLECTRONS
L'énergie de "sortie" wi correspondant à l'arrachement d'un électron à un atome, et donnée par wi = h νi est ce que l'on appelle l'énergie d'ionisation de l'atome Dans le domaine visible ou UV, l'effet photoélectrique ne se produit en général que sur l'électron le moins lié d'un atome donné : nous verrons que l'emploi de photons
Niveaux d’énergie de l’atome ------------------- Terminale S
I Niveau d’énergie d’un atome I 1 – Hypothèse de NIELS BOHR Tout atome possède de l’énergie ; mais cette énergie est quantifiée car elle ne peut prendre que certaines valeurs formant une suite discontinue Les états correspondant à ces valeurs particulières sont appelés niveaux d’énergie de l’atome
Les niveaux d’énergie - Le Site Web de Jeff OKeefe
Les niveaux d’énergie PowerPoint 8 3 La découverte des niveaux d’énergie Lorsqu’unatome est irradié avec de l’énergie, une portion de l’énergieest absorbé et puis ré-émise Si cette énergie est passée à travers un prisme et puis absorbée sur un film photographique, un spectre d’émissionpeut être
Les niveaux dénergie des atomes lourds
sont pratiquement indépendantes de l état physi-cochimique Les niveaux d énergie des atomes qui correspondent aux couches les plus extérieures, dont celles qui sont partiellement occupées, peuvent être en principe déterminés par spectroscopie optique et par spectroscopie X Leurs valeurs dépendent de l état physicochimique
41-101 Quantification de lnergie des atomes
L’énergie d’ionisation de l’atome d’hydrogène vaut donc 13,6 eV Deux méthodes pour calculer la longueur d’onde émise lors du passage du niveau 3 au niveau 2 : Application de la formule de Ritz :
Chapitre 21 Deux siècles d’énergie
a Les flèhes représentent des hangements de niveau d’énergie de l’ato me b La flèche représente l’asorption d’un photon par l’atome c La flèche représente l’émission d’un photon par l’atome d Cet atome peut émettre ou a sorer des photons dont l’énergie est E = 2,71 eV 5
L’ATOME D’HÉLIUM
d’onde de l’électrons et de l’électron excité diminue rapidement lorsque l aug- mente Parexemple,l’énergiedescongurationssd etsf est,surlagure , très similaire aux énergies des niveaux n = et n = de l’atome d’hydrogène,
Spectroscopie Electronique : Notions de base et fondamentales
Modèle de Bohr (1913) : quantification des niveaux d’énergie électroniques permettant de calculer le spectre de l’atome d’hydrogène Base du développement de la théorie quantique et de la spectroscopie Préambule
|
L atome d hydrogène - ENS-phys
[PDF] L 'atome d 'hydrogène ENS phys phys ens ~dalibard transparentsX cours pdf |
|
Diagramme énergétique de l atome d Hydrogène a) Etat ionisé et
[PDF] Diagramme énergétique de l 'atome d 'Hydrogène a) Etat ionisé et poly prepas cours%radioactivité%II%(fin) pdf |
|
Quantification de l énergie des électrons dans les atomes - Eduscol
[PDF] Quantification de l 'énergie des électrons dans les atomes Eduscoleduscol education rnchimie chi gen dossiers quant atome pdf |
|
02 Quantification de l énergie de l atome d hydrogène
[PDF] Quantification de l 'énergie de l 'atome d 'hydrogènemelusine eu syracuse immae mpsi physique chimie pdf |
|
Niveaux d energie de l atome d hydrogene - E-monsite
[PDF] Niveaux d energie de l atome d hydrogene E monsitecisse doro e monsite niveaux d energie de l atome d hydrogene pdf |
|
Leçon #8211; L atome d hydrogène - Learn Alberta
[PDF] Leçon L 'atome d 'hydrogène Learn Alberta learnalberta ca content sfp hydrogen lesson pdf |
|
Atome d hydrogène et quot;hydrogénoïdes quot;
[PDF] Atome d 'hydrogène et quot hydrogénoïdes quot liphy ujf grenoble IMG pdf chapitre pdf |
|
Spectres et niveaux d énergie - Jardin des Sciences
[PDF] Spectres et niveaux d 'énergie Jardin des Sciencesjardin sciences unistra Spectres et niveaux d e nergie pdf |
|
quantification des niveaux d énergie - Sciences Physiques ac
[PDF] quantification des niveaux d 'énergie Sciences Physiques ac physique ac orleans tours observer quantification energie pdf |
|
Physique terminale S - Lycée d Adultes
août pal Notons que si n augmente, l 'orbite de l 'électron augmente comme n Ci contre les niveaux d 'énergie de l 'atome d 'hydrogène n = re |
- exercices corrigés sur les niveaux d'énergie pdf
- spectre d'émission de l'atome d'hydrogène exercice
- energie ionisation hydrogène
- niveau d'énergie exercice corrigé
- atome d'hydrogène formule
- solution de l'equation de schrodinger pour l'atome d'hydrogene
- atome d'hydrogène quantique
- niveau d'énergie d'un atome
emc2 - Niveaux d'énergie de l'atome d'hydrogène - Emission et
Source:https://cdn.kastatic.org/ka-perseus-images/284680f3cfc3e6865da65171d8a72ccfd6c75a14.png
Modèle de Bohr de l'atome d'hydrogène (leçon)
Source: Khan Academy

File:Graphique des niveaux d'énergie d'un atome d'hydrogènejpg
Source:https://upload.wikimedia.org/wikipedia/commons/thumb/9/94/Energy_level_diagram-fr.svg/1200px-Energy_level_diagram-fr.svg.png

Niveau d'énergie — Wikipédia
Source:https://media.kartable.fr/uploads/finalImages/final_5d5d4daf4b3eb7.59929585.png

La dualité onde – corpuscule de la lumière - 1ère - Cours Physique
Source:https://www.fichier-pdf.fr/2011/12/05/10-atome-de-bohr-2/preview-10-atome-de-bohr-2-1.jpg

10 Atome de Bohr par Änder - Fichier PDF
Source:https://s1.studylibfr.com/store/data/001920710_1-24ff303fcc263b61cd1657dc2bb00aef.png
niveaux d'énergie des électrons dans un atomes
Quantification de l 'énergie des électrons dans les atomes - Eduscol
- quantification de l'énergie d'un atome 1ere s
- niveau d'énergie exercice corrigé
- niveaux d'énergie de l'atome d'hydrogène
- exercices corrigés sur les niveaux d'énergie pdf
- les niveaux d'énergie pdf
- quantification de l'énergie 1ere s
- niveau d'énergie formule
- energie ionisation hydrogène
niveaux d'intervention de la puissance publique
Science économique - mediaeduscoleducationfr - Ministère de l
- pourquoi la puissance publique intervient-elle dans la régulation des économies contemporaines
- pourquoi les pouvoirs publics interviennent-ils pour réguler les marchés
- intervention des pouvoirs publics dans l'économie
- régulations et déséquilibres macroéconomiques fiche
- puissance publique et régulation économique cours
- comment le budget de l'état permet-il d'agir sur l'économie
- la fonction d'allocation des ressources
- rôle des pouvoirs publics
niveaux de compétence linguistique canadiens
Niveaux de compétence linguistique canadiens (NCLC)
- calcul nclc tef
- comment calculer nclc tef
- nclc test
- échelle des niveaux de compétence
- nclc tef calculator
- compétence linguistique cv
- compétence linguistique définition
- nclc en ligne
niveaux de langue exercices pdf
savoir repérer les trois registres de langue (pdf)
- exercices sur les registres de langue français
- les niveaux de langue exercices pdf cm2
- cours les registres de langue pdf
- exercices registres de langue lycée
- les niveaux de langue cm1 exercices
- exercices sur les registres de langue 6eme
- les niveaux de langue pdf
- exercices langage soutenu courant familier