couple acide base soude
|
Chapitre 1 Acides et bases
Une solution aqueuse est dite : — neutre si son pH vaut 7 i e [H3O+] 7 1 = 10 mol:L (à 25 C) ; — acide si son pH est inférieur à 7 i e [H3O+] > 10 7 mol:L 1 (à 25 C) ; — basique si son pH est supérieur à 7 i e [H3O+] < 10 7 mol:L 1 (à 25 C) Quelques exemples : Acide Neutre |
|
Couples acide
Couples acide - base Objectifs : - Comment caractériser des acides et des bases en solution aqueuse ? - Introduire la notion de couple acide – base et réaction entre un acide et une base I) Etude expérimentale d'un indicateur coloré : 1) Le bleu de bromothymol : a) Expérience : |
|
ECHELLE DE P KA DES PRINCIPAUX COUPLES ACIDE BASE
Acide Perchlorique HClO 4 ClO 4- Ion Perchlorate -8 Acide Chlorhydrique HCl Cl - Ion Chlorure -7 Acide Chlorique HClO 3 ClO 3- Ion Chlorate -2 7 Acide Nitrique HNO 3 NO 3- Ion Nitrate -1 4 Ion Oxonium H3O+ H2O Eau 0 Acide Iodique HIO 3 IO 3- Ion Iodate 0 8 Acide Sulfureux H2SO 3 HSO 3- Ion Hydrogénosulfite 1 2 Acide Oxalique C2O4H2 C2O4H- Ion |
|
Fiche de révisions sur les acides et les bases
Pour les couples acide / base on définit une constante d’acidité K A [acide] [H O ][base] K 3 A + = ou [acide] [base] pH =pK A +log Conséquence: pH = - log [ H 3 O + pK A = - log K A] [ acide ] > [ base ] [ base ] > [ acide ] 1°) Solution d’acide fort (AH) de concentration molaire Ca pH =−logCa |
|
LES REACTIONS ACIDE-BASE 1 Le pH
Ces deux espèces appartiennent aux couples acide/base suivants : CH3COOH/CH3COO− et H2O/HO− On a les demi-équations acide/base suivantes : CH3COOH = CH3COO− + H+ HO− + H+ = H2O On additionne les demi-équations (1) et (2) et on obtient la réaction acide-base suivante : CH3COOH + HO− CH3COO− + H2O |
|
Semestre 2 – Chapitre 2 : Réactions acido-basiques
Une réaction acide-base est une réaction d'échange d'ion H+ entre un donneur de H+ (acide) et un accepteur d'ion H+ (base) Exemple : Écrire la réaction entre l'ammoniac et l'acide acétique puis entre l'acide phosphorique et la soude |
Quels sont les différents types de acides ?
Acide Iodhydrique HI I- Ion Iodure -10 Acide Bromhydrique HBr Br- Ion Bromure -9 Acide Sulfurique H2SO4 HSO4- Ion Hydrogénosulfate -9 Acide Perchlorique HClO4 ClO4- Ion Perchlorate -8 Acide Chlorhydrique HCl Cl- Ion Chlorure -7 Acide Chlorique HClO3 ClO3- Ion Chlorate -2.7 Acide Nitrique HNO3 NO3- Ion Nitrate -1.4
Comment calculer la constante d’acidité ?
Pour les couples acide / base, on définit une constante d’acidité K A . ou pH = [ base] = - log K A KA(CH 3 C OOH / CH 3 C OO ) = [ CH 3 C OOH] Espèces en solution : En plus de l’eau, il y a les espèces surlignées ci-dessus. (2) ] (1') et [ H 3 O + ] ≅ Ca Donc :
Comment savoir si une solution est acide ?
Le pH d’une solution est compris entre 0 et 14. Si pH < 7, la solution est acide. Si pH = 7, la solution est neutre. Si pH > 7, la solution est basique. Le pH-mètre mesure une différence de potentiel entre deux électrodes pour en déduire la valeur du pH. une électrode de référence dont le potentiel est indépendant du milieu dans lequel elle plonge.
Quelle est la différence entre un acide faible et une base faible ?
acide faible : c’est un acide dont la réaction sur l’eau n’est pas totale. base faible : c’est une base dont la réaction sur l’eau n’est pas totale. 3 4 est un acide faible ! Donc : 3 C OOH est un acide faible, l’ion C H 3 C OO est une base faible.
2- Réactions acido-basiques :
Une réaction acide-base est une réaction d'échange d'ion H+ entre un donneur de H+ (acide) et un accepteur d'ion H+ (base). Exemple : Écrire la réaction entre l'ammoniac et l'acide acétique, puis entre l'acide phosphorique et la soude. f2school.com
3- L'eau : une espèce amphotère :
Expliquer pourquoi l'eau est une espèce amphotère. Écrire la réaction acide-base associée aux couples de l'eau. Quel nom porte cet équilibre ? Quelle est la constante d'équilibre associée à cette réaction ? f2school.com
1- Méthode de la réaction prépondérante :
Positionnement du problème : On introduit une ou plusieurs espèce(s) chimique(s) ayant des propriétés acido-basiques en solution aqueuse. On chercher à connaître les concentrations de toutes les espèces à l'équilibre, en particulier celle de H3O+. Une première méthode consiste à écrire les équations liant les concentrations à l'équilibre : Une cons
IV- Solutions tampon :
Rappeler ce qu'est une solution tampon. Un solution tampon est généralement réalisée en mélangeant un acide et sa base conjuguée en proportions égales. Quel est le pH imposé par le tampon en fonction du pKa du couple utilisé ? f2school.com
Semestre 2 – Chapitre 2 : Réactions acido-basiques
Les équilibres acido-basiques s'inscrivent dans la plus vaste problématique des équilibres chimiques, abordés au premier semestre. Le phénomène d'acido-basicité est important, par exemple dans l'organisme humain où des systèmes complexes contrôlent l'acidité du sang. Les acides et les bases sont en outre importants dans l'industrie : la grande quan
Définitions :
Rappeler la définition d'un acide fort, acide faible, base forte, base faible. Acide fort : acide qui réagit totalement avec l'eau. L'espèce AH n'existe pas dans l'eau. Base forte : base qui réagit totalement avec l'eau, la base A- n'existe pas dans l'eau. Acide faible : acide qui réagit partiellement dans l'eau, l'espèce AH existe dans l'eau, la r
K b=[ BH+][HO−]
[B ]c° b=[ → K Acide][ HO−] [base] d- Rappeler l'expression du pKa, par analogie en déduire l'expression de pKB. f2school.com
1- Méthode de la réaction prépondérante :
Positionnement du problème : On introduit une ou plusieurs espèce(s) chimique(s) ayant des propriétés acido-basiques en solution aqueuse. On chercher à connaître les concentrations de toutes les espèces à l'équilibre, en particulier celle de H3O+. Une première méthode consiste à écrire les équations liant les concentrations à l'équilibre : Une cons
IV- Solutions tampon :
a- Rappeler ce qu'est une solution tampon. Une solution tampon est une solution dont le pH est peu influencé par un apport extérieur de constituants acido-basiques ou par la dilution. b- Un solution tampon est généralement réalisée en mélangeant un acide et sa base conjuguée en proportions égales. Quel est le pH imposé par le tampon en fonction du

Comment identifier les couples acide/base ? ✅ Méthode Terminale spécialité Chimie

Couple ACIDE / BASE ? 💪 Exercice Terminale spécialité Chimie

Couple ACIDE/BASE 🎯 Comment les identifier ? Terminale spécialité Chimie
|
Chapitre 1 Acides et bases
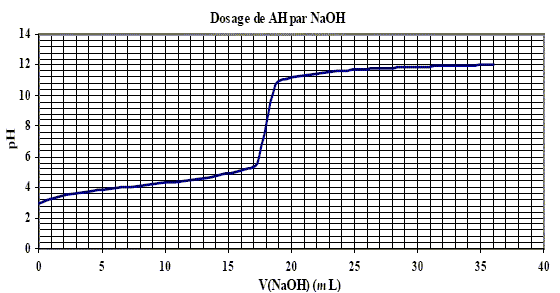
Deux espèces chimiques AH et A– forment un couple acide/base si et seulement si le dosage de l'acide acétique par la soude. |
|
TD1 : Acides et bases
Application numérique : [H3O+] = 40.10?8 mol.L?1. 2. a) La réaction qui a lieu est la dissociation de la soude dans l'eau : NaOH + |
|
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
Réaction entre une solution d'acide chlorhydrique (H3O+ + Cl–) et une solution d'hydroxyde de sodium (Na++OH–). Couples : H3O+/H2O. H2O/OH–. Page 6. 11. |
|
Chapitre 23
Uniquement entre l'acide d'un couple et la base d'un 1 - Quelles sont les formules des solutés de soude et de carbonate de sodium ? |
|
Transformations chimiques en solution aqueuse
Une espèce qui est l'acide d'un couple et la base d'un second couple est une Acide faible. Potasse. KOH. Base forte. Soude. NaOH. Base forte. Ammoniac. |
|
LES REACTIONS ACIDE-BASE 1. Le pH 1.1 Définition Le pH
couple acide/base noté : AH/A?. A ce couple acide/base est associé une demi-équation acido-basique notée : AH = A? + H+ La soude est une base forte :. |
|
PKa de divers couples acido-basiques
pKa de divers couples acido-basiques. Acide. Nom de l'acide. Base conjuguée. Nom de la base conjuguée. pKa. HClO4 acide perchlorique. |
|
Ateliers Science et Cuisine
1°S : notion de couple acide/base; réaction acidobasique et échange de proton de soude versé) lors du titrage d'un acide peu dissocié dans l'eau. |
|
Les acides et les bases - University of Ottawa
Les couples acide-base conjuguées • Exemple: Quels sont les couples acide-base conjuguées dans les réactions suivantes? (a) NH 3 (aq) + H 2 O(l) NH 4 +(aq) + OH-(aq) (b) H 3 O+(aq) + OH-(aq) 2 H 2 O(l) • Solution: (a) NH 4 +/ NH 3 est un couple acide-base conjuguée H 2 O/ OH-est un couple acide-base conjuguée (b) H 3 O+/H 2 |
|
Les couples acide-base - Maxicours
Un couple acide / base est caractérisé à la fois par K a de son acide ou par K b de sa base conjuguée HA+H 2 O A - + H 3 O + K a = [A-+ H 2 O HA+OH - K b = K a K b= x K a K b = [H3O +] x [OH-]= K e = 10-14 K a K b = K e = 10-14 -log(K a K b)= -log K e = -log(10-14) pK a + pK b = 14 [A-] [H3O+] [HA] |
|
Dosage acido-basique - Archiveorg
Il s’agit de couples (acide-faible /base faible) dont les espèces conjuguées ont des couleurs différentes Si on les note (HIn / In-) et Ki la constante d’acidité de ce couple On admet que la couleur de la solution est celle de la forme acide HIn si la concentration |
|
Les réactions acido-basiques - AlloSchool
Un indicateur coloré est un couple acide-base dont l’acide et la base ? n’ont pas la même couleur Son ?couple est noté : ? En présence de l’acide ???? la base de l’indicateur réagit selon la réaction : ?? Le mélange prend la couleur de l’espèce acide |
|
Searches related to couple acide base soude PDF
acide: espèce chimique capable de libérer un (ou plusieurs) proton (s) base: espèce chimique capable de capter un (ou plusieurs) proton (s) Attention ! solution acide ? acide Dans une solution acide : [H3 O+]>[OH ?] acide fort: c’est un acide qui réagit entièrement avec l’eau |
Quelle est la différence entre la base et l’acide conjugué ?
De même, la base HCO 3– se transforme en son acide conjugué H 2 CO 3 en gagnant un proton H + . Dans le couple acide-base NH / NH 3, l’acide est l’ion ammonium NH et la base qui lui est associée est l’ammoniac NH 3. L’acide NH se transforme en sa base conjuguée NH 3 en perdant un proton H + et inversement.
Quels sont les types de réactions de dissolution de bases et d’acides faibles ?
Exemples de réactions de dissolution de bases et d’acides faibles: • L’acide éthanoïque (CH3 COOH) est un acide faible : CH3 COOH(liq) H 2 O H3 O aq CH3 COOaq ??? + ? + ???+ • L’ammoniac est une base faible : NH3(g) H 2 O NH 4 (aq) OH (aq) ??? + ? + ???+ Remarques importantes: ¾ Puisque NH3est une base faible, l’ion + NH4est un acide faible !
Quelle est la différence entre un acide fort et une base faible ?
acide fort: c’est un acide qui réagit entièrement avec l’eau base forte: c’est une base qui réagit totalement avec l’eau acide faible: c’est un acide dont la réaction sur l’eau n’est pas totale. base faible: c’est une base dont la réaction sur l’eau n’est pas totale. Fiche de révisions sur les acides et les bases page 2
Comment écrit-On l’acide ?
On écrit toujours l’acide en premier, séparé de la base par une barre. Dans le couple acide-base H 2 CO 3 / HCO 3– , l’acide est la molécule H 2 CO 3 et la base qui lui est associée est l’ion HCO 3–. L’acide H 2 CO 3 se transforme en sa base conjuguée HCO 3– en perdant un proton H +.
| COUPLES ACIDE-BASE 1 Définitions - Free |
| Fiche de révisions sur les acides et les bases |
| Les acides et les bases - University of Ottawa |
| ECHELLE DE P KA DES PRINCIPAUX COUPLES ACIDE BASE - Sbec Company |
| Fiche de révisions sur les acides et les bases - Cortial |
| Searches related to couple acide base soude filetype:pdf |
|
Chapitre 1 Acides et bases
Deux espèces chimiques AH et A– forment un couple acide/base si et seulement si elles vérifient la le dosage de l'acide acétique par la soude Pour le |
|
TD1 : Acides et bases
Application numérique : [H3O+] = 4,0 10−8 mol L−1 2 a) La réaction qui a lieu est la dissociation de la soude dans l'eau : NaOH + |
|
SA1_PC : réactions acide-base - Chimie en PCSI
5 mai 2018 · chlorhydrique, phosphorique, acétique, de la soude, la potasse, l'ion réaction acide-base implique donc toujours deux couples acide-base |
|
Les acides et bases en solution aqueuse - Groupe Transition
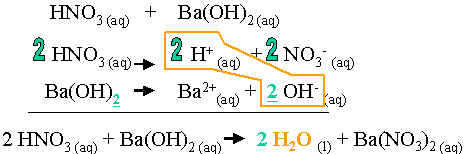
La réaction de l'acide avec la base donne lieu à la formation d'un sel et d'eau L' équation globale de mise en œuvre est donc : NaOH(aq) + HCl(aq) → NaCl(aq) + |
|
Chapitre 2 - Classe PCSI-PSI Damas
Cette définition engendre la notion de couple acide/base : à tout acide correspond une Quel est le pH de la solution sachant que la soude est une base forte ? |
|
Révisions sur les acides et les bases - Nicole Cortial
L'hydroxyde de sodium (ou soude) est une base forte : aq aq )s( HO Na HONa Pour les couples acide / base, on définit une constante d'acidité A K ] acide |
|
C1 : Acides & bases
Couple acide/base = association de deux espèces conjuguées Lorsqu'un mol· L-1, on ajoute m = 0,50 g de soude solide (NaOH, base forte) La variation de |
|
Réactions acido-basiques
ou sel Hydroxyde de sodium ou soude Hydroxyde de potassium ou potasse formule II- Passage réciproque de l'acide à la base : notion de couple 1) Mise |
|
Ch 6
2 - Écriture du couple acide AH et base A- : 3 - Exemple de couples acide/base Barrez les couples incorrects NH4 +/ NH3 |
|
Les réactions acido-basiques - Physagreg
acide (pH7) Ces solutions Ce couple sera appelé couple acide/base est sera toujours noté : HA / A Solution de soude à 1 0 mol/L |