Les piles cuivre-argent
|
Piles électrochimiques
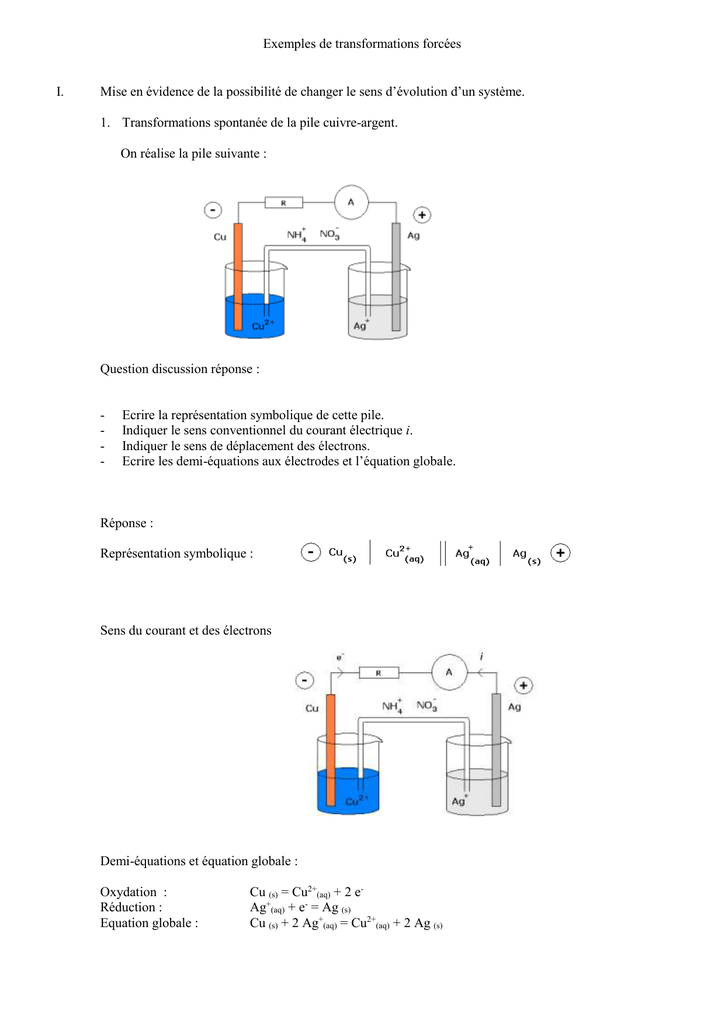
On considère une pile cuivre-argent réalisée à partir de deux lames de masse m = 1000 g Les solutions aqueuses de nitrate d'argent et de sulfate de cuivre utilisées sont des solutions de concentration apportée C = 0100 mol L-1 Leur volume individuel est V = 500 mL Données : |
|
Étude de la pile Cuivre-Argent
Étude de la pile Cuivre-Argent Doc 1 : A partir des couples oxydant/réducteur Cu 2+ (aq) / Cu (s) et Ag + (aq) / Ag (s) on peut envisager deux transformations dont les réactions peuvent être schématisées par les équations suivantes : Cu (s) ++ 2 Ag (aq) → 2 Ag (s) + Cu 2+ (aq) (1) Cu 2+ (aq) + 2 Ag (s) → 2 Ag + (aq) + Cu |
|
Chimie-TP10-les piles electrochimiques
Chimie-TP10-les_piles_electrochimiques Author: Julien Geandrot Subject: Constitution d'une pile zinc-cuivre par observation du transfert spontané d'électrons ; simulation d'une comportement électrique d'une pile : la pile argent-cuivre Created Date: 4/12/2007 12:00:00 AM |
|
Chapitre 10 : Les piles dispositifs mettant en jeu des
Connaissances et savoir-faire exigibles : Schématiser une pile ( voir TPχn°10) Utiliser le critère d’évolution spontanée pour déte rminer le sens de déplacement des porteurs de charges dans une pile (voir TPχn°10) Interpréter le fonctionnement d’une pile en disposant d’une information parmi les suivantes : sens de circulation |
|
Prof TP N°10-PROF : LES PILES ELECTROCHIMIQUES
La simulation faite avec la pile cuivre-zinc ne conduit pas à des résultats satisfaisants il est donc proposé de travailler avec la pile cuivre-argent Pour des raisons de coût une expérience collective est envisagée (un fil de 6 cm de long et de 0 5 mm de diamètre coûte environ 15 €) |
Quel est le prix d'un fil de pile ?
Pour des raisons de coût, une expérience collective est envisagée (un fil de 6 cm de long et de 0.5 mm de diamètre coûte environ 1,5 €). 2. 3. 4. Lorsque la pile débite, on épuise les réactifs et a l fém chute.
Comment interpréter le fonctionnement d'une pile ?
Interpréter le fonctionnement d’une pile en disposant d’une information parmi les suivantes : sens de circulation du courant électrique, f.é.m., réaction s aux électrodes, polarité des électrodes ou mouvement des porteurs de charges (voir TPχn°10).
Comment fonctionnent les piles ?
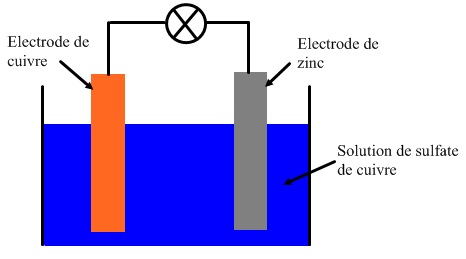
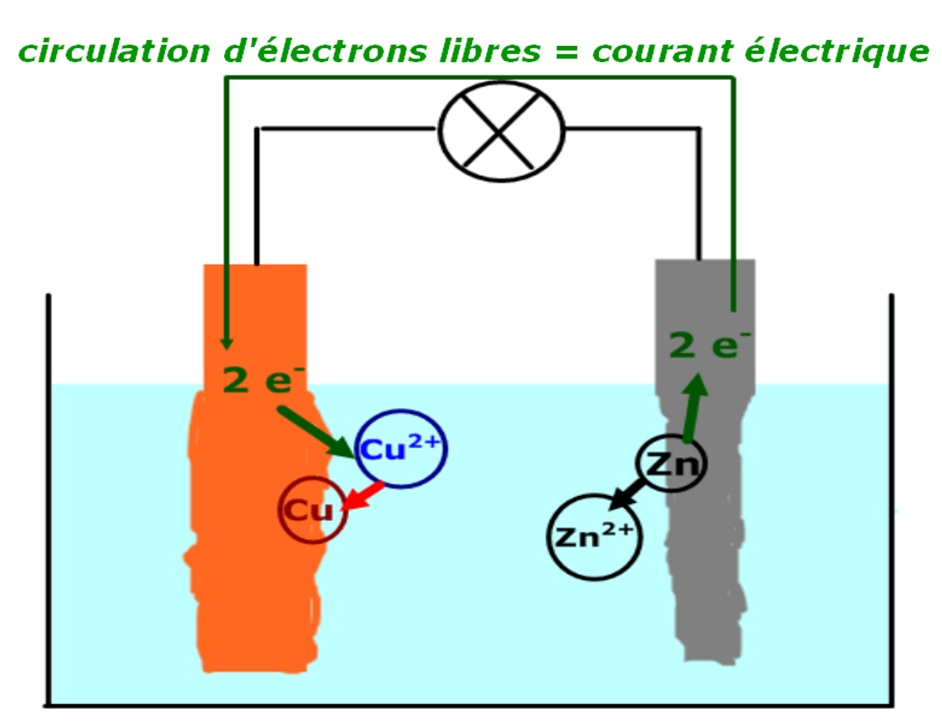
En effet, lors du fonctionnement de la pile, un transfert d'électrons entre l'anode et la cathode se fait par l'intermédiaire du circuit extérieur. Cela entraîne la consommation des réactifs, et donc l'usure de la pile. 1. Proposer un protocole expérimental permettant de réaliser une pile à partir du matériel à disposition.
Quels sont les effets de la poudre de cuivre sur la solution ?
Expérience TP : la solution dans laquelle on a ajouté la poudre de cuivre et la poudre de zinc s’est décolorée. Expérience cours : un dépôt rougeâtre apparaît sur la lame de Zinc et on observe un précipité noir dan s la solution.
|
TP N°10-PROF : LES PILES ELECTROCHIMIQUES
sous forme d'énergie électrique à l'aide d'un dispositif : la pile. ? Montrer qu'une pile délivre un courant de travailler avec la pile cuivre-argent. |
|
C6 1718_pile Cuivre Cu2+_Argent
L-1. - d'un papier imbibé solution aqueuse de nitrate de potassium pouvant constituer un pont salin. 1. Compléter le schéma de la pile réalisée ci-dessous (On |
|
TP 9 chimie : Terminale REALISATION ET ETUDE DE PILES Étude
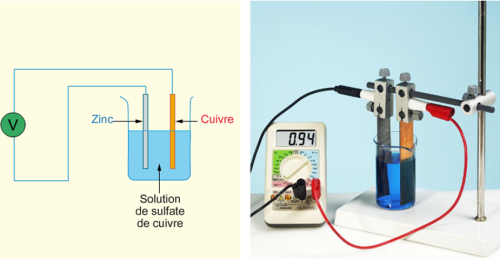
Montrer qu'une pile délivre un courant en circuit fermé. la pile.. pont salin fil d'argent fil de cuivre. 10 mL de solution à 05 mol.L-1. |
|
Ch 16 - Chimie et electricite
Recueillir et exploiter des informations sur les piles ou les accumulateurs Même question à l'électrode d'argent. ... Figure 4 : La pile Cuivre - Argent ... |
|
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
On réalise une pile cadmium-argent contenant les couples On considère une pile cuivre-argent réalisée à partir de deux lames de masse m = 1000 g. |
|
Chapitre 8: EXERCICE TYPE BAC
Constitution et étude d'une pile : 1. Voir schéma ci-contre: 2.1. Le courant circulant de l'argent vers le cuivre les électrons circulent en sens |
|
Chimie et développement durable Partie 1
et d'une électrode d'argent Ag plongée dans une solution contenant les ions argent. Pile 1 : pile constituée d'une électrode de cuivre Cu plongée dans une |
|
B) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
La plaque de cuivre qui représente le pôle positif de la pile s'appelle: la Une électrode d'argent Ag plongée dans une solution de sulfate d'argent ... |
|
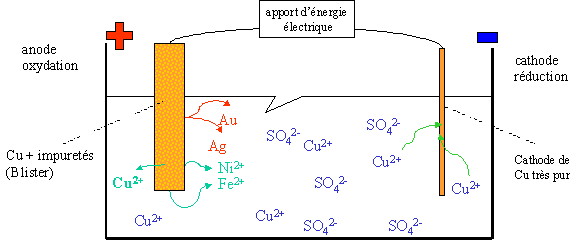
Chapitre 11 : Lélectrolyse une transformation forcée
I La pile usée : 1) Retour sur une pile déjà étudiée : ? Nous allons reprendre l'étude de la pile cuivre-argent dont on a observé le comportement dans le. |
|
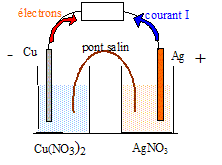
ÉTUDE DE LA PILE CUIVRE ARGENT
ÉTUDE DE LA PILE CUIVRE ARGENT. I. Transformation chimique spontanée par transfert direct d'électrons : 1. L'intensification de la coloration bleue indique |
| Étude de la pile Cuivre-Argent |
| Ch 16 - Chimie et electricite |
| ÉTUDE DE LA PILE CUIVRE ARGENT |
| PILE CUIVRE-ARGENT - WordPresscom |
| TP N°10-PROF : LES PILES ELECTROCHIMIQUES - Physagreg |
| Ex10pilespdf |
| C) Réaction aux électrodes: d) Rôle du pont salin - AlloSchool |
| Oxydo-réduction et Piles électrochimiques SMPC2 fsr 2015 |
| I Principes de piles galvaniques |
| Les piles et l'oxydo-réduction : |
| Chapitre 8: EXERCICE TYPE BAC - fredpeurierecom |
Quels sont les trois éléments essentiels qui constituent une pile ?
Où se passe l'oxydation dans une pile ?
. Elle est généralement composée de zinc.
. Une réaction d'oxydation se produit au niveau de cette borne : elle fournit les électrons.
Comment fonctionne une pile chimie ?
. Elles sont reliées au circuit électrique, par lesquelles entre ou sort le courant électrique.
. L'électrolyte est une solution aqueuse conductrice qui permet la circulation des ions.
C'est quoi une pile électrochimique ?
. Elle permet la conversion de l'énergie chimique en une autre forme d'énergie.
|
ÉTUDE DE LA PILE CUIVRE ARGENT
ÉTUDE DE LA PILE CUIVRE ARGENT I Transformation chimique spontanée par transfert direct d'électrons : 1 L'intensification de la coloration bleue indique |
|
C6 1718_pile Cuivre Cu2+_Argent - chimphys
La solution aqueuse de sulfate de cuivre est cyan, celle de nitrate d'argent incolore B – Constitution et fonctionnement de la pile cuivre-argent en circuit fermé |
|
6 Fabrication dune pile cuivre-argent
BAC 282 6 Fabrication d'une pile cuivre-argent La tension à vide d'une pile dépend fortement des espèces chimiques mises en jeu dans les demi-équations |
|
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
On considère une pile cuivre-argent réalisée à partir de deux lames de masse m = 10,00 g Les solutions aqueuses de nitrate d'argent et de sulfate de cuivre |
|
TP N°10-PROF : LES PILES ELECTROCHIMIQUES - Physagreg
Montrer qu'une pile délivre un courant en circuit fermé Utiliser le critère d' évolution de travailler avec la pile cuivre-argent Pour des raisons de coût, une |
|
Ch 16 - Chimie et electricite
Recueillir et exploiter des informations sur les piles ou les accumulateurs solution incolore de nitrate d'argent (Figure 1) Figure 4 : La pile Cuivre - Argent |
|
Examen du 12 décembre 2008 2 heures - lutesupmcfr
12 déc 2008 · L de solution de sulfate de cuivre CuSO4 de concentration 1,0 10 -2 mol L -1 Donner la demi-équation redox associée à la demi-pile A et donner l'expression L d'une solution de nitrate d'argent AgNO3 de concentration |
|
Corrigé de lexamen du 13 décembre 2007 2 heures - lutesupmcfr
13 déc 2007 · de cuivre entre la pile initiale et la pile usée ? Donner l'équation de réaction associée à la constante de solubilité de l'acétate d'argent |
|
Les piles
cher un fil de cuivre et un fil d'argent bien déca- pés EX2 1) Ecrire l'équation d' oxydoréduction modélisant le fonctionnement d'une pile plomb-argent 2) Faire |
|
Piles et oxydoréduction Exercice - Lycée Ismael Dauphin
-(aq), de concentration molaire en ions argent c = 0,20 mol L-1 On immerge partiellement un fil de cuivre La masse de la partie immergée est égale à m = 0, 52 |