liaison de van der waals pdf
|
Lecture 10 The Dispersion Force and van der Waals Interaction
THE DISPERSION FORCE AND VAN DER WAALS INTERACTION References Israelachvili J N Intermolecular and surface forces eng Third edition; Elsevier Aca-demic Press: Amsterdam 2011 McLachlan A D Proc R Soc Lond A 1963 271 387–401 |
|
Lecture 15 The van der Waals Gas (Ch 5)
The van der Waals Gas (Ch 5) The simplest model of a liquid-gas phase transition - the van der Waals model of “real” gases – grasps some essential features of this phase transformation (Note that there is no such transformation in the ideal gas model) |
How do van der Waals forces work?
Van der Waals forces are driven by induced electrical interactions between two or more atoms or molecules that are very close to each other. Van der Waals interaction is the weakest of all intermolecular attractions between molecules. However, with a lot of Van der Waals forces interacting between two objects, the interaction can be very strong.
What are the forms of Van der Waals interaction between two semi-infinite media?
Forms of the van der Waals interaction between two semi-infinite media P.1.a.1. Exact, Lifshitz P.1.a.2. Hamaker form P.1.a.3. Nonretarded, separations approaching contact, l 0,rn 0 P.1.a.4. Nonretarded, small differences in permittivity P.1.a.5.
What is the van der Waals gas model?
The van der Waals Gas (Ch. 5) The simplest model of a liquid-gas phase transition - the van der Waals model of “real” gases – grasps some essential features of this phase transformation. (Note that there is no such transformation in the ideal gas model). This will be our attempt to take intermolecular interactions into account.
What is van der Waals theory?
This is a strategy intended to defeat the fear that stops many who need to use the theory of van der Waals forces from taking advantage of progress over the past 50 or 60 years. Many excellent physically sophisticated texts already exist, but they remain inacces-sible to too many potential users.
A) Généralités
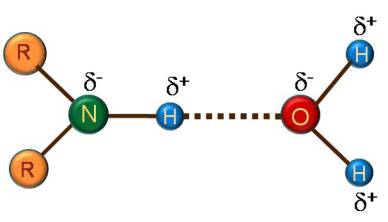
Liaison de Van Der Waals : d’origine électrostatique, correspondant à des interactions attractives entre atomes ou molécules (les interactions du type ion-dipôle ne font pas partie de ce type d’interaction). Il existe 3 types d’interactions de Van Der Waals, décrites ci-dessous. cahier-de-prepa.fr
1) Force d’orientation ou interaction de Keesom
Interaction dipôle permanent- dipôle permanent : Les molécules polaires modifient mutuellement leurs orientations et tendent à aligner leurs dipôles. cahier-de-prepa.fr
Interaction dipôle permanent- dipôle induit :
Les molécules polaires possèdent des dipôles permanents qui peuvent, en modifiant la répartition des charges, créer des dipôles (appelés dipôles induits) dans des molécules initialement apolaires mais polarisables (la polarisabilité augmentant avec la taille du nuage électronique). cahier-de-prepa.fr
Interaction dipôle instantané- dipôle instantané ou dipôle instantané- dipôle instantané induit :
Les électrons sont en perpétuel mouvement autour des noyaux des atomes des molécules, ce qui fait qu’une molécule même apolaire présente à tout instant un moment dipolaire non nul (appelé dipôle instantané). Cependant, la valeur et l’orientation dans le temps de ces dipôles étant aléatoires, le moment dipolaire total d’une molécule apolaire est en
Etat physique des halogènes à température ambiante :
Difluor et dichlore gazeux, dibrome liquide et diiode solide (Températures de fusion et d’ébullition augmentant avec les masses molaires). Température d’ébullition des alcanes augmentant avec leur masse molaire. cahier-de-prepa.fr
2) Miscibilité de solutions
Les particules pour lesquelles l’effet London est majoritaire et celles pour lesquelles l’effet Keesom est majoritaire ont tendance à se regrouper entre elles dans un mélange, et ne seront donc que cahier-de-prepa.fr

The van der Waals equation Khan Academy

Van Der Waals Forces

Real gases and the van der Waals equation Physical Processes MCAT Khan Academy
|
Les transformations de la matière - Chimie en PCSI
III Les interactions de Van der Waals Dans une molécule la cohésion des atomes de la molécule est assurée par les liaisons covalentes |
|
LES FORCES INTERMOLECULAIRES
Grâce à cette échelle on peut prédire le type de liaison présent dans une ces forces sont désignées sous le nom générique de forces de Van der Waals |
|
Les Etats de la matière - Fenelec
a - La liaison hydrogène b - Forces de Van der Waals 2 - Forces de répulsion intermoléculaires 3 - Forces intramoléculaires III - Agitation thermique |
|
Forces intermoléculaires
car les deux liaisons sont identiques (mêmes différences d'électronégativité) Leur somme vectorielle est donc nulle Forces de Van der Waals |
|
Les différents types de liaisons et leur influence sur les structures
quantique (liaisons covalente et métallique liaisons de type Van der Waals/London) Ainsi la liaison covalente peut être vue comme le partage de deux |
|
Les liaisons faibles
Les liaisons faibles année 2015-2016 S Falcou 2 2- La liaison de Van der Waals e- Les trois termes attractifs Interactions de type électrostatique : |
|
Van der Waals SIS 2014 - ENS
Part I) An introduction to van der Waals interaction We consider two atoms 2) Deduce that the interaction energy between two permanent dipoles |
|
Les interactions de faible énergie - UNF3S
Interactions de Van der Waals Chapitre 5 Les interactions de faible énergie III Liaison hydrogène I Interactions électrostatiques |
| Les transformations de la matière - Chimie en PCSI |
| Fiche Van der Waals / Liaison hydrogène - Créer son blog |
| Les différents types de liaisons et leur influence sur les structures |
| Solide moléculaire Interaction de Van der Waals liaison hydrogène |
| Les liaisons faibles |
| 1) Liaisons intermoléculaires - Prophychi |
| LES FORCES INTERMOLECULAIRES |
| Forces intermoléculaires |
| CHAPITRE V : LES LIAISONS CHIMIQUES |
| Les interactions intermoléculaires |
| The van der Waals interaction - University of Cambridge |
| Van Der Waals Interactions - Chemistry LibreTexts |
Définition: Qu’est-ce qu’une Liaison de Van Der Waals ?
Il s’agit d’une liaison de type intermoléculaire qui s’exerce entre les molécules d’une substance (contrairement aux liaisons de covalencequi sont des liaisons intramoléculaires car elles s’établissent entre les atomes d’une même molécule). Cette liaison est plus précisément une interaction électrique de faible intensité qui s’exerce entre les molé...
rôles Des Liaisons de Van Der Waals
Elles sont en général à l’origine de la cohésion des solidesmoléculaires, les interactions globalement attractives imposent une place fixe à chaque molécule. Elles peuvent aussi influencer la structure de ces solidespar le biais d’une contrainte principale: lors de la solidification, les molécules polarisées s’orientent de manière à ce que les pôle...
Quelles Molécules établissent Des Liaisons de Van Der Waals ?
Les liaisons de Van der Waals peuvent s’établir entre les molécules d’un corps lorsque ces dernières sont polaires. Ces molécules sont caractérisées par un moment dipolaire non nul qui résulte de l’addition des moments dipolaires associés aux différentes liaisons polarisées. Cependant les molécules dîtes apolairepossèdent aussi un moment dipolaire ...
Comparaison Des Liaisons de Van Der Waals Aux Autres Liaisons
Les liaisons de Van der Waals sont: 1. nettement plus faibles que les liaisons covalentes et que les liaisons ioniques 2. en général légèrement plus faible que les liaisons hydrogène. Les liaisons de Van der Waals entre dipôles permanents sont par ailleurs nettement plus fortes que celles entre dipôles instantanés.
Liaisons de Van Der Waals Entre dipôles Permanents
Ce sont des interactions électriques globalement attractives entre les dipôles électriques permanents que constituent les molécules polaires. Leur intensité dépend directement de la polarisation des molécules : Plus la molécule est polaire(plus moment dipolaire est élevé) et plus les liaisons de Van der Waals sont fortes. En l’absence de liaisons i...
Quelles sont les liaisons de Van der Waals ?
Comment reconnaître une interaction de van der Waals ?
. Lorsque la différence d'électronégativité est inférieure à 1,8, la liaison a plutôt tendance à être covalente.
What is van der Waals interaction?
- Van Der Waals Interactions. Van der Waals forces are driven by induced electrical interactions between two or more atoms or molecules that are very close to each other. Van der Waals interaction is the weakest of all intermolecular attractions between molecules.
What is the weakness of Van der Waals forces?
- Van der Waals forces are driven by induced electrical interactions between two or more atoms or molecules that are very close to each other. Van der Waals interaction is the weakest of all intermolecular attractions between molecules. Here is a chart to compare the relative weakness of Van der Waals forces to other intermolecular attractions.
What is the origin of Van der Waals force?
- Van der Waals force. It can be shown that van der Waals forces are of the same origin as that of the Casimir effect, arising from quantum interactions with the zero-point field. The term "van der Waals forces" is also sometimes used loosely as a synonym for the totality of intermolecular forces.
Are van der Waals forces independent of temperature?
- Van der Waals forces are independent of temperature except for dipole – dipole interactions. In low molecular weight alcohols, the hydrogen-bonding properties of their polar hydroxyl group dominate other weaker Van der Waals interactions.
|
III Les interactions de Van der Waals - Chimie en PCSI
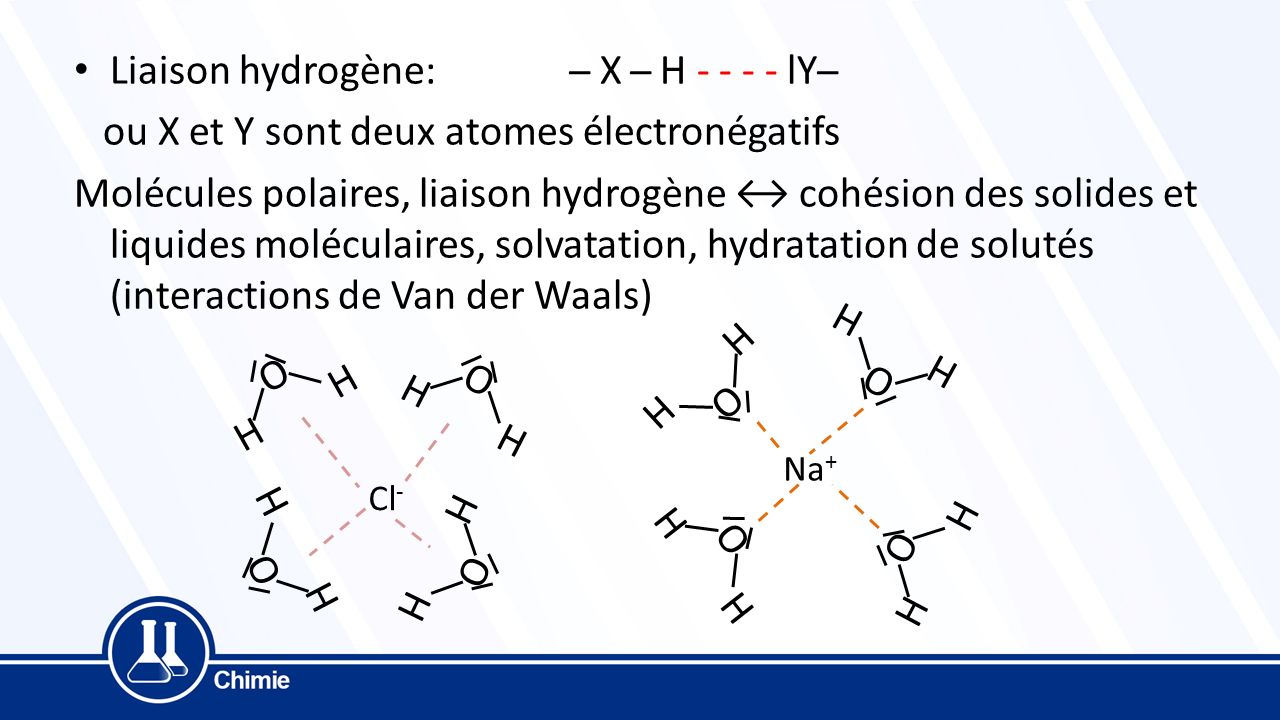
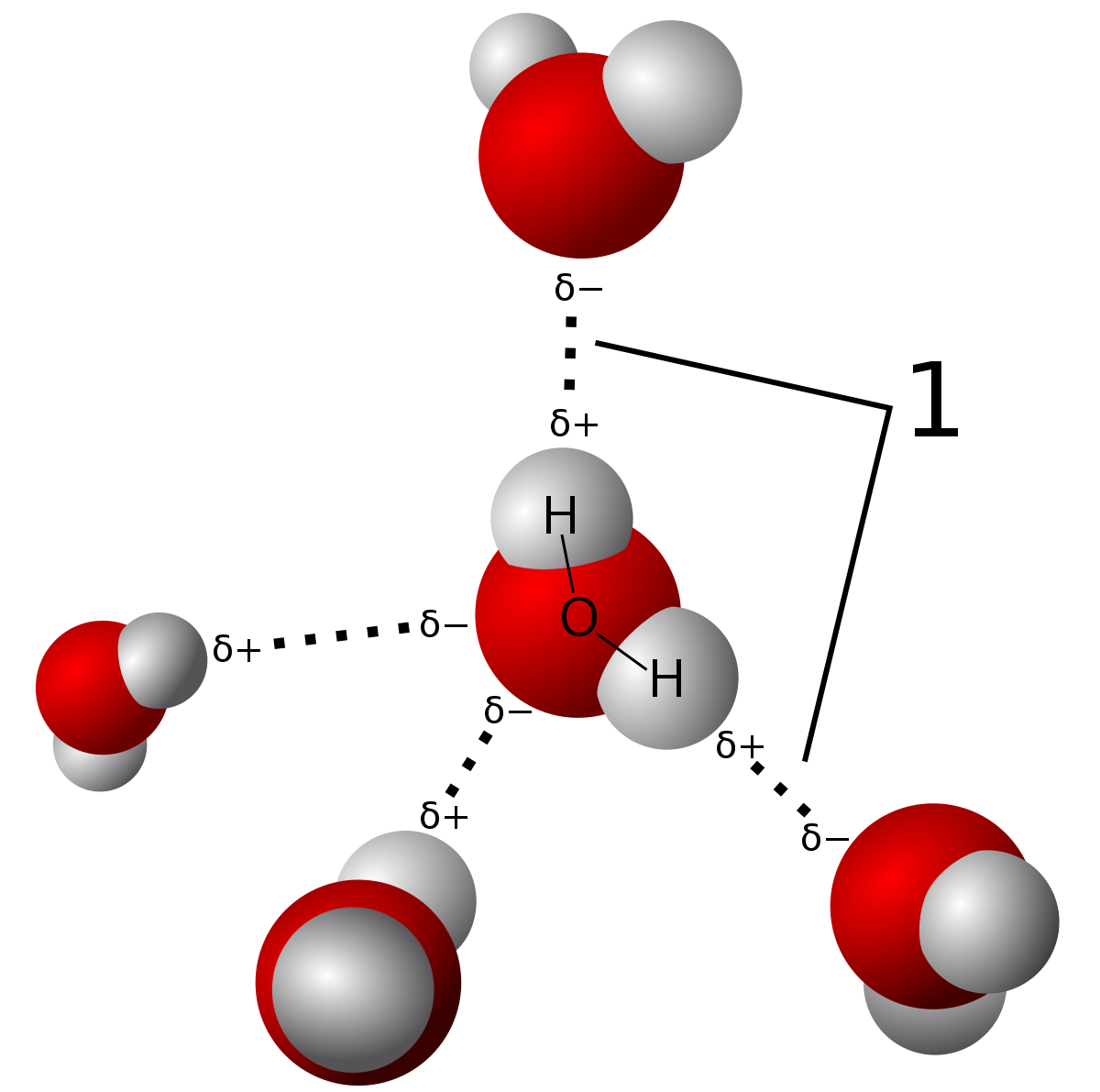
Une autre interaction expliquant entr'autres les températures de changement d' état de l'eau anormalement élevées sera aussi étudiée : la liaison hydrogène C' |
|
Les interactions de faible énergie - UNF3S
Interactions de Van der Waals Chapitre 5 Les interactions de faible énergie III Liaison hydrogène I Interactions électrostatiques IV Hydrophilie / |
|
Forces intermoléculaires
même norme, car les deux liaisons sont identiques (mêmes différences d' électronégativité) Leur somme vectorielle est donc nulle Forces de Van der Waals |
|
Les liaisons faibles
e- Les trois termes attractifs Interactions de type électrostatique : On peut décrire la liaison de Van der Waals de manière électrostatique On peut considérer qu |
|
L I A I S O N S I N T E R M O L E C U L A I R E S
Liaison de Van Der Waals Interaction entre molécules polaires - dipôles permanents ( 5 25 kJ mol-1 ) Interaction entre molécule polaire et molécule non |
|
Les interactions faibles
1 − Interactions ions - dipôle 2 − Interactions de Van der Waals : interactions dipôle - dipôle 3 − Liaison Hydrogène 4 – Exemple |
|
Fiche professeur - Académie dOrléans-Tours
Activité 2 : Le modèle : les interactions de Van der Waals (30 min) PARTIE 1 Mots clés de recherche : solide moléculaire, Van der Waals, liaison hydrogène |
|
Les interactions intermoléculaires
Interacfions répulsives (Pauli) Energie potenfielle intermoléculaire et liaison de van der Waals Conséquences sur les propriétés macroscopiques V – Liaison |
|
Liaisons intermoléculaires - Prophychi
Deux corps chargés sont soumis à une interaction électrique ATTRACTIVE si leurs charges sont de signes V 1) Liaison de Van der Waals Ces liaisons de |
|
Cours à compléter - Étienne Thibierge
27 nov 2017 · Figure 1 – Interaction entre un dipôle et une charge ponctuelle b) Interactions de van der Waals entre dipôles permanents (Keesom) Le |