Liaisons covalentes, doublets non liants, formule de Lewis
|
Chapitre 8 : Les molécules
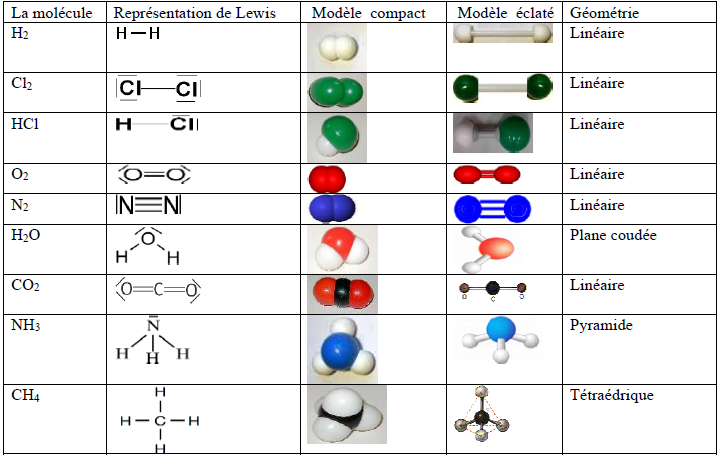
La formule développée qui fera apparaître toutes les liaisons covalentes présentes dans la molécule ainsi que les doublets non liants (voir représentation de Lewis) La formule semi-développée qui ne représentera pas les liaisons covalentes concernant les atomes d’hydrogène ni les doublets non liants |
|
La liaison chimique I: la liaison covalente
les atomes réagissent ensemble pour former des molécules afin d’arriver à une configuration électronique plus stable les électrons de valence nous intéressent le plus car ce sont les électrons de valence qui se font partagés entre deux atomes dans une liaison covalente la notation de Lewis est la représentation d’un élément par son symbole entouré |
|
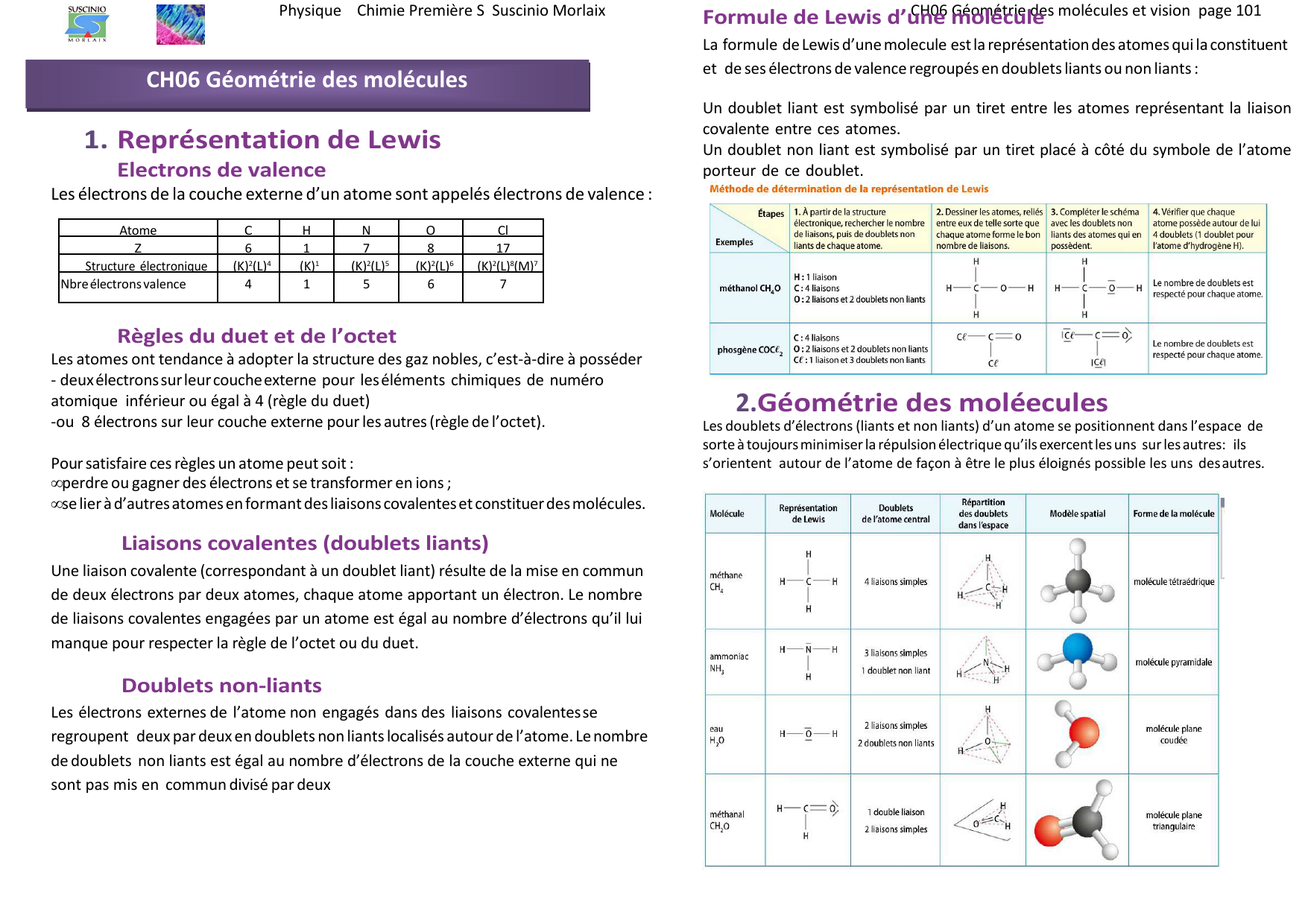
Structure électronique des molécules : Le modèle de Lewis
3 doublets non liants Liaisons multiples : N N à N N à N 2 3 paires liantes = 1 liaison triple 2 doublets non liants O O à O O à O 2 2 paires liantes = 1 liaison double 4 doublets non liants H C N à H–C N à HCN 4 paires liantes (1 liaison triple + 1 liaison |
|
Chapitre4 : La liaison chimique
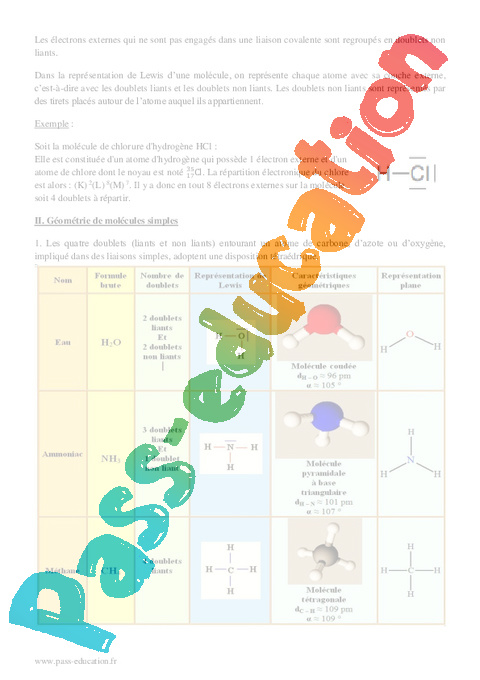
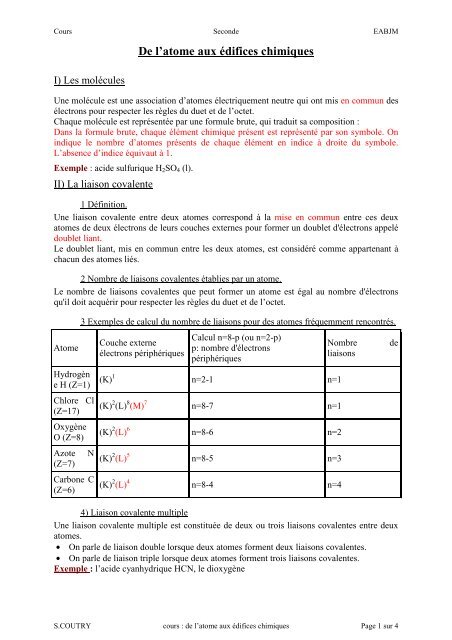
CHAPITRE 4 LA LIAISON CHIMIQUE II FORMULES DE LEWIS Notation ‚ Doublets liants : On fait un trait entre les deux atomes A ´B ‚ Doublets non liants : ˛ 0 électrons dans l’orbite moléculaire ˛ b 1 électrons dans l’orbite moléculaire ˛ 2 électrons dans l’orbite moléculaire Exemples ‚ H2O; H O H ‚ Molécule d’ammoniac |
Qu'est-ce que la liaison covalente ?
l'existence de liaisons. Au début des années 1920, Gilbert Newton Lewis propose un modèle de liaison faisant intervenir les électrons de valence (les plus externes) des atomes. Dans ce modèle, la liaison covalente résulte du partage de deux électrons de valence par les atomes qui se lient.
Qu'est-ce que la représentation de Lewis d'une molécule ?
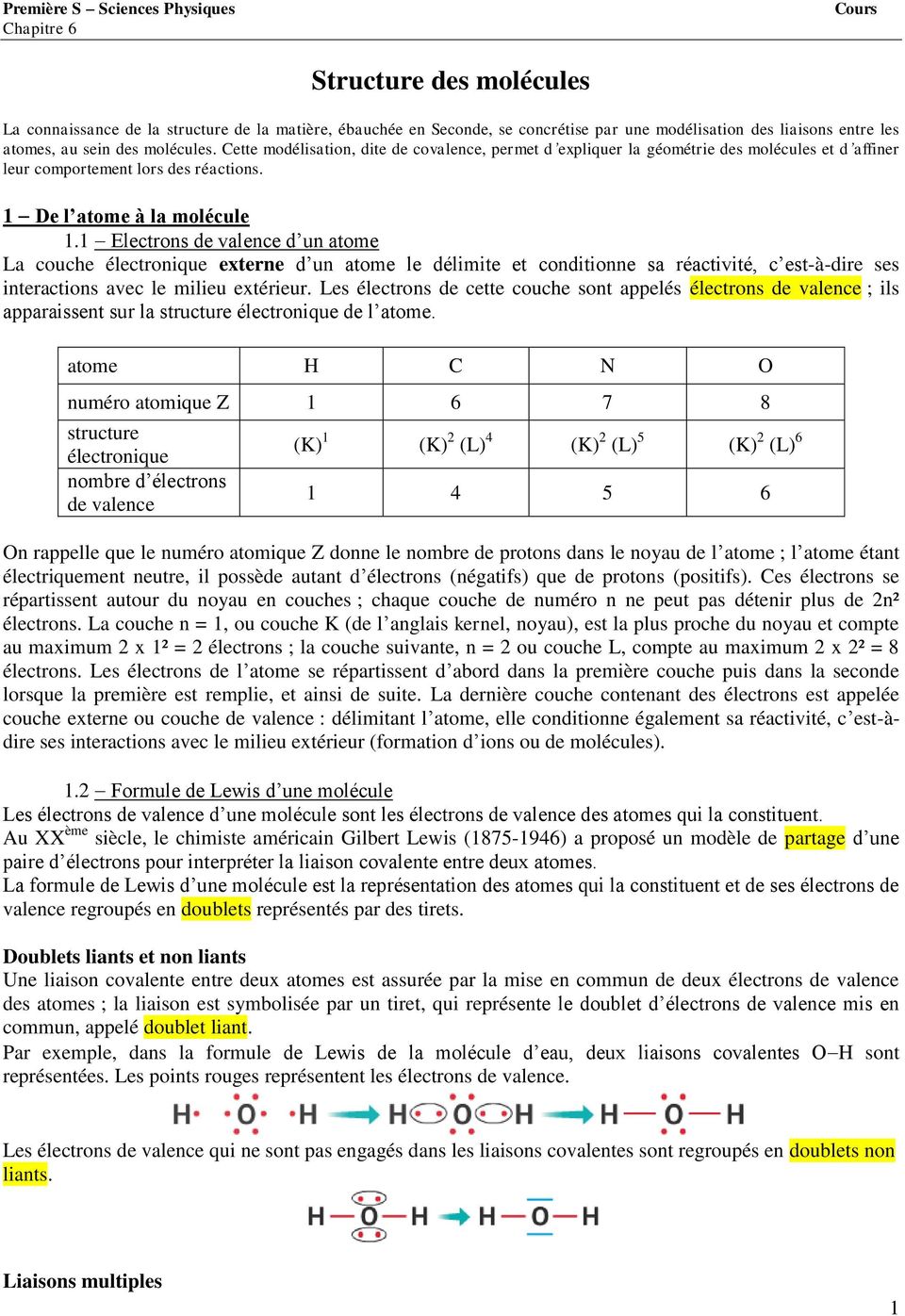
La représentation de Lewis d’une molécule fait apparaitre tous les atomes de la molécule ainsi que tous les doublets liants (liaisons covalentes) et non liants s’il y en a. Dans ce modèle, chaque liaison covalente (doublet d’électrons liants) est représentée par un trait simple horizontal ou vertical.
Quels sont les doublets non liants d’un atome ?
Dans une molécule, les doublets non liants d’un atome se positionnent de façon à être le plus éloigné les uns des autres. 2 doublets non liants = 4 électrons. 1 doublet liant = 2 électrons. Un atome de carbone est lié à deux atomes d’oxygène par des doubles liaisons covalentes. 2 doublets non liants = 4 électrons.
Quelle est la différence entre 2 doublets liants et non liants ?
2 doublets non liants = 4 électrons. 1 doublet liant = 2 électrons. Un atome de carbone est lié à deux atomes d’oxygène par des doubles liaisons covalentes. 2 doublets non liants = 4 électrons. 4 doublets liants = 8 électrons. 1 doublet non liant = 2 électrons.
La notation de Lewis
les atomes réagissent ensemble pour former des molécules afin d’arriver à une configuration électronique plus stable les électrons de valence nous intéressent le plus car ce sont les électrons de valence qui se font partagés entre deux atomes dans une liaison covalente la notation de Lewis est la représentation d’un élément par son symbole entouré
La liaison covalente
une liaison covalente est une liaison dans laquelle deux électrons sont partagés par deux atomes dans une liaison covalente, chaque électron du doublet partagé est attiré par les noyaux des deux atomes ces attractions aident à maintenir les deux atomes ensemble seulement les électrons de valence participent aux liaisons covalentes mysite.science.uottawa.ca
La structure de Lewis
les électrons qui ne participent pas à la formation d’une liaison covalente sont appellés des électrons non-liants ou des doublets libres une structure de Lewis est une représentation des liaisons covalentes par la notation de Lewis où les doublets liants sont illustrés par de petits traits ou par des paires de points entre deux atomes et les doubl
La règle de l’octet
Lewis a proposé que tout atome, sauf l’hydrogène, a tendance à former des liaisons jusqu’à ce qu’il soit entouré de huit électrons de valence ceci est la règle de l’octet l’hydrogène doit posséder deux électrons au-delà de la deuxième période (Li à F), on verra des exceptions à la règle de l’octet dues à la disponibilité des orbitales d dans la mêm
Liaisons multiples
si deux atomes partagent un doublet d’électrons, ils forment une liaison simple si deux atomes partagent deux doublets d’électrons, ils forment une liaison double si deux atomes partagent trois doublets d’électrons, ils forment une liaison triple pour une paire donnée d’atomes, les liaisons triples sont plus courtes et plus stables que les liaisons
L’électronégativité
l’électronégativité est la tendance qu’a un atome à attirer vers lui les électrons dans une liaison chimique l’électronégativité est une valeur relative, et donc sans unité plus l’électronégativité d’un élément est élevée, plus cet élément a tendance à attirer des électrons un élément qui a une affinité électronique forte et une énergie d’ionisatio
La charge formelle et les structures de Lewis
pour un atome isolé, le nombre d’électrons qui lui sont associés correspond au nombre d’électrons de valence qu’il possède dans une molécule, un atome possède les deux électrons dans chaque doublet libre qu’il possède, mais pour les doublets liants qui sont partagés entre deux atomes, un atome possède seulement la moitié du doublet liant la charge
Le concept de résonance
si on regarde, par exemple, une molécule comme l’ozone, O3, on a deux structures de Lewis différentes, mais équivalentes chaque structure de Lewis prédit que l’ozone a une liaison double O=O et une liaison simple O-O cependant, on constate expérimentalement que les deux liaisons O-O dans l’ozone sont équivalentes (même longueur, même force) en réal
Les exceptions à la règle de l’octet: les molécules à nombre impair d’électrons
certaines molécules contiennent un nombre impair d’électrons ces molécules sont des radicals libres et sont typiquement très réactives avec un nombre impair d’électrons, il est impossible d’obéir la règle de l’octet des exemples de telles molécules sont l’oxyde d’azote: le dioxyde d’azote: l’anion superoxyde: mysite.science.uottawa.ca
Les exceptions à la règle de l’octet: l’octet étendu
si l’atome central est de la troisième période (ou même plus bas dans le tableau périodique), les orbitales d de l’atome central peuvent participer aux liaisons covalentes ces orbitales d permettent à l’atome central d’accomoder plus de huit électrons, soit un octet étendu N.B. même si un atome peut avoir un octet étendu, il peut toujours choisir d
|
1 Théorie de Lewis
liaisons covalentes multiples : O2. O + O. ??. O O. Les traits sur les atomes O comme dans. O ou dans O sont des doublets non liants : ce sont des paires |
|
Chap VI Structure et géométrie des molécules
2- Liaisons covalentes et doublets non liants. ? Définition: Une liaison covalente Exemples de formule de Lewis pour des atomes fréquemment rencontrés. |
|
CH4 NH3 H2O H2O2 HCN CH5N
2 atomes voisins : structure linéaire ou coudée. Pour un atome ayant trois liaisons covalentes soit il possède un doublet non liant et la structure sera alors. |
|
Cours 1S changement de couleur et réactions chimiques
Exemple : la molécule d'ammoniaque de formule brute NH3 à pour représentation de Lewis : Elle comporte 3 liaisons covalentes donc 3 doublets liants et un |
|
EXERCICE RÉSOLU 2 - Composés soufrés et odorants
Combien établit?il de liaisons covalentes avec ses voisins ? 3. Combien possède?t?il de doublets non liants ? Représenter sa formule de Lewis. |
|
EXERCICES RATTRAPAGE SECONDE EXERCICES
Liaisons covalentes. (règle octet et duet). 0. 2. 1. 0. 4. 0. Ex 19 – Prévoir le nombre de doublets non liants. La formule semi-développée de la molécule de |
|
4) Lacunes électroniques Certains atomes ou ions nont néanmoins
une liaison covalente avec le doublet non liant d'un autre atome. On dit que ce sont des acides de Lewis. II) Représentation des molécules. 1) Les formules |
|
Chapitre 3 41 Azote et fluor 1. a. Latome dazote établit trois liaisons
L'atome de fluor comme l'atome de chlore |
|
Chapitre 8 : Les molécules
molécule ainsi que les doublets non liants (voir représentation de Lewis). •. La formule semi-développée qui ne représentera pas les liaisons covalentes |
|
Structures de lewis.pdf
Les traits peuvent être localisés sur un atome (doublet libre ou non liant) ou entre les atomes (doublet liant liaison covalente). Pour écrire la structure de |
| Schéma de Lewis |
| LES MOLECULES: REPRESENTATION CORRECTION |
| Chapitre 4 :La liaison chimique - Melusine |
| La liaison covalente - La chimie |
| Chapitre 8 : Les molécules - Physagreg |
| Chapitre 6 : des atomes aux molécules |
| B A — B Atome C N O F Cl H Doublets liants Nombre de doublets |
| Les différents types de liaisons et leur influence sur les structures |
| Fiche 2: Représentation de Lewis des espèces chimiques |
Comment savoir si un doublet est liant ou non liant dans une formule de Lewis ?
. Note : Seuls les électrons de la couche électronique la plus externe peuvent former des liaisons.
Comment trouver la formule de Lewis ?
. L'hydrogène sera entouré de 1 doublet (2 électrons).
Comment calculer la liaison covalente ?
Qu'est-ce que les doublets non liants ?
- Ce sont eux qui assurent les liaisons entre les atomes. • Les doublets non liants sont les paires d'électrons qui ne servent pas de liaisons entre deux atomes. • La représentation de Lewis d'une molécule fait apparaître tous les atomes de la molécule ainsi que tous les doublets liants et non liants le cas échéant.
Comment trouver le nombre de doublets liant d’un atome ?
- Pour trouver le nombre de doublets liant d’un atome on peut suivre la méthode suivante : trouver le nombre d’ électrons « n e » sur la couche de valence (par exemple en déterminant la configuration électronique) déterminer le nombre « n l » de liaisons covalentes établies par l’atome (en utilisant les règles de stabilité chimique)
Pourquoi les liaisons covalentes sont-elles importantes?
- Les liaisons covalentes sont particulièrement importantes puisque la plupart des molécules de carbone interagissent principalement par liaison covalente. La liaison covalente permet aux molécules de partager des électrons avec d'autres molécules, créant de longues chaînes de composés et rendant la vie plus complexe.
Quels sont les doublets d’un atome de la deuxième période ?
- Un atome de la deuxième ou de la troisième période respecte toujours la règle de l’octet et dispose toujours au sein d’une molécule de huit électrons sur sa couche de valence ce qui correspond à un total de 4 doublets (liants ou non liants).
???? Lycée (cours de seconde 2nd) Qu'est-ce que le modèle de LEWIS ? Notions de liaison covalente doublets LIANTS et NON LIANTSEn lien avec cette capsule ...
|
Fiche-Méthode modèle Lewis - Physagreg
Dans la première ligne, on écrira la formule brute de la molécule et On cherche le nombre de liaison covalente que doit former chaque atome pour respecter On calcule le nombre de doublet non liant qu'il y aura autour de chaque atome : |
|
Schéma de Lewis
Le doublet formé constitue une liaison covalente L'atome un doublet ou plus d' électrons libres ou non liants sur sa couche de valence (ex : NH3, OH-) |
|
1/6 I Liaison Covalente I Liais
Décrire la composition des molécules (à partir des formules chimiques) Sur la représentation de Lewis, il faut faire le décompte des charges présentes sur 1 liaison double + 2 liaisons simples ou doublets non liants → Molécule plane |
|
LES MOLECULES: REPRESENTATION CORRECTION - Educonline
I REPRESENTATION DE LEWIS DES MOLECULES 1) Les atomes Les liaisons entre atomes sont matérialisées par des tiges a) Élément Nombre de doublets liants: nu 1 4 3 2 2 1 Nombre de doublets non liants: nnu 0 0 1 L' atome de carbone établit 4 liaisons covalentes simples et satisfait à la règle de l' octet |
|
La liaison covalente
1 – Modèle de Lewis 2 – Modèle ondulatoire toutes les liaisons étant considérées comme purement covalente tous les atomes sont entourés de 4 doublets (liants ou non) La formule fait apparaître un minimum de charges formelles |
|
Chapitre 4 :La liaison chimique
doublet liant ou liaison covalente) - BA BAB A − Doublets non liants : 0 électrons C) Méthode générale d'écriture d'une formule de Lewis On considère |
|
Chapitre VII- La géométrie des molécules - Physique - Chimie
Les liaisons covalentes qui relient les atomes entre eux sont des doublets d' électrons formant des doublets non liants localisés autour de l'atome et représentés par des 4/ La représentation de Lewis : simulateur « 1S animation Lewis » |
|
EXERCICE RÉSOLU 2
Combien établit‐il de liaisons covalentes avec ses voisins ? 3 Combien possède ‐t‐il de doublets non liants ? 4 Représenter sa formule de Lewis 7 Utiliser |