loi de boyle mariotte pv nrt
|
Chapitre 13 : Les gaz parfaits
➢ La loi de Boyle Mariotte est historiquement l'ancêtre de la loi des gaz Quelle doit être la température du gaz (en °C) ? PV = nRT T = PV nR = 150 10 3 |
|
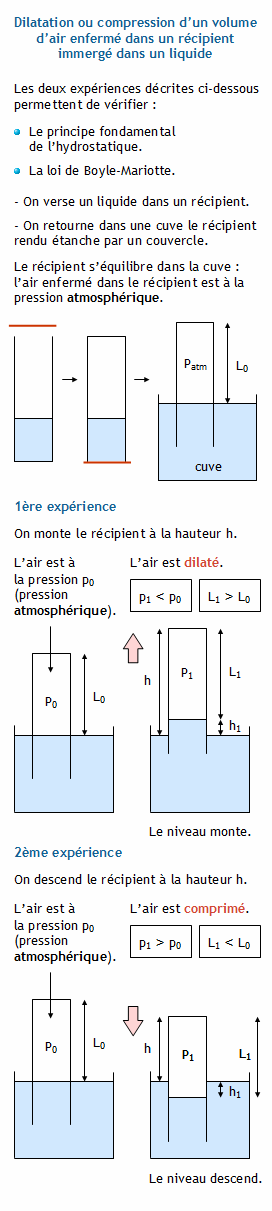
TP 14 Loi de Boyle-Mariotte P = x U
Objectifs: *Mesurer la pression d'un gaz grâce à un dispositif électronique *Etudier la variation de la pression d'un gaz en fonction du volume le nombre |
|
Loi-des-gaz-parfaits-exercices-corrigespdf
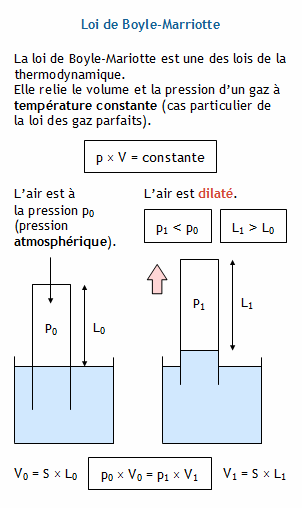
1) Loi de boyle-mariotte : A température constante pour une quantité donnée P V = n R T P en pascal (pa) V en mètre cube (m3) T en kelvin (k) n en mole |
|
Cours 2 : La pression et le vide Variables thermodynamiques
Loi de Boyle - Mariotte Si p= cte ⇒ V T =cte Loi de Gay-Lussac Si V= cte pV =nRT mais n=n 1 n 2 p 1 p 2 V =nRT p=p 1 p 2 |
|
Les Gaz Parfaits
Loi de Boyle-Mariotte volume et pression du gaz : Le savant anglais Robert Boyle établit la relation liant la pression et le volume d'un gaz relation qui sera |
C'est quoi le R dans PV nRT ?
Il existe une loi des gaz parfaits qui s'écrit sous la forme PV = nRT, où P est la pression d'un gaz (en pascals), V le volume occupé par le gaz (en m3), n la quantité de matière (en moles), R la constante universelle des gaz parfaits (8,3144621 J/K/mol), et T est la température (en kelvins).
La loi de Boyle-Mariotte décrit la relation entre la pression et le volume d'un gaz.
Elle stipule que, à température constante, le volume occupé par une certaine quantité de gaz est inversement proportionnel à sa pression.
|
Expérience P.V = cte 02425
1 - Introduction. Ce dispositif vous permet de vérifier simplement : la loi des gaz parfaits : P.V = n.R.T ; la loi de Mariotte : P.V = cte. La pression se |
|
Loi de Boyle Mariotte
calcul de PV pour une température considérée constante à 24.7°C et un volume de 30 ml. PV = nRT calcule de la quantité de matière n. V/1mole = R.T/P. |
|
Objectif général de lexpérience 1 Introduction
27 sept. 2017 Le premier objectif de l'expérience est de vérifier la loi de Boyle-Mariotte qui relie la pression et le volume d'un gaz parfait à température ... |
|
Chapitre 15 Modèle du gaz parfait
PV = nRT. Unités du Système international : P majuscule la pression du On retrouve la loi de Boyle-Mariotte étudiée en classe de première selon laquelle P. |
|
Chapitre 3 :Propriétés thermoélastiques des gaz réels phases
Loi de Boyle-Mariotte : Aux pressions évanouissantes. )0. ( ↦. P. PV ne Donc. PV nb. VP. ~). ( − . Donc. nRT. PV ≈ . Ainsi |
|
La compressibilité des gaz
PV=nRT. PV= Cte. Lorsque la quantité de gaz est constante on peut écrire. T. Il en découle 3 lois. Page 6. Loi de Boyle-Mariotte: Loi de Charles: En arrivant ... |
|
Modèle du gaz parfait
1) Loi de boyle-mariotte : A température constante pour une quantité donnée P.V = n.R.T. P en pascal (pa). V en mètre cube (m3). T en kelvin (k) n en mole ... |
|
04 juillet 2022
4 juil. 2022 E) l'équation d'état est égal à PV=nRT. 2) Parmi les items ... D) selon la loi de Boyle-Mariotte à température constante le produit PV est. |
|
RELATION LINEAIRE DIRECTEMENT PROPORTIONNELLE
La loi de Boyle Mariotte (souvent appelée loi de Boyle par les anglophones loi de Mariotte ou loi de Boyle Mariotte Exercices sur la loi PV =nRT. 1- Quatre ... |
|
Biophysique de1 letat gazeux
P augmente ( loi de Boyle-Mariotte) : PV=Cte. N BEN RAIS AOUAD. 9. C PV = n.R.T. Dim de R: R=P V/n.T=ML-1T-2.L3(n-1.θ. -1). N BEN RAIS AOUAD. 13. R=P V/n.T=ML ... |
|
Objectif général de lexpérience 1 Introduction
Expérience n°1 – Loi de Boyle-Mariotte et zéro absolu de température on obtient la forme standard de la loi des gaz parfaits: = PV nRT . (Eq. 10). |
|
Expérience P.V = cte 02425
P.V = cte vous permet de vérifier simplement : la loi des gaz parfaits : P.V = n.R.T ; la loi ... Remarque au sujet de la loi Boyle - Mariotte. |
|
Thermodynamique
La loi de Boyle-Mariotte est très facile à vérifier elle nécessite un matériel Un gaz parfait est un corps qui vérifie la relation PV = nRT à ... |
|
Plongée Loisir VF
Lois physiques associées. Gradient de Pression. Hydrostatique ? 1 bar / 10 m. Archimède. Isotherme : T ? Cte. Loi de Boyle-Mariotte : PV = nRT = cte. |
|
Cours de physique générale
5 mai 2009 l'autre variable change également de telle sorte que pV = cte. V. 1 p. pV = cte. Démo : Loi des gaz Pression - Volume Boyle - Mariotte # 657 ... |
|
Lois physiques des gaz - Reanesth
14 févr. 2013 Lois des gaz parfaits (Boyle-Mariotte Gay-Lussac |
|
Lois physiques des gaz - Reanesth
14 févr. 2013 Lois des gaz parfaits (Boyle-Mariotte Gay-Lussac |
|
Le premier principe de la thermodynamique
PV = cste (=nRT) loi de compressibilité isotherme à T et n fixées (Boyle Mariotte). • V/T = cste (= nR/P) loi de dilatation isobare à P et n fixées (Gay |
|
Modèle du gaz parfait
1) Enoncer la loi de Boyle-Mariotte. 2) Enoncer la loi du gaz parfait. de la pression p par le volume v occupe par le gaz est constant : P.V = constante. |
|
Chapitre 3 :Propriétés thermoélastiques des gaz réels phases
B) Lois de BoyleœMariotte et AvogadroœAmpère Loi de Boyle-Mariotte : ... 1) Volume molaire normal. nRT. PV = Dans les CNTP avec une mole de gaz :. |
| Exp01 - Mariottepdf - Objectif général de l'expérience 1 Introduction |
| Modèle du gaz parfait - AlloSchool |
| Chapitre 13 : Les gaz parfaits - Physagreg |
| Cours de physique générale - EPFL |
| Les Gaz Parfaits |
| I Propriétés des gaz II Les types de gaz |
| Gaz parfait - ACCESMAD |
| Expérience PV = cte 02425 - Pierron |
| Chapitre 15 Modèle du gaz parfait |
| Cours 2 : La pression et le vide Variables thermodynamiques |
Formule et Unités
La loi des gaz s'exprime mathématiquement par la formule: PV = nRT Où P est la pression exercée par un gaz. Il est généralement exprimé avec l'unité d'atmosphère (atm), bien qu'il puisse être exprimé en d'autres unités: mmHg, pascal, bar, etc. Le volume V occupé par un gaz est généralement exprimé en unités du litre (L). Alors que n est le nombre d...
Loi Boyle-Mariotte
Augmentation de la pression en réduisant le volume du récipient. Source: Gabriel Bolívar Il a été formulé indépendamment par le physicien Robert Boyle (1662) et le physicien et botaniste Edme Mariotte (1676). La loi est énoncée comme suit: à température constante, le volume d'une masse fixe d'un gaz est inversement proportionnel à la pression qu'il...
Loi Charles-Gay-Lussac
Lanternes chinoises ou ballons à souhait. Source: Pxhere. La loi a été publiée par Gay-Lussac en 1803, mais elle faisait référence à l'ouvrage inédit de Jacques Charles (1787). Pour cette raison, la loi est connue sous le nom de loi de Charles. La loi stipule qu'à pression constante, il existe une relation directe de proportionnalité entre le volum...
Loi d'Avogadro
La loi a été énoncée par Amadeo Avogadro en 1811, soulignant que des volumes égaux de tous les gaz, à la même pression et température, ont le même nombre de molécules. V 1 / n 1 = V 2 / n 2
Que Dit La Loi Sur Les Gaz Parfaits?
La loi des gaz parfaits établit une relation entre quatre propriétés physiques indépendantes du gaz: la pression, le volume, la température et la quantité de gaz. Il suffit de connaître la valeur de trois d'entre eux, pour pouvoir obtenir celle des autres. La loi établit les conditions qui indiquent quand un gaz se comporte idéalement et quand il s...
Calcul de La Densité et de La Masse Molaire d'un Gaz
L'équation de la loi des gaz parfaits peut être utilisée pour calculer la densité d'un gaz et sa masse molaire. En faisant une simple modification, on peut trouver une expression mathématique qui relie la densité (d) d'un gaz et sa masse molaire (M): d = MP / RT Et effacer M: M = dRT / P
Calcul Du Volume d'un Gaz Produit lors d'une Réaction Chimique
La stoechiométrie est la branche de la chimie qui rapporte la quantité de chacun des réactifs présents avec les produits participant à une réaction chimique, généralement exprimée en moles. L'utilisation de l'équation des gaz parfaits permet de déterminer le volume d'un gaz produit lors d'une réaction chimique; puisque le nombre de moles peut être ...
Calcul Des Pressions partielles Des Gaz présents Dans Un Mélange
La loi des gaz parfaits peut être utilisée, avec la loi de pression partielle de Dalton, pour calculer les pressions partielles des différents gaz présents dans un mélange gazeux. La relation s'applique: P = nRT / V Pour trouver la pression de chacun des gaz présents dans le mélange.
Volume de Gaz Collecté Dans L'eau
Une réaction est effectuée qui produit un gaz, qui est collecté au moyen d'un plan expérimental dans l'eau. La pression totale du gaz plus la pression de vapeur d'eau est connue. La valeur de ce dernier peut être obtenue dans un tableau et par soustraction la pression du gaz peut être calculée. À partir de la stoechiométrie de la réaction chimique,...
Loi de Mariotte.
Un gaz parfait est un fluide idéal qui satisfait à l’équation d’état p.v=n.RT, ou encore c’est un gaz qui obéit rigoureusement aux trois lois. MARIOTTE, GAY .LUSSAC et CHARLES. On désigne par ‘v’ le volume d’une unité de masse, de gaz parfait et par ‘Vm’ le volume molaire d’un gaz parfait avec : 1 mole =6,023.1023 Molécules = A (nombre d’Avogadro)....
Loi de Gay-Lussac.
A température constante, le produit de la pression d’une masse gazeuse par son volume est constant (cette loi est d’origine expérimentale) Sous faibles pressions, tous les gaz se comportent de la même manière quelque soit leur nature. Par définition, un gaz parfait sera un gaz pour lequel, P.V = Cte loi de MARIOTTE. Pour un gaz parfait, le produit ...
Loi de Charles (ou 2eme Loi de Gay-Lussac).
A pression constante, l’augmentation de volume d’un gaz parfait (dilatation ou détente) est proportionnelle à la température absolue. V/T = Cte Ou V=Cte.T loi de GAY-LUSSAC. Si on considère deux états différents d’une même masse gazeuse à la même pression avec : 1. T1 et V1température et volume à l’état (1). 2. T2 et V2 température et volume à l’ét...
Caractéristiques d’un Gaz Parfait
A volume constant, l’augmentation de pression d’un gaz parfait est proportionnelle à l’élévation de la température. On a : P/T = Cte Si on considère deux états différents d’une même masse gazeuse dans lesquelles elle occupe le même volume. La pression et la température sont : 1. P1 et T1pression et température à l’état (1). 2. P2 et T2pression et t...
Mélange Des Gaz Parfaits
On recherche l’équation qui lie les paramètres d’état (p, v,T). On considère une (U.D.M) d’un gaz parfait dans deux états différents : 1. Etat (1) : (P, V, T) 2. Etat (2) : (P’, V’, T’) Imaginons un 3èmeétat où la pression est P, la température est T’. Etat (3) : (P, V’’, T’). On passe à pression constante de l’état (1) à l’état (3), on a donc en v...
Comment calculer la loi de Boyle-Mariotte ?
C'est quoi le R dans PV nRT ?
Comment démontrer que PV nRT ?
Quand s'applique la loi de Boyle-Mariotte ?
Qu'est-ce que la loi de Boyle-Mariotte ?
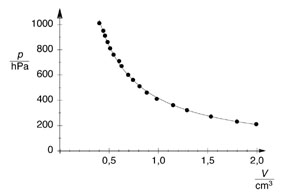
- La loi de Boyle-Mariotte relie la pression et le volume d'un gaz parfait à température constante. On trace ainsi une courbe isotherme du gaz. Boyle et Mariotte ont constaté que la courbe était proche, à quelques pourcents près, d'une branche d' hyperbole équilatère en coordonnées de Clapeyron , soit pour une température donnée constante.
Qu'est-ce que la loi de Mariotte ?
- Loi de Boyle-Mariotte. La loi de Boyle-Mariotte ou loi de Mariotte, souvent appelée loi de Boyle dans le monde anglo-saxon, du nom du physicien et chimiste irlandais Robert Boyle et de l'abbé physicien et botaniste français Edme Mariotte, est l'une des lois de la thermodynamique constituant la loi des gaz parfaits.
Où trouver le dispositif de Kröncke pour la démonstration de la loi Boyle-Mariotte ?
- Dispositif de Kröncke pour la démonstration de la loi Boyle-Mariotte. Musée des sciences de Milan, ( (it) voir sur le site du musée [ archive] ).
Qu'est-ce que l'isotherme de Boyle-Mariotte ?
- Le lieu géométrique des points de Boyle-Mariotte, qui sont les minimums des isothermes, est appelé courbe de Boyle-Mariotte. Il existe une température appelée température de Boyle-Mariotte au-delà de laquelle les isothermes sont croissantes monotones, l'isotherme correspondante est appelée isotherme de Boyle-Mariotte .
|
Exp01 - Mariottepdf - UniNE
Expérience n°1 – Loi de Boyle-Mariotte et zéro absolu de température de gaz, on obtient la forme standard de la loi des gaz parfaits: = PV nRT (Eq 10) 2 |
|
Lois physiques des gaz - Reanesth
14 fév 2013 · Connaître les principes des lois physiques des gaz ○ Lois des gaz parfaits ( Boyle-Mariotte, Gay-Lussac, Charles, ○P V = Z(T,P) N R T |
|
Les gaz parfaits - Physagreg
La loi de Boyle Mariotte est historiquement l'ancêtre de la loi des gaz parfaits kPa Quelle doit être la température du gaz (en °C) ? PV = nRT T = PV nR = |
|
I Propriétés des gaz II Les types de gaz
Boyle-Mariotte, de Charles, de Gay-Lussac et la loi général des gaz nRT = 99,384 L Exemple 2 : Un volume de 350 cm 3 d'un gaz a une masse de 1,069 g |
|
Thermodynamique - Jeulin
3 1 Objectifs Comprendre le sens de l'énoncé de la loi de Mariotte Si on considère la loi des gaz parfaits : p V = n R T, on constate que R = pV/nT, où n est le |
|
Expérience PV = cte 02425 - Pierron
Ce dispositif vous permet de vérifier simplement : la loi des gaz parfaits : P V = n R T ; la loi de Mariotte : P V = cte Remarque au sujet de la loi Boyle - Mariotte |
|
La compressibilité des gaz
Equation des gaz parfaits: PV=nRT PV= Cte Lorsque la quantité de gaz est constante on peut écrire T Il en découle 3 lois Page 6 Loi de Boyle-Mariotte: PxV= |
|
Chapitre 11
Loi de Boyle-Mariotte D'après la loi de Boyle-Mariotte, à température constante, le volume La loi de Charles nous dit qu'à pression constante, le volume d'un gaz P = nRT/V P = 0,76 mol x 8,314 kPa*L/mol*K x 321K/8,0L P = 2,5 x 102 kPa |













![Ley de boyle mariotte - [PDF Document] Ley de boyle mariotte - [PDF Document]](https://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Pression-volume_ARI.png/250px-Pression-volume_ARI.png)