Nombres de moles
|
Chapitre 11 : La mole
- On appelle quantité de matière le nombre de moles contenues dans un échantillon Elle se note n et s'exprime en mole (symbole : mol) 1 2 Le nombre d' |
|
Chimie quantitative – mole masse molaire volume molaire
Exercice 1 Une mole d'atomes est la quantité de matière qui contient 602 x 1023 atomes identiques Le nombre d'Avogadro est égal à 602 x 1023 |
|
QUANTITÉ DE MATIÈRE
moles « nombre de moles » (symbole : mol) NA = 602 1023 mol-1 constante d'Avogadro (en nombre d'entités par mole) N = n NA Ex : Combien y a-t-il d'atomes |
|
Chapitre-chimie-mole-concentration-molairepdf
Combien de « paquets » ou nombre de moles (n) sont contenus dans un échantillon de N atomes ? La relation de proportionnalité entre la quantité de matière n |
|
Éléments chimiques
mol g( 1 − ) Nom Symbole Z Masse molaire Nom Symbole Z Masse molaire aluminium Al 13 2698 lithium Li 3 694 antimoine Sb 51 12175 magnésium |
|
I La mole
En chimie les quantités des substances sont représentées par des nombres mais celles-ci doivent toujours être accompagnées par les unités qu'elles désignent |
C'est quoi le nombre de mole ?
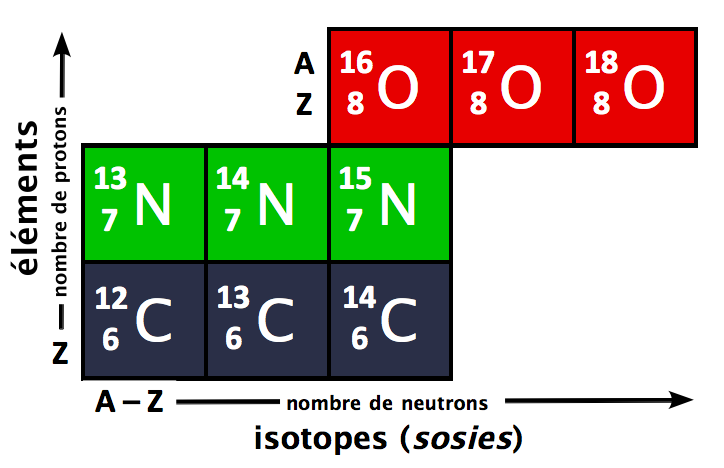
Par définition, la mole, de symbole mol, est la quantité de matière d'un système qui contient autant d'entités élémentaires qu'il y a d'atomes dans 0,012 kg (soit 12 g) de carbone 12 (noté 12C).
Dans l'état actuel de nos connaissances, on estime qu'il y a 6,022.1023 atomes de carbone 12 dans 0,012 kg de 12C.En laboratoire, il est possible de préparer une solution d'un volume V donné et une concentration massique Cm donnée.
Ainsi, il s'agit là d'une dissolution Pour ce faire, il faut, dans un premier temps calculer la masse de soluté nécessaire à la préparation.
On utilise alors la relation suivante : m = Cm x V.
Comment calculer le nombre de moles ?
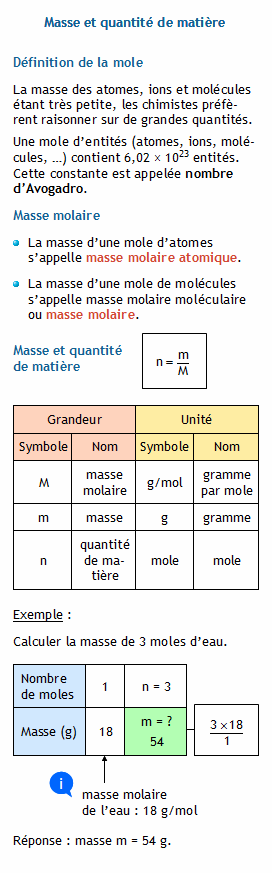
La formule n=mM n = m M permet de calculer le nombre de moles d'une substance à l'aide de sa masse et de sa masse molaire.
Une salière contient 97,02 g 97 , 02 g de chlorure de sodium (NaCl), communément appelé sel de table.
Quelle est la quantité de chlorure de sodium en nombre de moles?
Comment calculer le nombre de moles dans une réaction chimique ?
Nous pouvons convertir la masse en nombre de moles en utilisant l'équation �� = �� �� , où �� représente la quantité de matière en moles, �� représente la masse en grammes et �� représente la masse molaire en grammes par mole.
|
Calculer une quantité de matière - Editions Ellipses
Une mole est un ensemble 602 × 1023 entités chimiques (atomes ions ou molécules) Ce nombre est appelé « constante d'Avogadro » et est noté NA |
|
1) Calculez le nombre dentités (N = nbr de molécules atomes ou
1023/mol N = n NA ou n = N Na n = nbr de moles N = nbr de molécules ou d'atomes Na = nbr d'Avogadro Exercices : 1) Calculez le nombre d'entités (N |
|
La mole comme unité de quantité de matière et les grandeurs molaires
non car atomes invisibles ? Quelles données permettent de calculer le nombre d'atomes formant chaque javelot ? Matière des javelots (élément chimique) |
|
Exercice sur la mole et la quantité de matière Niveau : seconde Thème
L'ammoniac a comme formule brute NH3 1 Calculer la masse d'une molécule d'ammoniac 2 Déterminer le nombre N de molécules d'ammoniac contenues dans |
|
La mole Ce quil faut retenir La mole : Exercices dapplication niveau
où NA est le nombre d'Avogadro (NA = 602 1023 mol-1) Combien y a-t-il de molécules d'eau H2O dans 200 moles d'eau pure ? Exercice II |
|
La quantité de matière : la mole
1 fév 2008 · Si on connaît le nombre de nucléons d'un atome on peut savoir sa masse molaire (1 nucléon dans le noyau ? 1g/mol 4 nucléons dans le noyau ? |
|
Chapitre-chimie-mole-concentration-molairepdf
La mole et La Concentration molaire Introduction ? Quel est l'ordre de grandeur du nombre de particules contenues dans tous les objets qui nous |
|
Défis sur la notion de mole - pedagogieac-orleans-toursf
Réinvestir la définition de la quantité de matière et du nombre d'Avogadro qui ont été découverts précédemment dans les activités (grains de riz médicament |
|
9-cours molepdf
Pour pratiquer la chimie les chimistes doivent dénombrer le nombre d'atomes d'ions ou de molécules appelés « entités chimiques » (échelle microscopique) |
Comment calculer le nombre de moles ?
. Ensuite, il est possible de déterminer le nombre de moles.
C'est quoi le nombre de moles ?
. Dans l'état actuel de nos connaissances, on estime qu'il y a 6,022.1023 atomes de carbone 12 dans 0,012 kg de 12C.
Comment calculer le nombre n ?
. Pour calculer la quantité de matière demandée, il faut donc utiliser la formule n = C × V, où n représente la quantité de matière d'ions argent.
Comment calculer M avec N et M ?
|
Compter en chimie : à la découverte de la mole - Académie d
Cette quantité de matière (ou nombre de moles) est notée n et s'exprime en mol Doc 5 : Pour aller plus loin Utilité de la masse d'un paquet pour le chimiste |
|
La mole comme unité de quantité de matière et les grandeurs molaires
L'observation des javelots permet-elle de comparer leur nombre d'atomes ? non car atomes Calculer alors les nombres de moles d'atomesdanslesjavelots |
|
Chapitre 1 La quantité de matière, la concentration molaire et le
des nombres d'atomes ou de molécules extrêmement grands, veulent simplifier leurs nombre de moles d'atomes présentes dans ce morceau de fer (Ils sont |
|
La quantité de matière : la mole
1 fév 2008 · Si on connaît le nombre de nucléons d'un atome, on peut savoir sa masse molaire (1 nucléon dans le noyau → 1g/mol, 4 nucléons dans le noyau |
|
La mole
La mole Cours de chimie de seconde 3 Lycée Koeberlé SELESTAT Une mole d'entités élémentaires d) C'est le nombre de moles de carbone 12 |
|
Chapitre 9 : la mole, unité de quantité de matière - sciences
Pour pratiquer la chimie, les chimistes doivent dénombrer le nombre d'atomes, d' ions ou de molécules appelés « entités chimiques » (échelle microscopique) |
|
Chapitre 1 : Pourquoi et comment mesurer des - Physagreg
La mole est la quantité de matière d'un système contenant autant d'entités élémentaires qu'il y a d'atomes dans 12,00 g de carbone 12 Le nombre d' Avogadro |
|
Pdf, 6 MB - Université Paris-Saclay
La mole, aussi appelé nombre d'Avogadro, est une unité (mol) qui permet de manipuler de très grands nombres plus facilement La mole est une quantité de |











![Série de TD № 01 chimie 2[1] par Crash - Fichier PDF Série de TD № 01 chimie 2[1] par Crash - Fichier PDF](http://web.a9lame.com/Documents/images/Cours%203%20La%20mole%20La%20quantit%C3%A9%20de%20mati%C3%A8re.pdf%203.jpg)