relation entre s et ks
|
Chapitre Chapitre II: II: La La solubilité solubilité
3 Relation entre solubilité et produit de solubilité : a)- Cas d’un électrolyte simple : nH2O AX(s) AX(diss) A + (diss) + X-(diss) Ks = [A+] [X-] S= [A+] = [X-] S = (Ks)1/2 b)- Cas générale : nH2O AaXx(s) AaXx(diss) aA +x (diss) + xX-a (diss) Ks = [A+x]a [X-a]x S = 1/a [A+x] = 1/x [X-a] Soit [A+x] = as et [X-a] = xs KS = (as)a (xs)x =aa |
|
La solubilité
Relation entre solubilité et produit de solubilité : a)- Cas d'un S = (Ks)1/2 b)- Cas générale : nH2O AaXx AaXx aA+x + xX-a b)- Cas générale : nH2O AaXx |
|
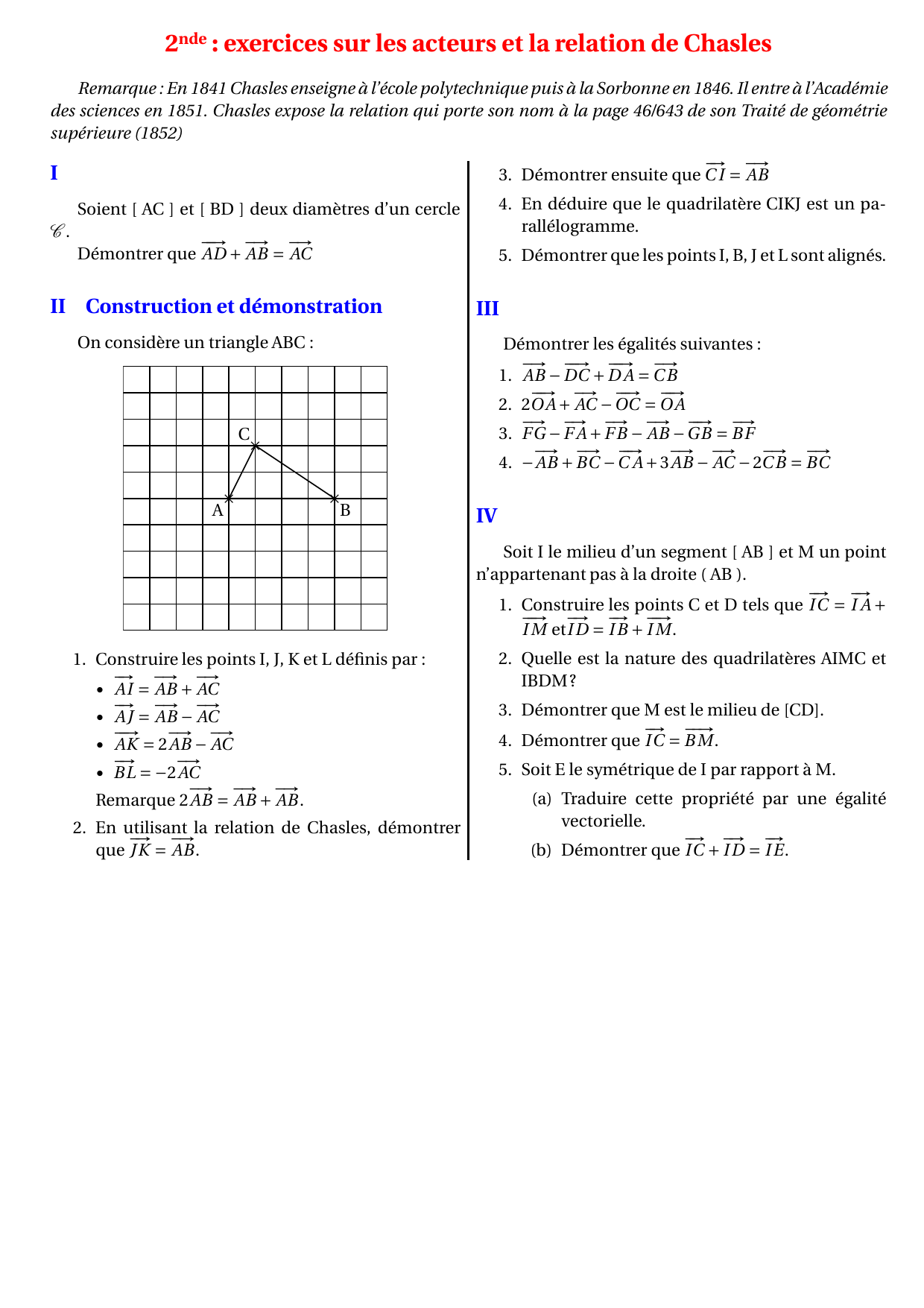
CHAPITRE II Equilibres de solubilité et de complexation I
[Pb2+] = c + s’’ ; Ks = (c+ s’’) (2s’’)2; s’’ < s → s’’ |
|
Équilibres de solubilité
La constante d'équilibre s'écrit Ks(AgCl) = [Ag+][Cl−] = 10−97 (à 298 K) De même lorsque le précipité Fe2S3(s) est présent l'équilibre solide/espèces |
|
EQUILIBRES ET SOLUBILITE
la relation entre Ks et s dépend des coefficients stoechiométriques de la réaction Si l’électrolyte est peu soluble Ks est faible et pKs élevé mais l’ordre des solubilités n’est pas nécessairement celui des Ks |
|
SOLUBILITE – REACTIONS DE PRECIPITATION
2 3 Relation entre s et Ks : CA sol →← C + aq + A –aq A t = 0 0 0 A l’équilibre s s On peut écrire : Ks = [C + ] aq [A – ] aq = s s = s 2 ⇒ s = Ks 3 Modification de la solubilité : 3 1 Effet d’IONS COMMUNS : Quand on introduit dans une solution saturée un ion commun avec le corps |
|
1) Notion de solubilité
Le produit de solubilité Ks est la constante d’équilibre de la réaction écrite dans le sens de la dissolution du solide ionique dans l’eau Exemple : Pour un solide pur l’activité est toujours égale à 1 Ks = On pose : pKs = - log Ks Ks = 10-pKs Plus Ks est petit plus le pks est grand moins le sel est soluble |
|
Réaction de solubilité
La solubilité « S » est définie comme étant quantité maximale de corps que l’on peut dissoudre dans un volume déterminé du solvant liquide Lorsque cette quantité normale est atteinte la solution est saturée et lorsque cette quantité est dépassée on dit qu’il y a précipitation du soluté |
Comment calculer la solubilité avec le KS ?
S = Ks/[OH-]3 dans ce cas la solubilité est fonction du pH.
On peut supposer que Fe(OH)3 étant très peu soluble, il y aura très peu d'ion OH- produit par sa dissolution et que le pH sera donc celui de l'eau pure pH = pOH = 7.La solubilité massique sm d'une espèce dans un solvant est égale à la masse maximale de solide que l'on peut dissoudre dans un litre de solution.
Elle s'exprime en g·L–1.
Lorsqu'un solide est dissous dans un solvant, une solution homogène est obtenue.
Quelle est la valeur de KS ?
Le produit de solubilité Ks est la constante d'équilibre de la réaction écrite dans le sens de la dissolution du solide ionique dans l'eau.
Exemple : Pour un solide pur, l'activité est toujours égale à 1.
On pose : pKs = - log Ks ⇒ Ks = 10-pKs Plus Ks est petit, plus le pks est grand, moins le sel est soluble.
1- de la solubilité :
La solubilité « S » est définie comme étant quantité maximale de corps que l’on peut dissoudre dans un volume déterminé du solvant liquide. Lorsque cette quantité normale est atteinte, la solution est saturée, et lorsque cette quantité est dépassée, on dit qu’il y a précipitation du soluté pharmacie.univ-batna2.dz
2- Différentes catégories d’un composé:
La structure conditionne la solubilité d’une substance « Le semblable dissout le semblable » D’une façon générale; un solvant polaire peut dissoudre un soluté polaire et un solvant apolaire dissoudra plus facilement un soluté apolaire. En particulier, les sels sont solubles dans des solvants comme l'eau. Cependant la solubilité des sels dans l'eau
3- Expression de la solubilité des composés peu solubles : 3.1. Equilibre de dissolution précipitation
A une température donnée, lorsqu’ on ajoute, en quantité appréciable, du soluté au solvant, on atteint la limite de solubilité pour le soluté considéré. On obtient au moins deux phases : D’où : [MX] pharmacie.univ-batna2.dz
MX M+ + X-
Solide Non Dissous Solide en solution saturée Ions pharmacie.univ-batna2.dz
3.2. Expression générale :
[MnXm] [MnXm] nMm+ + mXn- [MnXm] : composé en solution à l’état moléculaire en concentration maximale. pharmacie.univ-batna2.dz
4. Le produit de solubilité :
Soit l’équilibre de dissociation d’un composé MnXm en solution homogène : MnXm nMm+ ++ mXn- Applicabilité de la loi d’action de masse : Kc = m . Xn − n X m MnXm : Concentration maximale du composé en solution = S Kc.S = Mm+.Xn- = Ks Ks est une constante pour une température donnée. Le produit de solubilité est une constante q
Ks = Mm+ . Xn-
Si : Mm+. Xn- < Ks le corps reste dissous Si : Mm+. Xn- > Ks il y a précipitation sous forme solide Si : Mm+. Xn- = Ks La solution est saturée Ks est la valeur correspondant à la solution saturée, c'est donc le produit ionique maximum compatible avec l'absence de précipitation. Pour cette raison, il est appel
II- Influence de l’environnement sur la solubilité
Comme tout équilibre chimique, l’équilibre entre un sel solide et ses ions est dynamique, et peut subir des déplacements sous différentes influences : Influence de la nature du solvant et du soluté Influence de la température Influence de l’état physique du composé Influence d’un ion commun Influence du pH Influence de la complexation Influence de
4- Influence d’un ion commun :
Si l’on dissout un sel AXBY dans un solvant contenant déjà un ion commun BX- provenant d’un autre sel CXBZ soluble, le produit de solubilité du sel AXBY, qui est une constante s’écrit : x y A y + B x − = K S Dans ce cas B x − y . s , ou s est la solubilité de AXBY avant l’introduction de l’ion commun. En effet, les ions BX- provi
s .( y . s + c )
AXBY étant un sel peu soluble, on peut négliger la quantité y . s devant C, puisque CXBZ est un sel soluble. x y D’où : K = ( xx s . s ) . c = K S Et : pharmacie.univ-batna2.dz
III- Précipitation fractionnée
Si une solution contient plusieurs ions susceptibles de donner un précipité avec un même antagoniste, les sels ne vont pas se former en même temps mais successivement en raison des différences des produits de solubilité pharmacie.univ-batna2.dz
2. Les différents ions précipitant ont des charges différentes :
La simple comparaison des produits de solubilité est insuffisante pour prévoir les réactions. pharmacie.univ-batna2.dz
VI- Surcharge des précipités :
La surcharge des précipités se fait par occlusion ou par adsorption. L'occlusion résulte de l’emprisonnement par le précipité de sels présents dans la solution. Ce phénomène peut se produire lorsque le précipité résultant de l'échange d’ions se forme trop rapidement. L'adsorption est une contamination qui se produit en surface du précipité de
1. En Analyse qualitative :
Recherche des anions ou des cations dans une solution par l’observation d’une formation d’un précipité. pharmacie.univ-batna2.dz
2. En analyse Quantitative :
On peut doser un ion présent dans une solution en l’engageant dans un précipité qui est recueilli et pesé ; c’est le but de l’analyse gravimétrique. On peut également ajouter une solution titrée contenant l’ion provoquant la Précipitation ; on met ainsi en œuvre des méthodes titrimétriques les plus utilisées Sont des méthodes argentim
1. Argentométrie en milieu acide :
-En opérant en milieu acide fort (nitrique), on rend plus sélective la précipitation par les ions argentiques des Br -, Cl-, I-, CN- et SCN--L’absence presque totale des indicateurs nous impose de procéder à des méthodes en retour. . pharmacie.univ-batna2.dz
Méthode de Charpentier Volhard :
Cette méthode par retour nécessite en raison de l'absence d'indicateur en milieu acide Pour les halogénures. Elle s'effectue donc en deux temps : Ajouter un excès d’argent Ag+ dans une solution contenant l’ion halogénure pharmacie.univ-batna2.dz
Ag+ + X- → AgX
-Dosage de l'excès de Ag+ versé par une solution titrée de SCN- selon la réaction de précipitation : pharmacie.univ-batna2.dz
b. Applications – Extension :
Le dosage des chlorures et bromures s'effectue sans difficulté en opérant la précipitation en milieu nitrique. Le dosage des iodures présente deux difficultés : L'adsorption considérable de l'iodure d'argent. L'action oxydante de l'acide nitrique sur les iodures. Pour éviter ce dernier inconvénient, de précipiter en milieu neutre les I- et
c I −
-Cet ion periodure donne avec l'amidon une coloration bleue intense - Utilisée également comme indicateur en iodométrie. -Par addition de solution de nitrate d'argent, on atteint le point d'équivalence, étant donné la valeur du produit de solubilité de l'iodure d'argent, l'iodure est chassé du complexe et précipite. Il en résulte une décoloration
4. Méthode de Fajans :
L'adsorption, dans ce cas, est non seulement utile mais nécessaire. - Tous les halogénures d'argent ont un certain pouvoir adsorbant, qui augmente du Cl- au Br- et à I-. L'adsorption consiste à la fixation d'ions par le précipité d'halogénure d'argent Lors du dosage d'un halogénure par le nitrate d'argent, avant le point d'équivalence, les grai
VII- Courbes de titrage :
Les courbes de titrage sont généralement présentées sous la forme de graphiques où l'on porte le pAg en fonction du volume de nitrate d'argent. pharmacie.univ-batna2.dz

EQUILIBRE DE PRECIPITATION V2: RELATION ENTRE Ks et s PARTIE 2

EQUILIBRE DE PRECIPITATION V1: SOLUBILITE PRECIPITE PRODUIT DE SOLUBILTE ET RELATION ENTRE Ks & s

Application : Calcul de la solubilité à partir du Kₛ
|
EQUILIBRES ET SOLUBILITE
la relation entre Ks et s dépend des coefficients stoechiométriques de la réaction. Si l'électrolyte est peu soluble Ks est faible et pKs élevé mais |
|
Diapositive 1
s=[CrO4. 2-] = 0027/332= 8 |
|
HYDRAULIQUE A SURFACE LIBRE
déterminer une relation entre la contrainte de cisaillement o ? la masse volumique Ks=64 hn/X=72%. T=1800 mm. V=2.60 m/s. Ks=55 hn=1.3m. Q=2.2m3/s. |
|
SMPC (S2) Année universitaire : 2019/2020 Cours de chimie des
5) Montrer qu'il y a précipitation et calculer la masse du précipité obtenu. 6) Établir la relation entre s [H3O+] |
|
HYDRAULIQUE A SURFACE LIBRE
On s'intéresse dans ce chapitre à la détermination des courbes de remous ainsi KS. = 1 le coefficient de Manning. Cette relation est valable pour une ... |
|
SOLUBILITE – REACTIONS DE PRECIPITATION
2.3. Relation entre s et Ks : CAsol. ?. ? . C. + aq + A. – aq. A t = 0. 0 0. A l'équilibre. s s. On peut écrire : Ks = [ ]. |
|
Equilibre : Précipitation-Solubilité /Dr. Maghchiche
Tableau 1 : produit de solubilité de quelques sels. Sel. Ks. Sel. Ks Il existe une relation entre la solubilité S et le produit de solubilité Ks qu'il ... |
|
Étude de la solubilité de lacide benzoïque dans leau en fonction de
donc Ks(T) = s (en exprimant s en mol/L). Comme toute constante thermodynamique d'équilibre Ks(T) ne dépend que de la température selon la relation de Van' |
|
Biologie cellulaire. Exercices et méthodes
Le produit de solubilité du phosphate de zinc s'exprime par la relation suivante : Ks = [Zn2+]éq [PO4. 3–. ] 2 éq. ? b. La relation entre la solubilité et |
|
Chimie 6 Précipitation solubilité Table des matières
le sulfate de plomb s = c0. ?. Ks ? 1 |
Comment calculer la solubilité avec KS ?
. On peut supposer que Fe(OH)3 étant très peu soluble, il y aura très peu d'ion OH- produit par sa dissolution et que le pH sera donc celui de l'eau pure pH = pOH = 7.
Comment déterminer le KS ?
Comment calculer la valeur de la solubilité ?
. Certains solides sont plus solubles que d'autres.
|
La relation mathématique entre poids, masse et intensité de la
Relation mathématique entre le poids d'un corps, sa masse et l'intensité de la pesanteur OBJECTIFS DE FORMATION • Réinvestir la relation mathématique |
|
La relation entre lenvironnement construit et lactivité - RERO DOC
Mémoire de licence présenté par Jonas Schmid sous la direction du Prof Giuseppe Pini La relation entre l'environnement construit et l'activité physique sous |
|
Lobjectif est dobtenir la relation entre les quantités de matière
Exemple Afin de déterminer la concentration C1 d'une eau oxygénée, on en prélève un volume V1 = 10,0 mL que l'on dose à l'aide d'une solution de |
|
Diapo – Relation entre les opérations - Apprendre Enseigner Innover
Les liens entre les opérations : L'addition et la soustraction sont des opérations inverses • L'élève doit d'abord saisir la relation du tout et de ses parties |
|
ÉTUDE DE LA RELATION ENTRE DEUX VARIABLES (le coefficient
Le coefficient de corrélation de Bravais-Pearson est un indice statistique qui exprime l'intensité et le sens (positif ou négatif) de la relation linéaire entre deux |
|
Relation entre le style de communication - Archipel UQAM
Tableau 18 Résultats du rôle médiateur de la variable de l'engagement de l' élève dans la relation entre les variables de la relation maître-élève et l'intensité du |



![ensembles relations lois de composition [PDF: 82 ko] ensembles relations lois de composition [PDF: 82 ko]](https://www.cours-gratuit.com/images/remos_downloads/detail2/id-7839.7839.pdf-full.jpg)
![PDF] Cours sur le marketing relationnel et la gestion de la PDF] Cours sur le marketing relationnel et la gestion de la](https://www.fichier-pdf.fr/2012/06/19/formulaire/preview-formulaire-1.jpg)


















