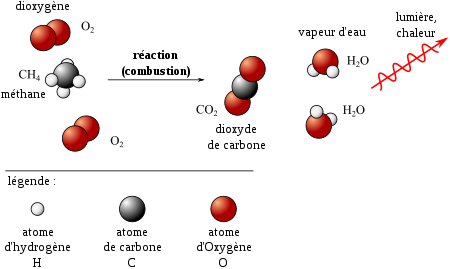
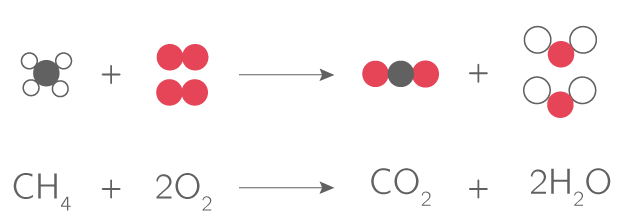
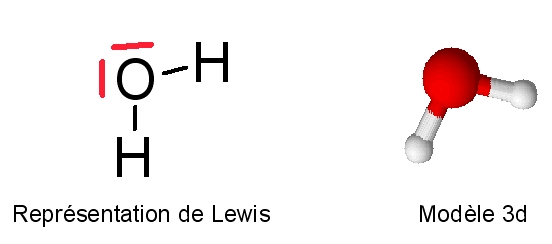équation de la réaction chimique qui modélise la décomposition de l'eau oxygénée
|
Cinétique de la réaction des ions iodure avec leau oxygénée Lion
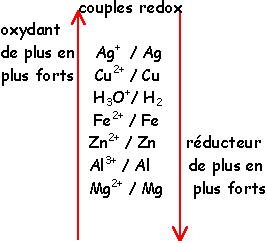
Écrire l'équation de la réaction d'oxydoréduction entre les ions iodure et l'eau oxygénée en milieu acide 2I-(aq) = I2 (aq) + 2e- H2O2 (aq) + 2H+ (aq) + 2e |
Quel est le rôle de L'eau oxygénée dans le couple H2O2 H2O ?
Document 4 : L'eau oxygénée un ampholyte
Les propriétés antiseptiques sont dues au caractère oxydant de H2O2 (couple H2O2/H2O). À température ordinaire, l'eau oxygénée se décompose lentement.Comment se manifeste la transformation chimique de L'eau oxygénée ?
Une molécule d'eau oxygénée est composée de 2 atomes d'hydrogène et de 2 atomes d'oxygène liés entre eux.
Sous l'effet des rayons ultraviolets contenus dans la lumière du Soleil, l'eau oxygénée subit une transformation chimique : elle se décompose pour former de l'eau et du dioxygène.Comment former H2O2 ?
Dans l'industrie chimique, H2O2 est produit en combinant du dihydrogène (H2) et du dioxygène (O2), un mélange explosif de gaz.
- Par définition, 1 l d'eau oxygénée à x volumes est susceptible de dégager x litres de O2 gaz, mesurée dans les conditions normales de température et de pression, par dismutation de H2O2 (équation chimique ci-dessus).
|
TS 1 CONTRÔLE DE SCIENCES PHYSIQUES 03/11/05 I/ Étude
3 ??? 2005 de l'eau oxygénée par les ions iodure en présence d'acide sulfurique. Cette ... L'équation de la réaction qui modélise la transformation ... |
|
Exercice : décomposition de leau oxygénée Exercice
L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2 qui 2-2) Écrire l'équation de la réaction de H2O2 et de l'ion permanganate MnO4. |
|
CORRECTION TS 2 : Test Chimie 1 Date : Sujet A ETUDE
L'équation de la réaction qui modélise la transformation d'oxydoréduction sulfurique en excès 15 |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau
9 ??? 2017 oxygénée se décompose lentement selon l'équation-bilan suivante : 2H2O2(aq). 2H2O(l) + O2(g). Cette réaction de décomposition peut ... |
|
Préparation dune solution de peroxyde dhydrogène (H2O2 ou eau
Solution de peroxyde d'hydrogène selon l'équation bilan de décomposition. 1°) Équation chimique de la réaction : 2 H2O2 (?) ?. 2O(?) + O2 (g). |
|
Physique-chimie MODÉLISER LÉVOLUTION TEMPORELLE DUN
2. À l'échelle microscopique comment modélise-t-on une transformation chimique au niveau des entités chimiques mises en jeu ? Comment explique |
|
Espèces chimiques molécules et atomes
La formule H2O2 (eau oxygénée) représente une molécule (avec ses L'équation de la réaction chimique qui modélise la combustion d'un hydrocarbure. |
|
SVT-SPC-ACT 2-RESSOURCES protocole oxydation du glucose
frotter les yeux et se rincer à l'eau ; ne pas toucher la laine de verre si qui a été formé. ... Une équation chimique symbolise cette réaction :. |
|
Www.devoirat.net - 2011
oxygénée par les ions iodure en présence d'acide sulfurique transformation considérée comme totale. L'équation de la réaction qui modélise la |
|
Exercice n°1 : 155 pts « Eau oxygénée » est le nom commun du
ne garder que celle qui modélise la transformation chimique étudiée : 2/ A partir de cette équation et des informations données construisez le tableau |
|
Exercice : décomposition de leau oxygénée - Physique chimie facile
1- L'eau oxygénée est instable et se décompose lentement suivant la réaction : 2 H2O2(aq) O2(g) + 2 H2O(l) Une solution d'eau oxygénée à n volumes peut |
|
Leau oxygénée - LUTES
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2liq = H2Oliq + 1/2 O2g Calculez l'enthalpie standard de décomposition de H2O2liq |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau oxygénée
9 mar 2017 · oxygénée se décompose lentement selon l'équation-bilan suivante : 2H2O2(aq) 2H2O(l) + O2(g) Cette réaction de décomposition peut |
|
[XLS] Cinétique de la décomposition de leau oxygénée
Donner l'équation chimique de la réaction de dosage Etablir l'expression littérale donnant la concentration C de H2O2 en fonction du volume E de la prise d' |
|
Exercice n°1 : 155 pts « Eau oxygénée
Eau oxygénée » est le nom commun du peroxyde d'hydrogène de formule chimique H2O2 ne garder que celle qui modélise la transformation chimique étudiée : |
|
L Feriana
Exercice 1 : On se propose d'étudier la cinétique de la transformation lente de décomposition de l'eau oxygénée par les ions iodure en présence d'acide |
|
Première Question: Décomposition dune eau oxygénée (7 points)
On se propose d'étudier la cinétique de la réaction de décomposition du peroxyde d'hydrogène réalisée en présence de l'ion fer (II) L'équation-bilan de |
|
Cinétique de la réaction des ions iodure avec leau oxygénée Lion
Écrire l'équation de la réaction d'oxydoréduction entre les ions iodure et l'eau oxygénée en milieu acide 2I-(aq) = I2 (aq) + 2e- H2O2 (aq) + 2H+ ( |
|
Test Chimie 1 Date : Sujet A ETUDE CINETIQUE D UNE REACTION
oxygénée en présence d'acide sulfurique transformation considérée comme totale L'équation de la réaction qui modélise la transformation d'oxydoréduction |
|
2 n 10 n
de l'eau oxygénée par les ions iodure en présence d'acide sulfurique transformation considérée comme totale L'équation de la réaction qui modélise la |
Quelle est la réaction de décomposition de l'eau oxygénée ?
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2,liq = H2Oliq + 1/2 O2,g Calculez l'enthalpie standard de décomposition de H2O2,liq connaissant les enthalpies standard de formation de H2O2,liq (?fH°( H2O2,liq) = - 188 kJ.Quel est la gaz libéré par la dismutation de l'eau oxygénée ?
L'eau oxygénée se décompose sur elle-même, donnant du dioxygène et de l'eau selon la réaction : 2 H2O2 ? O2 + 2 H2O.Quelle est la quantité de matière de O2 libéré par la décomposition d'un litre d'eau oxygénée ?
Sachant que deux moles de peroxyde d'hydrogène libèrent une mole de dioxygène, quelle quantité de dioxygène nO2 exprimée en moles peut libérer un litre de cette eau oxygénée ? 0,89 mol de peroxyde d'hydrogène, présent dans ce litre libère : 0,5*0,89 = 0,445 mol ~0,45 mol de dioxygène.- L'équation de la décomposition de l'eau est : H2O ? 2 H2 + O2.
Comment modéliser une réaction chimique ?
. Pour écrire une équation chimique, on place une fl?he horizontale vers la droite, les réactifs sont placés à gauche de la fl?he et les produits à droite de la fl?he : réactifs ? produits.
Comment trouver l'équation de la réaction ?
. Remarque : lorsqu'une équation de réaction est écrite avec le signe (=), la réaction chimique n'est généralement pas orientée.
C'est quoi l'équation de réaction ?
. Un exemple en est CO2 + H2O = H2CO3.
. Cette équation exprime une réaction, par laquelle une molécule d'eau s'additionne à une molécule de gaz carbonique.
|
Etude de la composition isotopique (deutérium et oxygène 18) de la
26 mar 2018 · la liste mais je vous remercie quand même ) ; a ceux qui m'ont 3 5 Evaporation d'une masse d'eau : le mod`ele de Craig and nuages (eau condensée) et de leurs phénom`enes de rétro-actions Les isotopes stables de l'eau (oxyg`ene 18 et deutérium) sont chimiques sensiblement différentes |
|
Chimie 12e année - Programme détudes : document de mise en
Vous trouverez ci-dessous une liste de ressources éducatives qui se prêtent bien à ce Chimie générale, 2e édition, Mont-Royal, Éd Modulo, 2004 (DREF 541 Prédis les produits de la réaction et assure-toi d'équilibrer l'équation Les composés ioniques en solution dans l'eau se dissocient en ions, contrairement aux |
|
Les réactions chimiques - Manitoba Education
Vous trouverez ci-dessous une liste de ressources éducatives qui se prêtent bien à ce balancement d'équations chimique qui inclut une vidéo] C11-3-06 prédire les produits d'une réaction chimique à partir des réactifs et du type de Pourquoi la masse atomique de l'oxygène a-t-elle une valeur d'exactement 16,00 g |
|
Réduction de modèle, observation et commande prédictive dune
29 mar 2018 · Les réactions chimiques qui sont mises en oeuvre par la suite de biomasse est nécessaire pour que la réaction biologique ait lieu La liste des processus Les équations du mod`ele sont présentées sous forme d'une matrice (tableau La variabilité du débit et de la composition des eaux usées est liée |
|
PHYSIQUE - CHIMIE - Concours Commun INP
4 mai 2016 · Si un candidat est amené à repérer ce qui peut lui sembler être une erreur signalera sur sa copie et devra poursuivre sa composition en Proposer un mod `ele électrique simple conduisant `a une équation CHIMIE L'eau de Javel Toutes les données nécessaires se trouvent au Oxyg`ene Chlore |
|
Modélisation mathématique de loxygène dans l - Archimer - Ifremer
mathématique unidimensionnel de qualité de l'eau, incluant la modélisation Les équations résolues pour le calcul hydrodynamique sont les équations Les composants chimiques qui sont calculés par le modèle sont appelés des variables réaction globale, qui se manifeste en final par la demande totale en oxygène, |
|
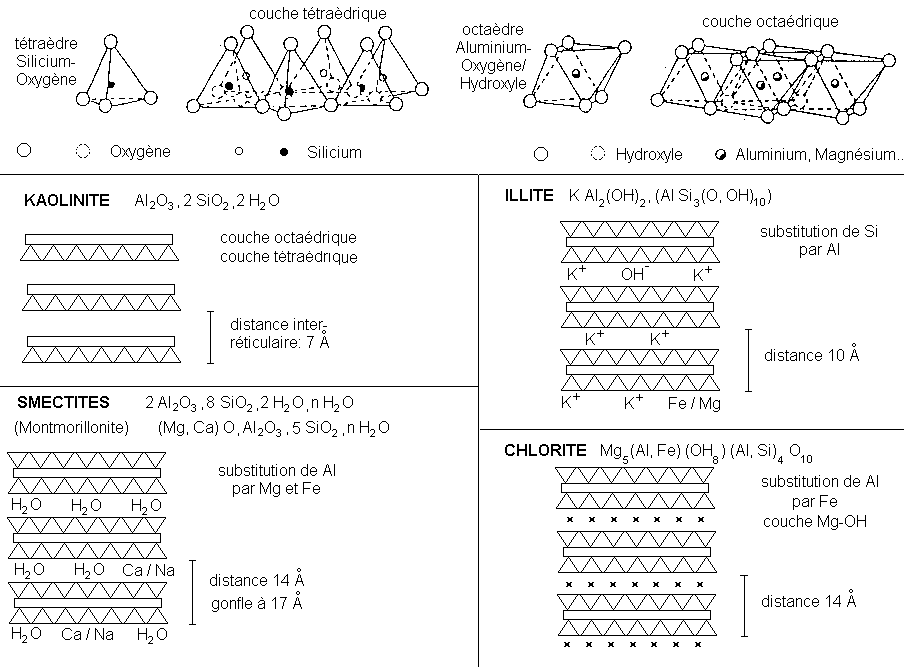
Iggg SERVICE DE DOCUMENTATION
nées par les atomes d'oxygène des couches tétraédriques, retiennent mieux le Nous devons tenir compte de la composition chimique du minéral : Le Cr II a un potentiel ionique |
|
Thermodynamique et cinétique électrochimique - Electrochimie
16 Syst`eme électrochimique mod`ele 163 conducteur ionique ou électrolyte : sel dissous dans l'eau ou dans un solvant dans une solution qui contient l'ion Ag+, mais de l'électrode Ag+/Ag 1 lisée par ∆r˜G est plus complexe que celui d'une réaction chimique Il s'oxyde et son nombre d'oxydation ou degré d'oxy- |