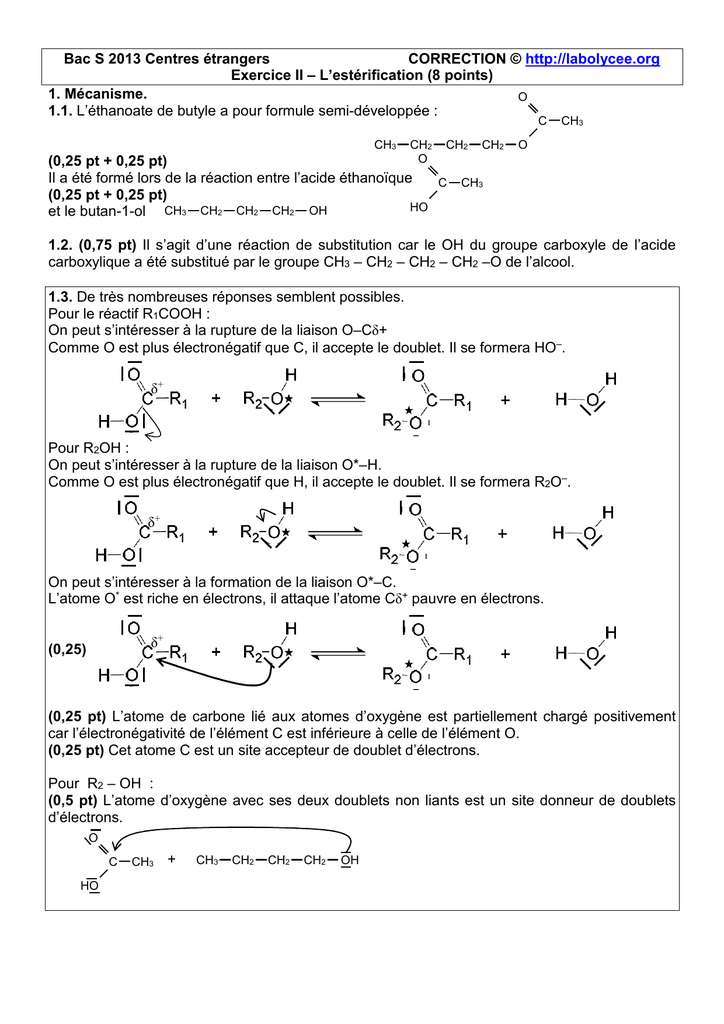
cinétique de décomposition de l'eau oxygénée
|
Chapitre 3 DECOMPOSITION THERMIQUE DES SOLIDES
1 jui 2018 · La cinétique de décomposition thermique (évolution de la perte de masse ou de la vitesse de perte de masse) est alors représentée par une |
|
ER Cinétique Chimique
ER Cinétique Chimique Décomposition de l'eau oxygénée On se propose d'étudier la cinétique de la réaction de décomposition de l'eau oxygénée `a une |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau oxygénée
3 2 Tracer la courbe cinétique (courbe 1) qui représente [H2O2]=f(t) En prendre l'échelle : En abscisses : 1cm pour 10 min ; En ordonnées : 1cm pour 0 01 mol L |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau oxygénée
9 mar 2017 · 3 2 Tracer la courbe cinétique (courbe 1) qui représente [H2O2]=f(t) En prendre l'échelle : En abscisses : 1cm pour 5 min ; En ordonnées : 1cm |
|
Exercices de Cinétique chimique avec solutions
Exercices Exercice n°1 Lorsqu'on étudie à 48 °C la réaction de décomposition du chlorure de benzène diazonium : C6H5N2Cl → C6H5Cl + H2 |
Quels sont les 3 principaux facteurs cinétiques ?
En conséquence, un facteur cinétique modifie la durée d'évolution d'un système chimique.
Plusieurs facteurs cinétiques peuvent être envisagés comme la température, la pression et la concentration des réactifs.Quelle est la réaction de décomposition de l'eau oxygénée ?
.
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2,liq = H2Oliq + 1/2 O2,g Calculez l'enthalpie standard de décomposition de H2O2,liq connaissant les enthalpies standard de formation de H2O2,liq (∆fH°( H2O2,liq) = - 188 kJ.Comment déterminer K ?
On peut déterminer la valeur de k en effectuant une même réaction à différentes températures.
On obtient ainsi une série de mesures rassemblant k = f(t).
La méthode des vitesses relatives permet de déterminer l'ordre de réaction par rapport à chacun des réactifs.- Exemple : une solution à 35% ( [% H2O2]masse = 35), contient donc 35g de H2O2 pour 100 g de solution, et compte tenu de la densité (1130 kg/m3 ou 1,13 g/ml) , 39,55 g pour 100 ml ou 395,5 g/litre, ce qui correspond à (395,5/34.01)= 11,62 moles de H2O2, soit en volume (11,62 x 11,2) = 130 litres (environ).
|
ER Cinétique Chimique - Décomposition de leau oxygénée
3) Vérifier par régression linéaire l'ordre de dismutation de l'eau oxygénée. 4) En déduire la valeur de la constante `a la température et le temps de |
|
Etude cinétique de la décomposition de l’eau oxygénée
Problème I-1 – Etude cinétique de la décomposition de l'eau oxygénée. Enoncé. En présence de perchlorure de fer jouant le rôle de catalyseur l'eau oxygénée |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau
9 mars 2017 L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène utilisée comme désinfectant pour les plaies et pour l'entretien des ... |
|
E R C C (5) ? ER ? Décomposition de leau oxygénée
§ la concentration molaire volumique en H2O2 est proportionnelle au volume v1éq de solution de permanganate versé. 2) On postule une cinétique d'ordre 1 par |
|
Etude cinétique des propriétés catalytiques de lhémocyanine de
Néanmoins l'étude cinétique quanti- tative de la décomposition de l'eau oxygénée par l'oxyhémocyanine n'a jamais été effectuée. |
|
1 Objectifs 2 Principe de la manipulation 3 Cinétique de la réaction
Le peroxyde d'hydrogène (H2O2) intervient dans deux couples oxydant-réducteur : H2O2/H2O et O2/H2O2. Le peroxyde d'hydrogène (ou eau oxygénée) se décompose |
|
Problème I-1 – Etude cinétique de la décomposition de leau
Problème I-1 – Etude cinétique de la décomposition de l'eau oxygénée. Enoncé. En présence de perchlorure de fer jouant le rôle de catalyseur l'eau oxygénée |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau
Déduire la concentration C0 de la solution d'eau oxygénée. ???????? ?????????? ??????. ???. : ??????. ??????. : ????????. ???????. |
|
TS 1 CONTRÔLE DE SCIENCES PHYSIQUES 03/11/05 I/ Étude
3 nov. 2005 On se propose d'étudier la cinétique de la transformation lente de décomposition de l'eau oxygénée par les ions iodure en présence d'acide ... |
|
Exercice : décomposition de leau oxygénée Exercice
Exercice : décomposition de l'eau oxygénée. 2008-2009. L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2 qui est souvent utilisée comme. |
|
Exercice 1 (7 points) Cinétique de la décomposition de leau oxygénée
L'eau glacée bloque la décomposition de l'eau oxygénée Les deux facteurs cinétiques : Concentration du réactif et la température ½ ¼ ¼ 2 2 A l |
|
Décomposition de leau oxygénée - ER Cinétique Chimique
ER Cinétique Chimique Décomposition de l'eau oxygénée On se propose d'étudier la cinétique de la réaction de décomposition de l'eau oxygénée `a une |
|
Etude de la cinétique de la décomposition de leau oxygénée H2O2
Etude de la cinétique de la décomposition de l'eau oxygénée H2O2 Détermination de la concentration de la solution d'eau oxygénée |
|
Etude cinétique de la décomposition de leau oxygénée - KlubPrepa
Problème I-1 – Etude cinétique de la décomposition de l'eau oxygénée Enoncé En présence de perchlorure de fer jouant le rôle de catalyseur l'eau oxygénée |
|
[XLS] Cinétique de la décomposition de leau oxygénée
Dosage de l'eau oxygénée par l'ion permanganate et résultats : Donner l'équation chimique de la réaction de dosage Etablir l'expression littérale donnant la |
|
Première Question: Décomposition dune eau oxygénée (7 points)
Première Question: Décomposition d'une eau oxygénée (7 points) L'eau oxygénée ou solution aqueuse de peroxyde d'hydrogène H2O2 est une espèce oxydante |
|
1h - Problème 1 : Décomposition dune eau oxygénée (10points)
On se propose d'étudier la cinétique de la réaction de décomposition du peroxyde d'hydrogène réalisée en présence de l'ion fer (II) L'équation-bilan de cette |
|
Leau oxygénée - LUTES
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2liq = H2Oliq + 1/2 O2g Calculez l'enthalpie standard de décomposition de H2O2liq |
|
Activité expérimentale Étude cinétique de la décomposition des ions
Étude cinétique de la décomposition des ions iodure par l'eau oxygénée Présentation générale de la manipulation L'étude cinétique que nous réalisons |
|
Suivi cinétique de la décomposition de leau oxygénée
Étudier l'évolution dans le temps de la réaction de décomposition de l'eau oxygénée catalysée par les ions Fe3+ I PRINCIPE 1 Équation de la réaction L'eau |
Quelle est la réaction de décomposition de l'eau oxygénée ?
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2,liq = H2Oliq + 1/2 O2,g Calculez l'enthalpie standard de décomposition de H2O2,liq connaissant les enthalpies standard de formation de H2O2,liq (?fH°( H2O2,liq) = - 188 kJ.Quel est la gaz libéré par la dismutation de l'eau oxygénée ?
L'eau oxygénée se décompose sur elle-même, donnant du dioxygène et de l'eau selon la réaction : 2 H2O2 ? O2 + 2 H2O.Comment se calcule la masse molaire moléculaire de l'eau oxygénée H2O2 ?
L'eau oxygénée, ou peroxyde d'hydrogène, H2O2, a une masse molaire M=34g/mol. Lorsqu'il est écrit 110 volume sur le flacon, cela signifie que la décomposition de H2O2 que contient la solution, libère un volume d'oxygène O2 égal à 110 fois son volume.- Pour une eau oxygénée à n mol/L de peroxyde d'hydrogène, 1 L d'eau peut dégager n/2 mol de dioxygène, c'est à dire 22,4×n/2 = 11,2n L. Le "22,4" est le volume molaire Vm = V/n = RT/P (en supposant le dioxygène comme un gaz parfait).
Quel est la gaz libéré par la dismutation de L'eau oxygénée ?
Quelle est la décomposition de L'eau ?
Pourquoi la concentration est un facteur cinétique ?
|
Décomposition de leau oxygénée - ER Cinétique Chimique
§ la concentration molaire volumique en 2 2 est proportionnelle au volume 1,éq de solution de permanganate versé 2) On postule une cinétique d' |
|
E R C C (5) 击 ER 击 Décomposition de leau oxygénée
On se propose d'étudier la cinétique de la réaction de décomposition de l'eau oxygénée `a une température T fixée En présence de perchlorure de fer jouant le |
|
TP4 suivi decomposition eau oxyg
TP4 χ Suivi cinétique de la décomposition de l'eau oxygénée Objectifs Étudier l' évolution dans le temps de la réaction de décomposition de l'eau oxygénée |
|
Cinétique chimique - Chamilo
La cinétique de la réaction de décomposition du peroxyde d'hydrogène H2O2 ( eau oxygénée) en eau H2O et en dioxygène O2 (équation chimique ci-dessous) |
|
Décomposition dune eau oxygénée
L'eau oxygénée ou solution aqueuse de peroxyde d'hydrogène H2O2 est une On se propose d'étudier la cinétique de la réaction de décomposition du |
|
EXERCICES DE REVISION : CINETIQUE CHIMIQUE - PC-STL
L'eau oxygénée se dismute, c'est-à-dire se décompose, spontanément mais lentement, selon la réaction notée par la suite (1), d'équation : H2O2(l) = H2O(l) + |
|
Décomposition de leau oxygénée - WordPresscom
Exercice : décomposition de l'eau oxygénée 2008-2009 L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2, qui est souvent utilisée |
|
Cinétique de la réaction entre les ions iodures et leau oxygénée
La quantité de diiode formé peut être évaluée indirectement par l'ajout d'une quantité connue de thiosulfate de sodium Celui-ci réagit instantanément avec le |