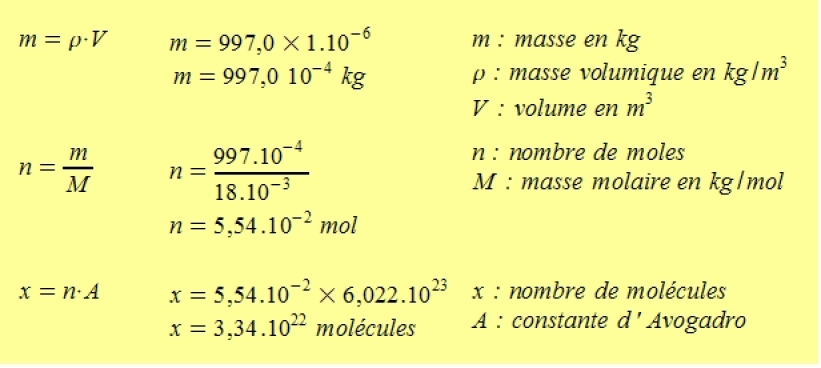combien de moles dans 1 litre d'eau
|
1 Matiere
Dans une mole de molécules d'eau combien de moles d'atomes d'oxygène trouve-t-on ? Sachant qu'un litre d'eau pure contient 556 mol de molécules d'eau en |
|
Chapitre 1 La quantité de matière la concentration molaire et le
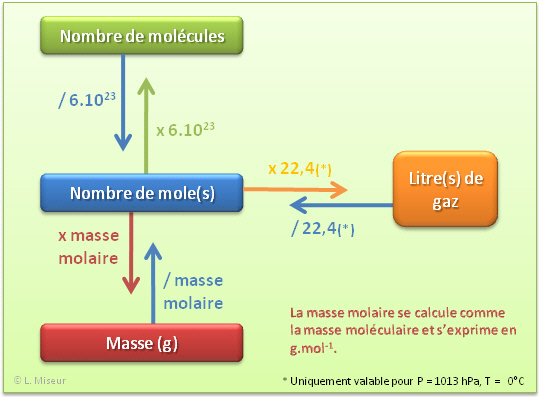
Pour faciliter le « comptage » de la matière on part du principe qu'une mole d'atomes correspond à un nombre une constante égale à 602 1023 atomes ! L'année |
|
Chapitre 5
• Un échantillon d'eau de 200 moles contient un nombre de molécules d'eau de = 200 mol × 602 × 1023mol−1 = 120 × 1024 • La quantité de matière d'une |
|
I La mole
1 Le nombre de moles et les différents types de particules D'après les - Convertir le nombre de moles en volume dans les CNTP : ( ) 2 2 25080 NO mol |
|
IIILeau
masse H Cl pur = 16 g masse eau = 9964 g nombre de moles d'eau = masse eau / 1801 = 5532 mol (Pour l'eau pure nous avions trouvé 5536 mol/l ! ) En |
|
La stoechiométrie
3- Quelle masse (g) d'hydrogène et combien de moles d'oxygène sont nécessaires à la formation de 3L d'eau? N B 1 litre d'eau équivaut à une masse de 1000g 1 |
|
Quelques rappels sur les calculs de quantités et de concentrations
ex : solution d'albumine à 1 : 1 g d'albumine pour 100 g de solvant concentration molaire = molarité : concentration en soluté exprimée en nombre de moles de |
Comment calculer la mole de l'eau ?
Matière et matériaux
1 mole d'eau (c'est-à-dire environ 6.1023 molécules d'eau, ce nombre est le nombre d'Avogadro, noté N) pèse 18 g, et occupe, à l'état liquide, un volume de 18cm3.
Dans un volune "V" (en cm3) d'eau, il y a donc V/18 * N molécules d'eau.Quel est le nombre de moles d'eau contenues dans 1 l d'eau ?
Un litre d'eau pèse 1000 g à 25° C.
La concentration molaire de l'eau est égale à 1000 / 18 = 55,5 moles par litre (55,5 mol/l ou 55,5 M).Comment calculer les mol par litre ?
Unités.
Dans le Système international, la concentration molaire s'exprime en moles par mètre cube (mol/m3 ou mol⋅m−3), mais on utilise plus couramment les moles par litre (mol/l ou mol⋅l−1) : 1 mol/l = 1 000 mol/m.- La formule n=mM n = m M permet de calculer le nombre de moles d'une substance à l'aide de sa masse et de sa masse molaire.
Une salière contient 97,02 g 97 , 02 g de chlorure de sodium (NaCl), communément appelé sel de table.
Quelle est la quantité de chlorure de sodium en nombre de moles?
|
Travaux Dirigés de Licence – HLCH 101- Chimie Générale – 2018/19
2.7- La solubilité de l'éther dans l'eau est de 69 g·L-1. Combien de moles d'éther peut-on solubiliser dans. 1 litre d'eau ? Comparer ce chiffre au nombre |
|
1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
Concentration molaire : combien y a-t-il de moles dans un litre c = n. V. Exercices a) Nous ajoutons 25 g de NaCl (sel de cuisine) dans 5 litres d'eau. |
|
Travail dirigé 5 : La concentration dune solution
17. Calculer la concentration molaire de la solution obtenue en mélangeant 200 mL d'eau à 50. mL de NaOH 5 mol.L-1. Quel est le facteur de dilution ? |
|
Chapitre 1 La quantité de matière la concentration molaire et le
Avec NA la célèbre constante de M. Avogadro qui s'exprime en mol–1. par mole |
|
Les équilibres- exercices supplémentaire avec correction -2017
Si à t=0 |
|
Td corriges biochmv 2014-2015.pdf
a) On ajoute 10-3 mole de HCl (acide fort) dans un volume final de 1 L d'eau. Quelle est la variation de pH que l'on observe ? pH initial = 700 (eau). pH |
|
III..Leau
5536 mol/l. Equation 1: concentration formelle de l'eau dans l'eau pure ... Or |
|
Module 1.1 : Révision
1.1.1. Combien y a-t-il d'atomes de chlore dans 300 g de trichlorure de phosphore 10-3 mol de caféine par litre de café. ... c) 1 |
|
Module 1.4 : Volumes de gaz
a) Déterminer le volume en Litre correspondant à 1 m3 Combien y a-t-il de moles de gaz carboniques dans 42 L de ce gaz pris aux conditions standards ? |
|
Chapitre 1 La quantité de matière la concentration molaire et le
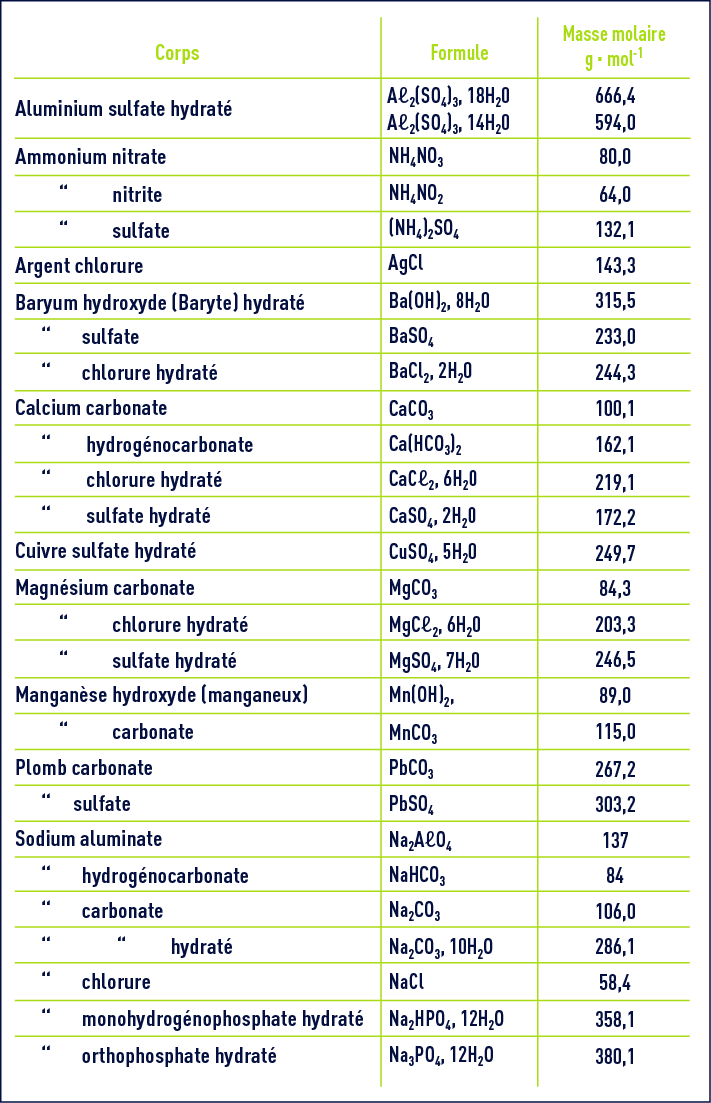
le gramme par mole notée g mol–1 Ainsi la masse molaire de la molécule d'eau H2O est : M(H2O) = 2 x M(H) + M(O) = 2 x 100 + 160 = 180 g mol–1 |
|
Calculer une quantité de matière
Pour une espèce dissoute en solution : n = C × V C la concentration s'exprime en moles par litre (mol L–1) ; V le volume s'exprime en litres (L) |
|
A) Donner la définition de la molarité dune solution b) Calculer la
Une solution qui contient une mole par litre est une solution molaire La molalité est la concentration exprimée en moles par kg d'eau Une solution qui |
|
La Mole et la Concentration Molaire Superprof
Avis 43 |
|
Les solutions
Une masse de 18 gramme d'eau en contiendra 18 / 18 = 01 mole (01 nombre de moles particulaires ( molécules ou ions) par litre de solutions ? |
|
IIILeau
5536 mol/l Equation 1: concentration formelle de l'eau dans l'eau pure Or dans un litre d'eau des 5536 moles « initialements présentes » 2 10 |
|
Chimie quantitative – mole masse molaire volume molaire
3) Quel est le nombre de moles contenues dans 234 g de chlorure de 1 1846 mg de K2CrO4 est dissout dans de l'eau pour former 2500 ml de solution |
|
Concentration molaire - Wikipédia
Dans la vapeur d'eau à 100 °C sous 1 atm ce même volume vaut 306 l donc la concentration de l'eau y est 0033 mol/l soit 1 700 fois moins que dans l'eau |
Comment trouver des mol par litre ?
L'équation pour la concentration molaire est �� = �� �� , où �� est la quantité de matière du soluté en moles, �� est la concentration molaire exprimée typiquement en moles par litre et �� est le volume de la solution, typiquement exprimé en litres.Comment calculer le nombre de moles de l'eau ?
L'eau est composé de 2 hydrogènes et 1 oxygène, donc la masse molaire de la molécule serait de 1.008g/mol x 2 + 16.00g/mol = 18.016g/mol. Cela veut dire que pour chaque 18.016g d'eau, tu as 1 mol d'eau.C'est quoi une mole d'eau ?
1 mole d'eau (c'est-à-dire environ 6.1023 molécules d'eau, ce nombre est le nombre d'Avogadro, noté N) pèse 18 g, et occupe, à l'état liquide, un volume de 18cm3.- Pour trouver le nombre de moles de NaOH, il faut déterminer la masse molaire moléculaire du NaOH. Pour ce faire, il faut additionner la masse de chacun des éléments qui forment la molécule. Ensuite, il est possible de déterminer le nombre de moles.
Comment calculer des moles par litre ?
Quel est le nombre de moles d'eau contenues dans 1 l d'eau ?
. La concentration molaire de l'eau est égale à 1000 / 18 = 55,5 moles par litre (55,5 mol/l ou 55,5 M).
Comment calculer la mole de l'eau ?
. La masse d'une mole d'eau est donc la masse molaire de l'oxygène et 2 fois la masse molaire de l'hydrogène soit : M(H2O) = 2M(H) + M(O) soit M(H2O) = 2 × 1,0 + 16,0 = 18 g·mol-1.
Comment calculer le nombre de moles ?
. Ensuite, il est possible de déterminer le nombre de moles.
|
Quantités de matière et concentration molaire
utilisent les quantités de matière exprimée en mol et surtout pas en gramme L- 1 Correction Application 1 10 mol de glucose dans 500 mL d'eau C = 20 10 |
|
Chapitre 1 : Pourquoi et comment mesurer des - Physagreg
Le nombre d'Avogadro définie le nombre d'entité dans une mole : 6 023*10 ml d'un volume V de ce liquide par la masse me d'un même volume d'eau e l e l |
|
Volume molaire
23 oct 2009 · Le volume, tout comme l'entropie ou encore l'énergie libre de Gibbs, est une Pour un mélange binaire (ici eau – éthanol) avec nA moles de solvant le volume total de la solution divisé par le nombre de moles de chaque |
|
Molarité, molalité - e-fisio
La molalité est la concentration exprimée en moles par kg d'eau L'osmolarité d 'une solution est le nombre de moles de particules en solution dans 1 litre |
|
Quelques rappels sur les calculs de quantités et de - e-fisio
Unité : mole L-1 ; symbole : M concentration molale = molalité : concentration exprimée en nombre de moles de soluté par d'albumine pour avoir une concentration massique de 3 g pour 100 g (= 10-1L) d'eau ? 1g soluté Q = 1 1 310g L |
|
IIILeau
L'eau a) Concentrations réelles et formelles La concentration molaire réelle d' une espèce chimique, notée [ ] , se calcule en divisant le nombre de moles de |
|
CONCENTRATION MOLAIRE ET SOLUTIONS AQUEUSES ⇒ ⇒
La concentration molaire est la quantité de matière de soluté dans un litre de solution On a donc : C = 8,00 10 -2 mol L -1 L'ammoniac dans l'eau 1 Quantité |
|
Exercice 4 : Correction :
[ ]=10−7 mol l−1 1 On calcule la quantité d'ions H3O+ contenus dans un litre d 'eau Dans 1l d'eau, le nombre N H3O+ d'ions H3O+ est : N H3O+ = H3O+ |