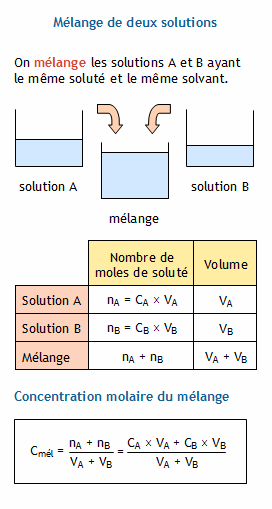
concentration oh- en fonction du ph
|
Diagrammes potentiel-pH
écrit en milieu acide : Zn(OH) 2(s) +2H + (aq) +2e = Zn (s) +2H 2 O (l) La loi de Nernst donne : E = E (Zn(OH) 2 /Zn )+ RT 2F ln[H +]2 = E (Zn(OH) 2 /Zn ) 0;06 pH (4) La frontière est donc une fonction a ne de pente - 006 et d'ordonnée à l'origine le potentiel apparent E (Zn(OH) 2 /Zn ) 4 Finalement on superpose le diagramme E-pH de l |
| Equilibres chimiques et calcul du pH dune solution |
|
Méthodes de calcul des pH
6 40 1 pH 3 13 log0 135 2 00 2 4 2 Cas particulier : H2SO4 4 3 Sel d’acide fort et de base faible La première ionisation est totale On calcul le pH en utilisant la formule des acides forts et exprimant la concentration en molarité |
|
§ 7 (suite) Calcul du pH de solutions
l’autoprotolyse de l’eau à la concentration en H 3O+ ou en OH– est négligeable On a alors pour les solutions de l’acide fort et de la base forte respectivement : [H 3O+] ≈ c a et [OH–] ≈ c a 㱺 [H 3O+] ≈ K e⋅(c0)2 / c a Si au contraire c a est très petit et en particulier |
|
© 2002 Université de Liège Département de Chimie Groupe
En combinant les relations (1) (2) et (3) on calcule aisément les concentrations de toutes les espèces présentes dans l'eau pure : - KW = [ H3O +] [ OH -] = 10 10-14 (mol/L)2 = [ H 3O +]2 = [ OH -]2 D'où [ H3O +] = [ OH -] = 10 10−14 (mol/L)2 = 10 10-7 mol/L - de l'équation (2) on peut déduire la concentration en molécules d'eau |
Quelle est la relation entre le pH et la concentration en quantité de matière d'ions oxonium ?
Les relations entre le pH et la concentration en quantité de matière d'ions oxonium sont pH = – log [ H 3 O +] et [ H 3 O +] = 10 –pH . Le pH permet de mesurer l’acidité ou la basicité d’une solution. Le pH est un nombre sans unité compris entre 0 et 14. basique si son pH est compris entre 7 et 14.
Comment calculer le pH ?
(1+2–3) Ka Ka’ = Ke / Kb’ Ke Kg Théoriquement, le calcul du pH dans ce cas est toujours possible. Il suffit de faire la liste des espèces présentes en solution, d’écrire les relations entre les concentrations (constantes d’équilibre, bilan de charges et bilan de masses) et d’exprimer toutes ces concentrations en fonction de [H3O+].
Comment calculer le pH d'une solution ?
Le pH d’une solution est lié à la concentration en quantité de matière d'ions oxonium. Les relations entre le pH et la concentration en quantité de matière d'ions oxonium sont pH = – log [ H 3 O +] et [ H 3 O +] = 10 –pH . Le pH permet de mesurer l’acidité ou la basicité d’une solution. Le pH est un nombre sans unité compris entre 0 et 14.
Quelle est la contribution de l'autoprotolyse à la concentration en H3O+ ou Oh– ?
Si la concentration d’un acide ou d’une base en solution est suffisamment grande, la contribution de l’autoprotolyse de l’eau à la concentration en H3O+ ou OH– peut être négligée. Dans le cas de la solution d’un acide suffisamment concentré, [OH–] peut être négligée dans l’expression du bilan de charges.
![Calculating pH from [OH-] hydroxide Concentration Calculating pH from [OH-] hydroxide Concentration](https://pdfprof.com/FR-Documents-PDF/Bigimages/OVP.pTwbohS89Edh_NntCt9oiAHgFo/image.png)
Calculating pH from [OH-] hydroxide Concentration

How to Calculate Hydroxide ion (OH-) Concentration from pH
![Calculating pH & pOH [H+] [OH-] Acids & Bases CLEAR & SIMPLE Calculating pH & pOH [H+] [OH-] Acids & Bases CLEAR & SIMPLE](https://pdfprof.com/FR-Documents-PDF/Bigimages/OVP.ygZ6IG9_EeKRxre_Sn00jQHgFo/image.png)
Calculating pH & pOH [H+] [OH-] Acids & Bases CLEAR & SIMPLE
|
Cours de Chimie - Informatique Titrage acide/base
17 avr. 2013 tion du graphique de l'évolution du pH en fonction du volume de réactif ... Le calcul de la concentration en OH? utilise la quantité d'ions ... |
|
PH et pKa
Une solution contenant un acide fort a un pH inférieur à celui d'une solution de même concentration d'un acide faible. ([HCl] 0.1 M pH < 1; [CH3COOH] 0.1 M |
|
COURS DE CHIMIE GENERALE Semestre 1 SVI
l-1 la concentration des ions. OH- est 1 |
|
Effets de lutilisation de la soude caustique lors de la stabilisation d
3 déc. 2015 La concentration en ions OH- initiale de la solution d'hypochlorite (1E-5 mol/L à pH 9) peut être négligée dans. |
|
Transformations chimiques en solution aqueuse
COMPLEMENTS : ETUDE DE LA SOLUBILITE DE L'YDROXYDE EN FONCTION DU PH DE LA SOLUTION (solution diluée / confusion activité et concentration/c°). |
|
Chapitre 1 Acides et bases
liminaire la concentration unitaire C0 est omise. de référence interne est alors une fonction linéaire du pH de la solution. Il est nécessaire. |
|
Formation et stabilitii de complexes hydroxo-ammonio en solution
fonction du pH et de la concentration totale d'un ligand en solution. SolubilitC de Zn(OH) en fonction du pH en presence de NH3 0.02 M. Solution. pH. |
|
Td corriges biochmv 2014-2015.pdf
concentration C = 010 mol/L. Le laboratoire dispose d'un flacon de cristaux de b) Indiquer |
|
Transformations chimiques en solution aqueuse
pH. Fe(OH)3(s). Fe3+. (aq). Fe2+. (aq). Fe(s). Fe(OH)2(s). Concentration de contenant le même élément chimique en fonction du pH et du potentiel de la ... |
|
§ 7 (suite) Calcul du pH de solutions - EPFL
Si la concentration d'un acide ou d'une base en solution est suffisamment grande la contribution de l'autoprotolyse de l'eau à la concentration en H3O+ ou OH– |
|
PH et équilibres acido-basiques en solution aqueuse
Lors de l'étude des propriétés acido-basiques des solutions aqueuses on est souvent amené à faire des calculs de concentrations et de pH Ces calculs |
|
PH et pKa - The Zysman-Colman Group
Une solution contenant un acide fort a un pH inférieur à celui d'une solution de même concentration d'un acide faible ([HCl] 0 1 M pH < 1; [CH3COOH] 0 1 M |
|
COURS DE CHIMIE GENERALE Semestre 1 SVI
Exemple : soit la solution de NaOH de concentration C = 10-8 mol l-1 la concentration des ions OH- est 1051×10-7 M le pH de la solution est pH = 14 - pOH |
|
Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Exemple : soit la solution de NaOH de concentration C = 10-8 mol l-1 la concentration des ions OH- est 1051×10-7 M le pH de la solution est pH = 14 - pOH |
|
Les relations entre le pH et la concentration en ions oxonium
Objectif Déterminer la valeur du pH d'une solution à partir de la valeur de sa concentration en quantité de matière d'ions oxonium H3O+ et inversement |
|
Formules de pH des solutions diluées
b OH - = et [ ] b C B = la concentration totale en base On se propose d'établir les formules de pH en fonction de la concentration Cb |
|
Chapitre 1 Acides et bases
liminaire la concentration unitaire C0 est omise Une solution aqueuse est dite : — neutre si son pH vaut 7 i e [H3O+]= 10?7 mol L?1 (à 25?C) ; |
|
Calculer la concentration en ions H3O+ ou en ions OH- à partir du
Avis 45 |
|
La relation entre le pH et la concentration des ions hydronium (H+)
Les mesures du pH et du pOH correspondent à différentes valeurs de concentrations en ions H+ ou en ions OH- respectivement |
Comment calculer concentration OH avec pH ?
A partir de cette concentration en ions hydroxyde, il est possible de calculer le pOH de la solution : pOH = - log([OH-]) = - log(1.10-2) = 2 Pour finir, en utilisant la relation qui lie le pH au pOH, il est possible d'en déduire le pH de cette solution : pH = 14 - pOH = 14 - 2 = 12 Ainsi, le pH de la solution est égalComment calculer la concentration de Ho ?
La concentration en ions OH? est de 5??11 mol/L 5 × 10 ? 11 mol/L . L'exemple suivant montre comment utiliser la constante d'ionisation de l'eau pour connaître la concentration molaire d'un ion présent quand la concentration de l'autre ion est connue.Quels sont le pH et le caractère d'une solution acide ou basique si OH -] 0 00002 Mol l-1 ?
Quels sont le pH et le caractère d'une solution si [ OH- ] = 0,00002 mol. -1 ? 4°. ?helle de pH : Sur l'échelle des pH, l'acidité ne varie donc que de 0 à 14.Formule de calcul de pH
1Pour un acide fort : pH = - log C.2Pour une base forte: pH = 14 + log C. Ces formules sont valables pour les concentrations supérieures à 10-7 mol/L.3Pour un acide faible : pH = 1/2 pKa - 1/2log C.4Pour une base faible : pH = 7 + 1/2 pKa + 1/2log C. 5pH = 1/2( pKa1 + pKa2)
Comment calculer la concentration en ions HO ?
. On insère la valeur de �� �� et la valeur de la concentration en ions hydrogène donnée dans le problème.
Quel lien Existe-t-il entre la concentration d'ions H+ et le pH d'une substance ?
. L'échelle pH est utilisée pour déterminer le degré d'acidité d'une substance. Elle représente la concentration des ions H+ dans une solution.
. Plus une substance contient d'ions H+ , plus elle est acide.
Quelle est la relation entre le pH et l'acidité ?
|
Quelques rappels sur les calculs de quantités et de concentrations
concentration massique est parfois exprimée en pourcentage : de masse de soluté sur la masse de solvant ex : solution d'albumine à 1 : 1 g d'albumine pour |
|
Cinétique chimique - UNF3S
admet un ordre si l'expérience montre qu'à température constante, la vitesse volumique de la réaction peut s'exprimer en fonction des concentrations en réactifs |
|
Quantité de matière, concentrations et dilution - mediaeduscol
massique d'une solution ou de la densité • Déterminer la concentration molaire en fonction de la masse prélevée, de la masse molaire et du volume |
|
Conductivite theorie et pratique - IGZ Instruments
La première étape dans les mesures de concentration est de connaître la conductivité de la solution en fonction de la concentration de l'espèce qui nous intéresse |
|
EQUILIBRE CHIMIQUE & ACTIVITÉ
21 oct 2009 · n'influençant pas l'équilibre, est ajouté à diverses concentrations dilués, on peut exprimer l'activité en fonction de la concentration et la |
|
TP15 : Conductimétrie
23 sept 2009 · Nous verrons aussi que la concentration des ions influe sur la conductivité Aprè avoir solution en fonction de la polarité du solvant |
|
TP : Détermination de la concentration en glucose dune boisson de
nuancée en fonction de la concentration en glucose de la solution testée A partir de solutions de concentrations connues, on peut établir une gamme de |
|
EQUILIBRES CHIMIQUES CINETIQUE CHIMIE EN SOLUTION
potentiel chimique en fonction de T et p, la différentielle totale de cette égal à V La concentration initiale est c0 = n0/V et la pression s'écrit : p = c0(1 + ")RT |