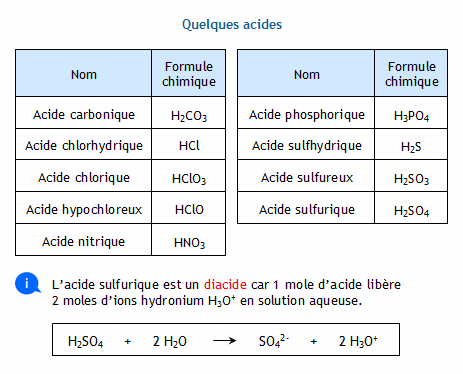
calcul concentration oh- avec ph
|
Méthodes de calcul des pH
On a aussi les relations suivantes : pH pK pOH pH pOH w 14 Méthodes de calcul des pH Cas Système Formule Exemple 1 Eau pure 2H O H O OH23 pH 7 2 Solution d’acide fort monofonctionnel HX H O H O X23 Les acides forts sont totalement dissociés pH C log C = concentration molaire en acide |
|
PH DES SOLUTIONS AQUEUSES I Généralités
Le pKa estime la force d’acidité ou de basicité des espèces chimiques à caractère acidobasique |
|
Success 24/7 Chemistry: pH pOH [H ] & [OH ] Calculations
pH = -log[H+] [H+] = antilog (-pH) pOH = -log [OH-] [OH-] = antilog(-pOH) There are 2 equations that can be used to go between the hydrogen scale and hydroxide scale pH + pOH = 14 [H+][OH-] = 1 0 x 10 14 Examples: pH = 2 54 pOH = _____ Acid or Base? _____ The concentration of a HCl solution is 0 00054 M What is the hydroxide ion concentration? |
Comment calculer le pH et le pOH ?
pH + pOH = 14 (Eq. 3) Cette équation est utilisée pour passer du pH au pOH . En association avec les équations Eq. 1a/b et Eq. 2a/b, on relie le pOH et/ou le pH aux concentrations [ OH −] et [ H 3 O +] .
Quelle est la relation entre le pH et la concentration en quantité de matière d'ions oxonium ?
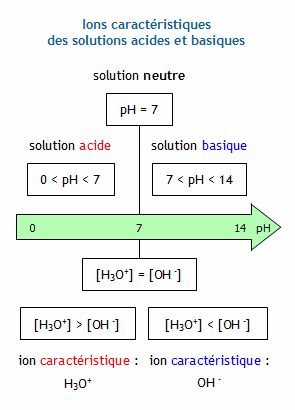
Les relations entre le pH et la concentration en quantité de matière d'ions oxonium sont pH = – log [ H 3 O +] et [ H 3 O +] = 10 –pH . Le pH permet de mesurer l’acidité ou la basicité d’une solution. Le pH est un nombre sans unité compris entre 0 et 14. basique si son pH est compris entre 7 et 14.
Comment calculer le pH d’un acide ?
La première ionisation est totale. On calcul le pH en utilisant la formule des acides forts et exprimant la concentration en molarité. 5. Solution de base faible Se dissocie en un acide de force nulle et la base conjuguée à l’acide.
Comment calculer le pH d'une solution d'acide fort ou de base forte ?
Calcul du pH d'une solution d'acide fort ou de base forte. Relation entre la force d'un acide et le pH de la solution. pH + pOH = 14 . unité, et vice versa. . En solution aqueuse, un acide est défini comme un composé qui augmente la concentration en H 3 O + ( a q) , alors qu'une base augmente la concentration en OH − ( a q) .
3. ÉCHELLE DU pKa
Le pKa estime la force d’acidité ou de basicité des espèces chimiques à caractère acidobasique. univ.ency-education.com
6. MESURE EXPÉRIMENTALE DU pH
La mesure du pH peut s’effectuer avec : des indicateurs colorés : directement en solution – avec du papier pH – ou des bandelettes pH. ou avec un pH-mètre. univ.ency-education.com
DÉMARCHE UTILISÉE POUR CALCULER LE pH :
Établir les réactions de dissociation Ecrire l’équilibre de l’eau : les constantes sont toujours vérifiées : Ke, Ka et Kb Ecrire le bilan massique : BM Ecrire le bilan électrique : BE Dans le cas des solutions complexes (coexistence de plusieurs espèces) ; l’équation obtenue est souvent difficile à résoudre, dans ce cas on peut envisager des approx
III. Équations de pH des solutions de mélanges
Mélange de protolytes de même nature Mélange de deux acides forts ou de deux bases fortes Mélange d’acide fort et d’acide faible ou de base forte et d’acide faible Mélange de deux acides faibles ou de deux bases faibles Mélange de protolytes de natures différentes (solutions de sels) Mélange d’acide fort et de base forte Mélange d’acide faible
Dans un mélange, il est important de considérer :
La dilution des diverses espèces dans la solution du mélange (variation des concentrations par dilution) univ.ency-education.com
Dans un mélange de protolytes de même nature, il est important de considérer :
L’addition d’ions communs à l’origine du déplacement des équilibres acido-basiques dans le sens de leur consommation et la diminution des coefficients de dissociation univ.ency-education.com
Dans un mélange de protolytes de natures différentes, il est important de considérer :
La consommation de l’espèce acide par la base si la « normalité » de l’acide est inférieure à celle de la base et inversement. univ.ency-education.com
Cas le plus général
Remarque nécessaire pour le calcul du pH dans les cas suivants univ.ency-education.com
[OH−] ≪ [H3O+] => (BE) [H3O+] = CA ̅̅̅̅ − CB ̅̅̅̅
pH de la solution imposé par l’acide fort en excès. = − (̅̅̅ − ̅̅̅) univ.ency-education.com
[H3O+] ≪ [OH−] => (BE) [OH−] = CB ̅̅̅̅ − CA ̅̅̅̅
pH de la solution imposé par la base forte en excès. pH = pKe + log(CB ̅̅̅ − CA ̅̅̅̅) univ.ency-education.com
(BM) (BE)
(Kaa) CA ̅̅̅̅ = [aH] + [a−] et CB ̅̅̅̅ = [BH+] univ.ency-education.com
1/ Cas où l’acide est en excès (̅̅̅ > ̅̅̅)
Coexistence de l’acide faible et de sa base conjuguée (pH d’une solution tampon) univ.ency-education.com
[H3O+]
KaA(CA ̅̅̅̅−CB ̅̅̅̅) (Kaa) CB ̅̅̅̅ = Équation d’Henderson Hasselbach univ.ency-education.com
[H3O+] ≪ [OH−] => (BE) [OH−] = CB ̅̅̅̅ − CA ̅̅̅̅
Le pH est imposé par le mélange : excès de la base forte (CB ̅̅̅̅ − CA ̅̅̅̅) + base conjuguée de l’acide faible (CA ̅̅̅̅). (Voir pH de solution de mélange de protolytes de natures différentes – Cas d’un mélange de base forte et de base faible). univ.ency-education.com
3/ Cas où l’acide et la base sont en quantités égales (̅̅̅ = ̅̅̅)
Dissociation totale de l’acide => pH imposé par la base conjuguée “a-“ formée de l’acide faible (CA ̅̅̅̅). (Voir pH de solution simple de base faible). c. Mélange d’acide fort AH et de base faible b univ.ency-education.com
(BM) (BE)
(Kbb) CA ̅̅̅̅ = [A−] et CB ̅̅̅̅ = [b] + [bH+] univ.ency-education.com
[H3O+] + [bH+] = [A−] + [OH−]
= [ −][bH+] [b] Coexistence de la base faible et de son acide conjugué (pH d’une solution tampon) univ.ency-education.com
2/ Cas où l’acide est en excès (̅̅̅ > ̅̅̅)
(Voir pH de solution de mélange de protolytes de natures différentes – Cas d’un mélange d’acide fort et d’acide faible). univ.ency-education.com
3/ Cas où l’acide et la base sont en quantités égales (̅̅̅ = ̅̅̅)
(Voir pH de solution simple d’acide faible). d. Mélange d’acide faible aH et de base faible b univ.ency-education.com
(BM) [aH] = CA ̅̅̅̅ − CB ̅̅̅̅
et [a−] = [bH+] = CB ̅̅̅̅ En remplaçant dans (KaA): = ̅̅̅ + ̅̅̅ − ̅̅̅ univ.ency-education.com
(BM) [b] = CB ̅̅̅̅ − CA ̅̅̅̅
et [a−] = [bH+] = CA ̅̅̅̅ En remplaçant dans (Kab): CB ̅̅̅ − CA ̅̅̅̅ pH = pKaB + log ̅̅̅̅ CA univ.ency-education.com
Cas d’une solution simple d’ampholyte (Soit NaAH)
(analogie avec le cas d’une solution de mélange d’acide faible et de base faible) NaAH → Na+ + AH- univ.ency-education.com
|
Cours de Chimie - Informatique Titrage acide/base
17 avr. 2013 tion du graphique de l'évolution du pH en fonction du volume de réactif ... Le calcul de la concentration en OH? utilise la quantité d'ions ... |
|
PH et pKa
de même concentration d'un acide faible pH d'un mélange d'acide faible avec sa base conjuguée il faut négliger [OH-] par rapport à [A] et [B]. |
|
§ 7 (suite) Calcul du pH de solutions
Si la concentration d'un acide ou d'une base en solution est suffisamment grande la contribution de l'autoprotolyse de l'eau à la concentration en H3O+ ou OH–. |
|
COURS DE CHIMIE GENERALE Semestre 1 SVI
CALCUL DE PH DES SOLUTIONS AQUEUSES. 2.1. Cas d'un acide fort Le Bore existe sous forme de deux isotopes 10B et 11B avec les proportions respectives de. |
|
Td corriges biochmv 2014-2015.pdf
avec C=concentration molaire en mol/L EXERCICE 2 : Calculer le pH d'une solution 01 mol/L d'acide butyrique dont le Ka est ... H-COOH + K-OH. |
|
Ex1) voici les concentrations de solutions dhydroxyde de potassium
Ex4) Calculer la concentration d'une solution d'hydroxyde de sodium de pH égal à les concentrations de solutions d'hydroxyde de potassium (K+ OH? ) :. |
|
UNIVERSITE P
Calculer le pH d'une solution de concentration C1 = 10-4 mol L-1. On justifiera les approximations utilisées. pH=4 on a bien [H3O+]>>[OH-]. |
|
Transformations chimiques en solution aqueuse
légèrement dissocié en équilibre avec ses ions constitutifs en solution aqueuse. Calculer le pH de début de précipitation de l'hydroxyde Al(OH)3(s) . |
|
Dosage acide faible – base forte
OH. HA. 3. 2. Base forte NaOH titrant concentration cb volume vb (à verser à la burette) : Pour étudier la variation du pH en fonction de vb on utilise. |
|
§ 7 (suite) Calcul du pH de solutions - EPFL
Si la concentration d'un acide ou d'une base en solution est suffisamment grande la contribution de l'autoprotolyse de l'eau à la concentration en H3O+ ou OH– |
|
Calculer la concentration en ions H3O+ ou en ions OH- à partir du
Avis 45 |
|
I Calcul du pH
La solution où son pH < 7 est une solution acide Exemple 2 : Calculer le pH d'une solution basique de concentration en ion hydroxyde OH - |
|
Les relations entre le pH et la concentration en ions oxonium
Objectif Déterminer la valeur du pH d'une solution à partir de la valeur de sa concentration en quantité de matière d'ions oxonium H3O+ et inversement |
|
Valeur-du-pHpdf - archimede
Calculer le pH de chacune des solutions et préciser leur nature acide ou basique [H3O+] mol L-1 [HO-] mol L-1 12x10-2 |
|
PH et pKa - The Zysman-Colman Group
[OH-] est très négligeable devant [B] pH = 7 + ½pKa + ½log [B] pH d'un mélange d'acide faible avec sa base |
|
Exercice 2 : « Concentration en soluté et pH »
Exercice 2 : « Concentration en soluté et pH » On prépare une solution aqueuse acide avec 063 g d'acide nitrique (HNO3) dissous dans 1000 mL d'eau |
|
Equilibres acide/base - Faculté des Sciences de Rabat
1) Calculer dans ce cas le pH d'une solution neutre 2) Déterminer à pH= 3 la concentration des anions hydroxyles (OH-) Corrigé 1) Le produit ionique |
|
Calculs de pH - AlloSchool
Considérons un acide fort mis en solution aqueuse à la concentration initiale c Notons h la concentration des ions H3O+ et ? la concentration des ions OH? |
Comment calculer concentration OH avec pH ?
A partir de cette concentration en ions hydroxyde, il est possible de calculer le pOH de la solution : pOH = - log([OH-]) = - log(1.10-2) = 2 Pour finir, en utilisant la relation qui lie le pH au pOH, il est possible d'en déduire le pH de cette solution : pH = 14 - pOH = 14 - 2 = 12 Ainsi, le pH de la solution est égalComment calculer la concentration en ions HO ?
Si on divise les deux côtés de l'expression de �� �� par la concentration en ions hydrogène, on obtient une équation qui permet de déterminer la concentration en ions hydroxyde. On insère la valeur de �� �� et la valeur de la concentration en ions hydrogène donnée dans le problème.Quelle est la relation entre l'acidité et le pH ?
La valeur du pH se mesure sur une échelle de 0 à 14, où 7 est neutre et toutes les valeurs inférieures à 7 sont acides et l'acidité augmente au fur et à mesure de la diminution de la valeur et où toutes les valeurs au-delà de 7 sont alcalines et l'alcalinité augmente au fur et à mesure que la valeur augmente.- La concentration d'ions H+ est très faible dans le plasma, et finement régulée. La concentration d'H+ est exprimée sous sa forme logarithmique inverse (pH=Log 1/[ H+ ]). Le pH artériel normal varie entre 7,38 et 7,42. Un pH bas définit une concentration d'H+ élevée et une situation d'acidémie.
Comment calculer la concentration en ions HO ?
. On insère la valeur de �� �� et la valeur de la concentration en ions hydrogène donnée dans le problème.
Comment calculer la concentration de l'acide ?
. La concentration d'une solution ou la concentration molaire est le rapport entre la quantité de soluté en moles par volume de solution, pouvant être calculée par l'équation suivante : �� = �� �� , où �� est la concentration molaire, �� est la quantité de matière de soluté en moles et �� est le volume de la solution.
Comment calculer la molarité des ions OH ?
|
Quelques rappels sur les calculs de quantités et de concentrations
comment calculer un volume de dilution ? Connaissant la masse de produit et la concentration finale voulue, on veut déterminer le volume dans lequel diluer le |
|
Calcul de la concentration en polluants - INRS
http://www inrs fr/dms/inrs/PDF/metropol-resultat-calcul-concentration pdf 1 / 4 Calcul de la Quantification avec changement de structure chimique |
|
Chimie
A Calcul de la concentration à partir de la masse de soluté et du volume de solution une dilution de 1,00 ml de solution mère avec 20,00 ml de solvant ; |
|
Travail dirigé 5 : La concentration dune solution - Unité AFO
la dilution d'une solution (avec ou sans ions communs) - le facteur de Calculer la concentration molaire d'une solution dont un volume de 50 mL contient 0,01 |
|
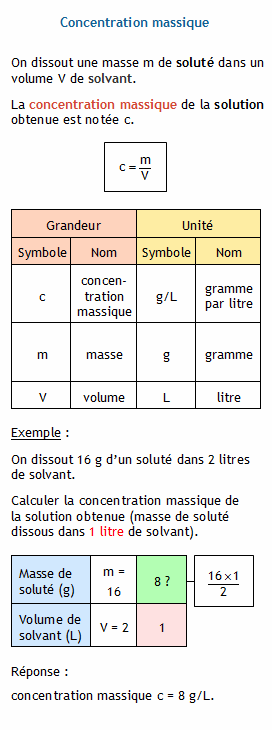
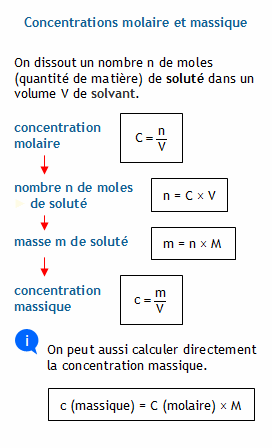
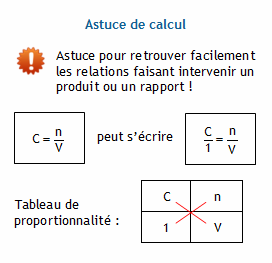
CONCENTRATIONS MOLAIRE ET MASSIQUE V nC = M mn = MV
C : concentration molaire ( en mol L-1) Calculer la concentration molaire de cette solution Avec m : masse du solide et M : masse molaire du solide |
|
Concentrations Formulespdf
Transformation du pourcentage massique en concentration molaire Concentration molaire en mol/l Pourcentage massique en 10 Masse volumique |
|
Préparation dune solution connaissant la densité de la solution m`ere
Une façon de résoudre ce probl`eme est de calculer la concentration Ci de la solution En pratique, on prél`evera 4,5 mL de la solution commerciale avec une |
|
TP : Détermination de la concentration en glucose dune boisson de
La concentration massique en glucose, c0 (en g L-1) d'une solution S0 peut se calculer à partir de la relation suivante : 0 0 V m C = avec m = masse en g de |
|
Rappel : les formules de chimie
On définit la concentration molaire C = n/ V avec n : quantité de matière (en mol) avec ρréférence = masse volumique de l'eau liquide 1 g mL-1 (pour le calcul |