ion hydroxyde ph
|
192 Hydrogen Ions and Acidity
APPLY CONCEPTS For students who have little or no experience with logarithms explain that pH is found by taking the negative of the power (exponent) of 10 that expresses the hydrogen ion concentration Show students this example: [H+] = 0 00010 = 1 0 × 10–4M; pH = –log 10(1 0 × 10–4) = 4 00 |
|
Chem 114 Exp 4 Mike
hydroxide ion concentrations The equations for these relationships are: [H +] x [OH ] = 1 0 x 10 –14 pH + pOH = 14 The following are 2 examples to show the relationships that exist between the pH the pOH the hydronium ion concentration and the hydroxide concentration Example (1) |
|
Chemistry 20 Lesson 26 pH and pOH
Chemistry 20 Lesson 26 – pH and pOH Refer to pages 238 to 244 in the Nelson text I Ionization of water Pure water has a very slight conductivity that is observable only if measurements are made with very sensitive instruments According to Arrhenius’ theory conductivity is due to the presence of ions |
|
Introduction to pH
hydrogen ion activity The pH value of a substance is directly related to the ratio of hydrogen ion [H+] and hydroxyl ion [OH-] concentrations If the H+ concentration is greater than the OH- the material is acidic; i e the pH value is less than 7 If the OH- concentration is greater than its H+ the material is basic with a pH value greater |
What is the equilibrium condition for ionization of water?
In pure water, the concentration of hydronium ions equals that of hydroxide ions. At 25 o C, the concentrations of both hydronium and hydroxide ions equal 1.0 ×10−7 1.0 × 10 − 7. The ion product of water, Kw K w, is the equilibrium condition for the self-ionization of water and is express as follows:
How do you find the pH and POH of a neutral solution?
The pH and pOH of a neutral solution at this temperature are therefore: pH = − log[H3O+] = − log(1.0 ×10−7) = 7.00 (14.2.10) (14.2.10) p H = − log [ H 3 O +] = − log ( 1.0 × 10 − 7) = 7.00 pOH = − log[OH−] = − log(1.0 ×10−7) = 7.00 (14.2.11) (14.2.11) p O H = − log [ O H −] = − log ( 1.0 × 10 − 7) = 7.00
Which ion molarities are considered basic solutions?
Basic solutions are those with hydronium ion molarities less than 1.0 ×10−7 M 1.0 × 10 − 7 M and hydroxide ion molarities greater than 1.0 ×10−7 M 1.0 × 10 − 7 M (corresponding to pH values greater than 7.00 and pOH values less than 7.00).
Is H3O+ acidic or basic?
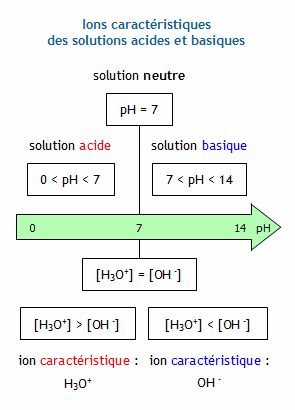
In pure water, the concentrations of the hydronium ion and the hydroxide ion are equal, and the solution is therefore neutral. If [H3O+] > [OH−] [ H 3 O +] > [ O H −], however, the solution is acidic, whereas if [H3O+] < [OH−] [ H 3 O +] < [ O H −], the solution is basic.
|
Organisation et transformations de la matière
•Si la valeur du pH est plus petite que 7 alors la solution est dite. « acide ». Une solution aqueuse basique contient plus d'ions hydroxyde. |
|
Chapitre CHIMIE – Le pH I – Les solutions acides neutres et
La formule de l'ion Hydroxyde est ……HO. - … 6. Complétez en dessous de la flèche avec les mots : ACIDE BASIQUE ou NEUTRE. pH. |
|
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Savoir repérer précisément l'équivalence dans un titrage pH-métrique (méthode des À quel couple acide/base appartient l'ion hydroxyde HO– ? |
|
CHIM105B – DS1 - Corrigé
En déduire la concentration en ions hydroxyde et le pH de la solution (pH1) pour que 99% du cobalt précipite. Si 99% du cobalt précipite sous forme d'hydroxyde |
|
H + Cl HO + Na
Le pH. - Pour savoir si une solution est ACIDE NEUTRE ou BASIQUE le chimiste -Une solution est BASIQUE si elle contient plus d'ions hydroxyde (Formule ... |
|
Effets de lutilisation de la soude caustique lors de la stabilisation d
3 déc. 2015 le pH de la solution d'hypochlorite plus alcalin (pH 11.9) afin de prévenir ... concentrations en ions sodium et hydroxyde (pH) une fois la ... |
|
Transformations chimiques en solution aqueuse
I LA REACTION DE PRECIPITATION : L'ECHANGE D'ION OU DE MOLECULE D'UN SOLIDE 3 1°) INFLUENCE DU PH : EXEMPLE DE LA SOLUBILITE DE L'HYDROXYDE D'ALUMINIUM ... |
|
Transformations chimiques en solution aqueuse
IV ETABLISSEMENT DU DIAGRAMME POTENTIEL-?PH DU FER : METHODE GENERALE 10 en milieu basique : forme basique de l'eau : ion hydroxyde HO-?. |
|
Chapitre 1 Acides et bases
acide si son pH est inférieur à 7 i.e. [H3O+]> 10?7 mol. ion hydroxyde |
|
Les acides et bases en solution aqueuse.
pH de l'eau pure et des solutions aqueuses. 4. Force des acides et des bases Dans les solutions d'hydroxydes métalliques ce sont les ions OH. |
|
Chapitre CHIMIE – Le pH I – Les solutions acides neutres et basiques
1) La solution qui contient plus d'ions Hydrogènes que d'ions hydroxydes est une solution acide donc son pH est inférieur à 7 c'est donc la solution 1 Page 4 |
|
H + Cl HO + Na
Une solution est ACIDE si elle contient plus d'ions hydrogène (Formule chimique : H+) que d'ions hydroxyde (Formule chimique : HO-) Les ions hydrogène sont |
|
Ions et pH
Les ions à connaître sont les ions : hydrogène H+ hydroxyde HO- chlorure Cl- cuivre (II) Le pH évalue l'acidité ou la basicité d'une solution |
|
Le pH et sa mesure : Physique - Chimie SOLUTIONS ACIDES ET BAS
25 mai 2020 · Le domaine du pH est compris entre 0 et 14 ? Le caractère acide ou basique est associé à la présence d'ions H+ et OH- |
|
Chapitre-6-Le-pH-et-les-ions-dans-notre-quotidien-Courspdf
Une solution acide contient plus d'ions H+ que d'ions OH- Les ions responsables de l'acidité d'une solution sont les ions H+ Une solution basique contient |
|
Chapitre 1 Acides et bases
acide si son pH est inférieur à 7 i e [H3O+]> 10?7 mol ion hydroxyde ou la théorie de Lewis basée sur les doublets d'électrons libres Une même |
|
Organisation et transformations de la matière - Eduscol
Le pH est relié à la présence d'ions hydrogène H+ et d'ions hydroxyde OH- toujours présents dans une solution aqueuse Une solution aqueuse acide contient |
|
Chapitre 2 : Le pH dune solution - Tribu
7 – Quel est le nom et la formule chimique de l'ion responsable de la basicité d'une solution ? Les ions responsables de la basicité sont les ions hydroxyde de |
|
3ch4 pH des solutions aqueuses
IDENTIFICATION DE QUELQUES IONS Le pH (potentiel hydrogène) d'une solution aqueuse est Mesurer le pH d'une solution diluée d'hydroxyde de sodium pH = |
|
PH et équilibres acido-basiques en solution aqueuse
distribuer gratuitement un ou plusieurs fichiers PDF ou ZIP complets et sans modification Le pH d'une solution aqueuse d'hydroxyde de sodium vaut 117 |
Quel est le pH de l'ion hydroxyde ?
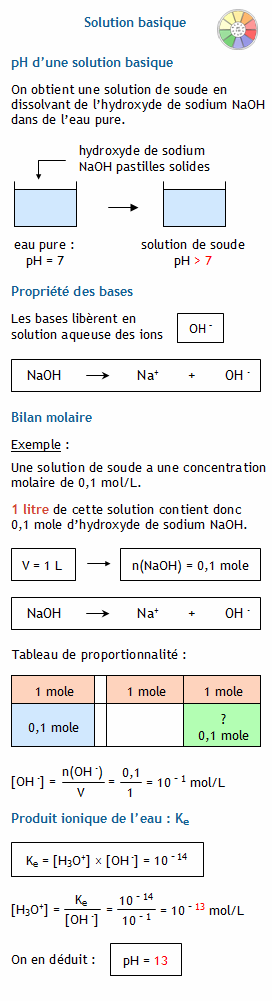
Les ions hydrogène (H+) et les ions hydroxyde (HO–) sont mis en évidence par la mesure du pH : acide pour les ions hydrogène (le pH est alors inférieur à 7). basique pour les ions hydroxyde (le pH est alors supérieur à 7).Quand le pH augmente la concentration en ions hydroxyde ?
Ainsi, plus la concentration en ions oxonium est faible, plus le pH augmente et plus la solution est basique. Inversement, plus la concentration en ions oxonium est importante, plus le pH diminue et plus la solution est acide.Quels sont les ions hydroxyde ?
L'anion hydroxyde (ou hydroxyle) se réfère à l'ion OH?. C'est un des ions polyatomiques les plus simples constitué d'un atome d'oxygène et d'un atome d'hydrogène. Il est porteur d'une seule charge électrique négative centrée sur l'atome d'oxygène.- Quels sont le pH et le caractère d'une solution si [ OH- ] = 0,00002 mol. -1 ? 4°. ?helle de pH : Sur l'échelle des pH, l'acidité ne varie donc que de 0 à 14.
Quand le pH augmente la concentration en ions hydroxyde ?
. Inversement, plus la concentration en ions oxonium est importante, plus le pH diminue et plus la solution est acide.
Quel ion augmente le pH ?
Quel est le pH de l'hydroxyde de sodium ?
. L-1.
. On applique la formule précédente : pH = 14 + log10-1.
Quels sont les ions du pH ?
. Il est lié aux concentrations des ions hydrogène \\ce{H+} et hydroxyde \\ce{OH-} .
. Lors de la dilution d'une solution, son pH se rapproche de 7.
|
LES TRANSFORMATIONS CHIMIQUES
Plus une solution est acide, plus elle contient d'ions hydrogène H+ Exemple : la solution d'acide chlorhydrique (H+ + Cl - ) L'ion hydroxyde HO- est |
|
Chap2 Tests de reconnaissance de quelques ions
En présence d'ions argent Ag+, les ions chlorure Cl- forment un précipité blanc qui noircit à la lumière En présence d'ions hydroxyde HO- : - les ions cuivre (II) |
|
La constitution de la matière – Identifier des ions
Les ions à reconnaitre Ion Formule chimique Fer II Fe2+ Fer III Fe3+ Zinc Zn2+ Chlorure Cl- Cuivre Cu2+ Sodium Na+ Hydrogène H+ Hydroxyde HO - |
|
Les ions hydroxyde et hydrogène
Conclusion: On peut classer les solutions en 3 catégories: acides, neutres ou basiques * si pH est inférieur à 7, la solution est acide et contient plus d'ions H+ |
|
Organisation et transformations de la matière - mediaeduscol
Une solution aqueuse basique contient plus d'ions hydroxyde OH- que d'ions hydrogène H+ ➡ Qu'est ce qu'un ion ? Page 26 Allons plus loin |
|
Le pH
Une solution est ACIDE si elle contient plus d'ions hydrogène (Formule chimique : H+) que d'ions hydroxyde (Formule chimique : HO-) Les ions hydrogène sont |
|
Chap 12 : LA REACTION ACIDE BASE
ions hydroxyde HO- et des ions positifs qui les accompagnent pour que la solution soit globalement neutre électriquement exemple : - la soude contient des |
|
Chap 6 VE solutions acides et solutions basiques
qu'une solution acide, il y a plus d'ions hydrogène H+ que d'ions hydroxyde HO- - qu'une 1) L'ion hydrogène H+, le responsable de l'acidité d'une solution |
|
Hydroxyde de sodium et solutions aqueuses - INRS
Dans ces conditions, le passage d'ions OH ne peut changer le pH du sang et les ions Na , réussissant à pénétrer dans l'organisme, représentent une quantité |
|
Comment mettre des ions en évidence ? - Collège Hubert Fillay
Partie n°1: Mise en évidence des ions chlorure (Cl-): >Nettoyez deux des tubes à Les ions hydroxyde (HO- ) : ils sont responsables du caractère basique |