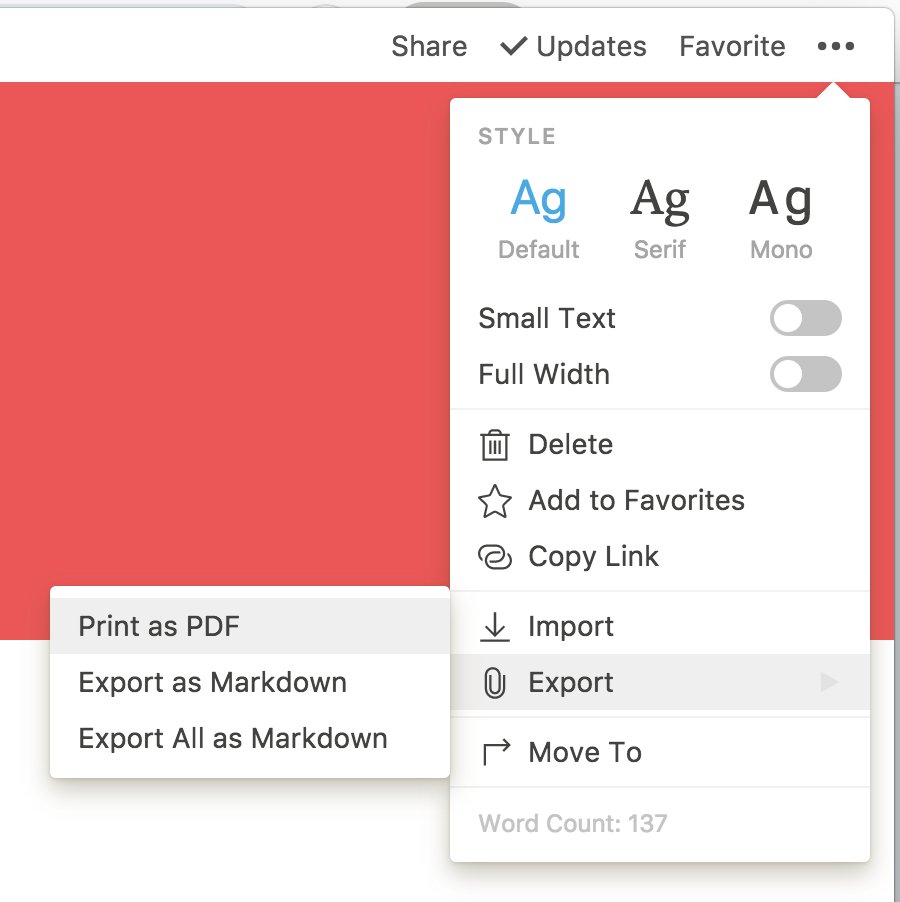
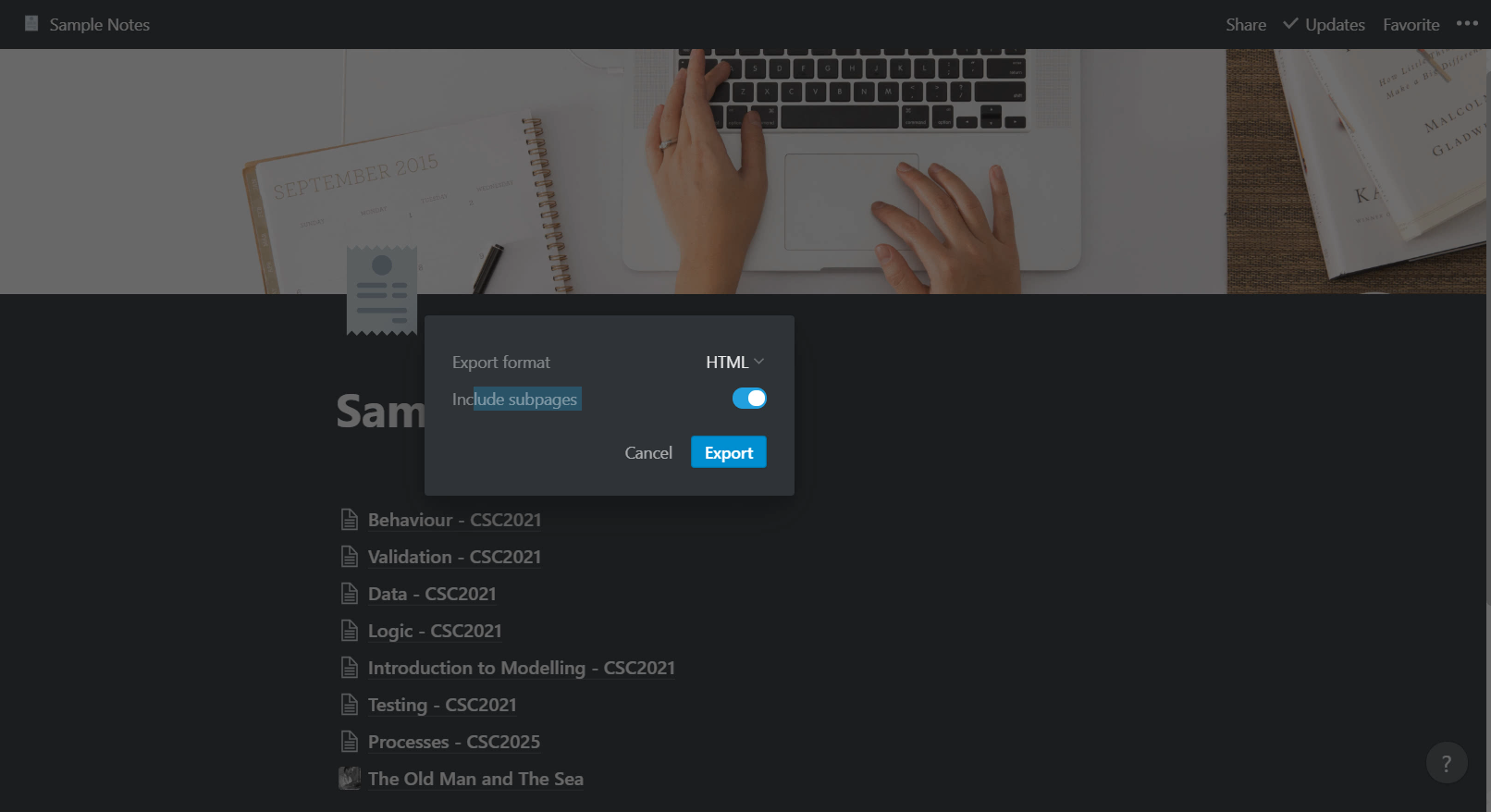
notion de ph pdf
|
Acid-Base pH Titration Introduction
The data will be displayed in the following format showing appropriate values for the slope (m) and y-intercept (b) y = mx + b m: 0 11 b: 12 35 (these are just example values) Cor = 0 98 20 Record the equation in your notebook in Data Table for pH vs Volume in the following format pH = 0 11V + 12 35 |
|
Acids and Bases Overview Chemistry 362
Arrhenius’ concept based on water Arrhenius 1880s: Acids form hydrogen ions H+(H2O)n in aqueous solution Bases form hydroxide ions in aqueous solution Examples of Arrhenius acids (in water): HCl H2SO4 etc Examples of Arrhenius bases (in water): NaOH NH3 etc Arrhenius definitions only apply to aqueous solutions |
|
Introduction to pH
pH is a unit of measure which describes the degree of acidity or alkalinity of a solution It is measured on a scale of 0 to 14 The term pH is derived from “p” the mathematical symbol for negative logarithm and “H” the chemical symbol for Hydrogen The formal definition of pH is: the negative logarithm of Hydrogen ion activity |
|
Leçon n° 5 : Notion de pH
Leçon n° 5 : Notion de pH - Les solutions acides et les solutions basiques Objectifs d’apprentissage : Connaitre la signification du pH Utiliser le papier pH et le pH-mètre pour mesurer le pH d’une solution aqueuse Classer les solutions aqueuses en solutions acides et basiques et neutres selon les valeurs du pH |
|
What Is pH and Why Do We Care?
In chemistry pH is defined as the negative logarithm of the hydrogen-ion activity More simply it is a measure of the relative amount of free hydrogen (H+) and hydroxyl ions (OH-) That is it tells the degree to which something—such as soil water or any solution—is basic or acidic pH is reported in logarithmic units like the Richter |
Quel est le rôle du pH ?
Le pH est le potentiel hydrogène ou potentiel d'hydrogénation.
Il sert à déterminer le degré d'alcalinité ou d'acidité d'un aliment – ou de tout autre type de solution – à partir de la concentration en ions hydrogène positifs dans le composé.
L'échelle du pH est comprise entre 0 et 14.Comment on calcule le pH ?
Pour calculer le pH d'une solution d'acide fort, on peut utiliser la relation "pH = -log[H₃O⁺]" en considérant que la conversion de l'acide est totale.
Pour une solution basique de concentration en ions hydroxyde donnée, on peut calculer le pH en utilisant le pOH ("pOH = -log[OH⁻]") et la relation "pH = 14 - pOH".- L'échelle de pH.
Le pH s'exprime selon une échelle logarithmique de 0 à 14 unités.
Une eau « neutre » possède un pH de 7 unités.
Un pH inférieur à 7 indique que l'eau est acide alors qu'un pH supérieur à cette valeur indique qu'il s'agit d'une eau alcaline.
3. ÉCHELLE DU pKa
Le pKa estime la force d’acidité ou de basicité des espèces chimiques à caractère acidobasique. univ.ency-education.com
6. MESURE EXPÉRIMENTALE DU pH
La mesure du pH peut s’effectuer avec : des indicateurs colorés : directement en solution – avec du papier pH – ou des bandelettes pH. ou avec un pH-mètre. univ.ency-education.com
DÉMARCHE UTILISÉE POUR CALCULER LE pH :
Établir les réactions de dissociation Ecrire l’équilibre de l’eau : les constantes sont toujours vérifiées : Ke, Ka et Kb Ecrire le bilan massique : BM Ecrire le bilan électrique : BE Dans le cas des solutions complexes (coexistence de plusieurs espèces) ; l’équation obtenue est souvent difficile à résoudre, dans ce cas on peut envisager des approx
III. Équations de pH des solutions de mélanges
Mélange de protolytes de même nature Mélange de deux acides forts ou de deux bases fortes Mélange d’acide fort et d’acide faible ou de base forte et d’acide faible Mélange de deux acides faibles ou de deux bases faibles Mélange de protolytes de natures différentes (solutions de sels) Mélange d’acide fort et de base forte Mélange d’acide faible
Dans un mélange, il est important de considérer :
La dilution des diverses espèces dans la solution du mélange (variation des concentrations par dilution) univ.ency-education.com
Dans un mélange de protolytes de même nature, il est important de considérer :
L’addition d’ions communs à l’origine du déplacement des équilibres acido-basiques dans le sens de leur consommation et la diminution des coefficients de dissociation univ.ency-education.com
Dans un mélange de protolytes de natures différentes, il est important de considérer :
La consommation de l’espèce acide par la base si la « normalité » de l’acide est inférieure à celle de la base et inversement. univ.ency-education.com
Cas le plus général
Remarque nécessaire pour le calcul du pH dans les cas suivants univ.ency-education.com
[OH−] ≪ [H3O+] => (BE) [H3O+] = CA ̅̅̅̅ − CB ̅̅̅̅
pH de la solution imposé par l’acide fort en excès. = − (̅̅̅ − ̅̅̅) univ.ency-education.com
[H3O+] ≪ [OH−] => (BE) [OH−] = CB ̅̅̅̅ − CA ̅̅̅̅
pH de la solution imposé par la base forte en excès. pH = pKe + log(CB ̅̅̅ − CA ̅̅̅̅) univ.ency-education.com
(BM) (BE)
(Kaa) CA ̅̅̅̅ = [aH] + [a−] et CB ̅̅̅̅ = [BH+] univ.ency-education.com
1/ Cas où l’acide est en excès (̅̅̅ > ̅̅̅)
Coexistence de l’acide faible et de sa base conjuguée (pH d’une solution tampon) univ.ency-education.com
[H3O+]
KaA(CA ̅̅̅̅−CB ̅̅̅̅) (Kaa) CB ̅̅̅̅ = Équation d’Henderson Hasselbach univ.ency-education.com
[H3O+] ≪ [OH−] => (BE) [OH−] = CB ̅̅̅̅ − CA ̅̅̅̅
Le pH est imposé par le mélange : excès de la base forte (CB ̅̅̅̅ − CA ̅̅̅̅) + base conjuguée de l’acide faible (CA ̅̅̅̅). (Voir pH de solution de mélange de protolytes de natures différentes – Cas d’un mélange de base forte et de base faible). univ.ency-education.com
3/ Cas où l’acide et la base sont en quantités égales (̅̅̅ = ̅̅̅)
Dissociation totale de l’acide => pH imposé par la base conjuguée “a-“ formée de l’acide faible (CA ̅̅̅̅). (Voir pH de solution simple de base faible). c. Mélange d’acide fort AH et de base faible b univ.ency-education.com
(BM) (BE)
(Kbb) CA ̅̅̅̅ = [A−] et CB ̅̅̅̅ = [b] + [bH+] univ.ency-education.com
[H3O+] + [bH+] = [A−] + [OH−]
= [ −][bH+] [b] Coexistence de la base faible et de son acide conjugué (pH d’une solution tampon) univ.ency-education.com
2/ Cas où l’acide est en excès (̅̅̅ > ̅̅̅)
(Voir pH de solution de mélange de protolytes de natures différentes – Cas d’un mélange d’acide fort et d’acide faible). univ.ency-education.com
3/ Cas où l’acide et la base sont en quantités égales (̅̅̅ = ̅̅̅)
(Voir pH de solution simple d’acide faible). d. Mélange d’acide faible aH et de base faible b univ.ency-education.com
(BM) [aH] = CA ̅̅̅̅ − CB ̅̅̅̅
et [a−] = [bH+] = CB ̅̅̅̅ En remplaçant dans (KaA): = ̅̅̅ + ̅̅̅ − ̅̅̅ univ.ency-education.com
(BM) [b] = CB ̅̅̅̅ − CA ̅̅̅̅
et [a−] = [bH+] = CA ̅̅̅̅ En remplaçant dans (Kab): CB ̅̅̅ − CA ̅̅̅̅ pH = pKaB + log ̅̅̅̅ CA univ.ency-education.com
Cas d’une solution simple d’ampholyte (Soit NaAH)
(analogie avec le cas d’une solution de mélange d’acide faible et de base faible) NaAH → Na+ + AH- univ.ency-education.com
3. ÉCHELLE DU pKa
Le pKa estime la force d’acidité ou de basicité des espèces chimiques à caractère acidobasique. univ.ency-education.com
6. MESURE EXPÉRIMENTALE DU pH
La mesure du pH peut s’effectuer avec : des indicateurs colorés : directement en solution – avec du papier pH – ou des bandelettes pH. ou avec un pH-mètre. univ.ency-education.com
DÉMARCHE UTILISÉE POUR CALCULER LE pH :
Établir les réactions de dissociation Ecrire l’équilibre de l’eau : les constantes sont toujours vérifiées : Ke, Ka et Kb Ecrire le bilan massique : BM Ecrire le bilan électrique : BE Dans le cas des solutions complexes (coexistence de plusieurs espèces) ; l’équation obtenue est souvent difficile à résoudre, dans ce cas on peut envisager des approx
III. Équations de pH des solutions de mélanges
Mélange de protolytes de même nature Mélange de deux acides forts ou de deux bases fortes Mélange d’acide fort et d’acide faible ou de base forte et d’acide faible Mélange de deux acides faibles ou de deux bases faibles Mélange de protolytes de natures différentes (solutions de sels) Mélange d’acide fort et de base forte Mélange d’acide faible
Dans un mélange, il est important de considérer :
La dilution des diverses espèces dans la solution du mélange (variation des concentrations par dilution) univ.ency-education.com
Dans un mélange de protolytes de même nature, il est important de considérer :
L’addition d’ions communs à l’origine du déplacement des équilibres acido-basiques dans le sens de leur consommation et la diminution des coefficients de dissociation univ.ency-education.com
Dans un mélange de protolytes de natures différentes, il est important de considérer :
La consommation de l’espèce acide par la base si la « normalité » de l’acide est inférieure à celle de la base et inversement. univ.ency-education.com
Cas le plus général
Remarque nécessaire pour le calcul du pH dans les cas suivants univ.ency-education.com
[OH−] ≪ [H3O+] => (BE) [H3O+] = CA ̅̅̅̅ − CB ̅̅̅̅
pH de la solution imposé par l’acide fort en excès. = − (̅̅̅ − ̅̅̅) univ.ency-education.com
[H3O+] ≪ [OH−] => (BE) [OH−] = CB ̅̅̅̅ − CA ̅̅̅̅
pH de la solution imposé par la base forte en excès. pH = pKe + log(CB ̅̅̅ − CA ̅̅̅̅) univ.ency-education.com
(BM) (BE)
(Kaa) CA ̅̅̅̅ = [aH] + [a−] et CB ̅̅̅̅ = [BH+] univ.ency-education.com
1/ Cas où l’acide est en excès (̅̅̅ > ̅̅̅)
Coexistence de l’acide faible et de sa base conjuguée (pH d’une solution tampon) univ.ency-education.com
[H3O+]
KaA(CA ̅̅̅̅−CB ̅̅̅̅) (Kaa) CB ̅̅̅̅ = Équation d’Henderson Hasselbach univ.ency-education.com
[H3O+] ≪ [OH−] => (BE) [OH−] = CB ̅̅̅̅ − CA ̅̅̅̅
Le pH est imposé par le mélange : excès de la base forte (CB ̅̅̅̅ − CA ̅̅̅̅) + base conjuguée de l’acide faible (CA ̅̅̅̅). (Voir pH de solution de mélange de protolytes de natures différentes – Cas d’un mélange de base forte et de base faible). univ.ency-education.com
3/ Cas où l’acide et la base sont en quantités égales (̅̅̅ = ̅̅̅)
Dissociation totale de l’acide => pH imposé par la base conjuguée “a-“ formée de l’acide faible (CA ̅̅̅̅). (Voir pH de solution simple de base faible). c. Mélange d’acide fort AH et de base faible b univ.ency-education.com
(BM) (BE)
(Kbb) CA ̅̅̅̅ = [A−] et CB ̅̅̅̅ = [b] + [bH+] univ.ency-education.com
[H3O+] + [bH+] = [A−] + [OH−]
= [ −][bH+] [b] Coexistence de la base faible et de son acide conjugué (pH d’une solution tampon) univ.ency-education.com
2/ Cas où l’acide est en excès (̅̅̅ > ̅̅̅)
(Voir pH de solution de mélange de protolytes de natures différentes – Cas d’un mélange d’acide fort et d’acide faible). univ.ency-education.com
3/ Cas où l’acide et la base sont en quantités égales (̅̅̅ = ̅̅̅)
(Voir pH de solution simple d’acide faible). d. Mélange d’acide faible aH et de base faible b univ.ency-education.com
(BM) [aH] = CA ̅̅̅̅ − CB ̅̅̅̅
et [a−] = [bH+] = CB ̅̅̅̅ En remplaçant dans (KaA): = ̅̅̅ + ̅̅̅ − ̅̅̅ univ.ency-education.com
(BM) [b] = CB ̅̅̅̅ − CA ̅̅̅̅
et [a−] = [bH+] = CA ̅̅̅̅ En remplaçant dans (Kab): CB ̅̅̅ − CA ̅̅̅̅ pH = pKaB + log ̅̅̅̅ CA univ.ency-education.com
Cas d’une solution simple d’ampholyte (Soit NaAH)
(analogie avec le cas d’une solution de mélange d’acide faible et de base faible) NaAH → Na+ + AH- univ.ency-education.com
|
Chapitre 1 Acides et bases
1.1 pH de solutions aqueuses. 1.1.1 Définition du pH et exemples. Le pH (“potentiel hydrogène”) d'une solution défini par Søren Sørensen en 1909 |
|
LES REACTIONS ACIDE-BASE 1. Le pH 1.1 Définition Le pH
Le pH. 1.1 Définition. Le pH (potentiel hydrogène) est une grandeur qui donne une information sur la concentration en ions oxonium [H3O+]. |
|
Chapitre CHIMIE – Le pH I – Les solutions acides neutres et
Chapitre CHIMIE – Le pH. I – Les solutions acides neutres et basiques : Démarche d'investigation : Acide |
|
Guide descriptif des nomenclatures détaillées des besoins et des
2 déc. 2020 Les définitions des notions de besoins et de prestations10 ont été élaborées en amont de la construction des nomenclatures SERAFIN-PH. |
|
PH DES SOLUTIONS AQUEUSES I. Généralités
La première définition est donnée par Sörensen en 1909 : « logarithme de l'inverse de la concentration en ions hydrogène ». pH = - log10 [H3O+]. À l'origine le |
|
1.1. Définition du pH dune solution aqueuse : La concentration
13 ACIDES ET BASES. REACTION CHIMIQUE PAR ECHANGE DE PROTON. 1. LE PH LES ACIDES ET LES BASES ? 1.1. Définition du pH d' |
|
Fiche dexercices sur les acides bases et pH (fiche n°11)
4) Indique quels sont les ions du pH majoritaires dans ce soda. Exercice 2. Range les éléments suivants du plus acide au plus basique : pH(lait) = 672. |
|
COURS DE CHIMIE GENERALE Semestre 1 SVI
CALCUL DE PH DES SOLUTIONS AQUEUSES. 2.1. Cas d'un acide fort m.a est par définition le 1/12 de la masse d'un atome de l'isotope 12 du carbone. |
|
PH Théorie et Pratique
Définition du pH. Mesure du pH. La chaîne de mesure des électrodes. Une mesure de pH fait intervenir deux électrodes : l'électrode indicatrice (aussi |
|
Conceptions modernes de lacidité. Le pH - sa mesure - applications
Les deux notions se complètent mais elles sont profon- dément différentes. L'acidité totale se détermine par un titrage : par exemple |
|
Chapitre CHIMIE – Le pH I – Les solutions acides neutres et basiques
Document n°1 : Méthode pour la mesure du pH d'une solution 1 Colorier les cartes d'identité des solutions acide en jaune et basique en bleu |
|
Chapitre 1 Acides et bases
1 1 pH de solutions aqueuses 1 1 1 Définition du pH et exemples Le pH (“potentiel hydrogène”) d'une solution défini par Søren Sørensen en 1909 s'écrit : |
|
COURS DE CHIMIE GENERALE Semestre 1 SVI
Définition de la ST 3 2 Propriété de la ST 3 3 Préparation de la ST 3 4 Calcul du pH de ST 4 Titrages acide-base 1 1 Titrage d'un acide fort par |
|
PH et équilibres acido-basiques en solution aqueuse
Il suppose que l'étudiant maîtrise les notions développées dans ce module : - acides et bases selon Brönsted - couple acide-base - constante d'acidité Ka ( |
|
LES REACTIONS ACIDE-BASE 1 Le pH 11 Définition Le - PC-STL
1 Le pH 1 1 Définition Le pH (potentiel hydrogène) est une grandeur qui donne une information sur la concentration en ions oxonium [H3O+] |
|
Les solutions acides et les solutions basiques - AlloSchool
1- Notion du pH : ? Le pH est un nombre sans unité compris entre 0 et 14 qui indique le caractère acide basique ou neutre d'une solution aqueuse |
|
PH DES SOLUTIONS AQUEUSES I Généralités
pH DES SOLUTIONS AQUEUSES I Généralités 1 DÉFINITION DU pH pH pour potentiel d'hydrogène La première définition est donnée par Sörensen en 1909 |
|
PH et pKa - The Zysman-Colman Group
La définition que nous utiliserons : Brønsted-Lowry (1923) http://evans harvard edu/ pdf /evans_pKa_table pdf 1 unité de pH = facteur 10 [H3O+] |
|
11 Définition du pH dune solution aqueuse : La concentration
Ch 13 ACIDES ET BASES REACTION CHIMIQUE PAR ECHANGE DE PROTON 1 LE PH LES ACIDES ET LES BASES ? 1 1 |
|
+ H3O+ Réactions acide-base - Notion dé - PhysiqueChimie
L-1 et « log » désigne le logarithme décimal La mesure du pH permet de calculer la concentration en ions oxonium par la relation : [H3O+] = 10-ph |
C'est quoi la notion de pH ?
Sigle signifiant potentiel hydrogène (de l'allemand potenz) ou pondus Hydrogenium (traduction de poids en latin). Il représente la mesure de l'acidité ou de l'alcalinité en chimie d'une solution ou d'un milieu. Plus précisément, le pH mesure la concentration d'une solution aqueuse en ions oxonium H3O+.Quels sont les 3 zones de pH ?
Acidité et basicité du milieu
Une solution est dite acide si son pH est inférieur à 7, basique s'il est supérieur à 7 et neutre s'il égal à 7.Quels sont les formules de pH ?
Le pH est utilisé pour déterminer le niveau d'acidité d'un composé. L'échelle du pH est comprise entre 0 et 14. La première étant la valeur la plus acide, et la dernière la plus basique, qui concerne les produits qui ne sont pas très acides.
Comment expliquer le pH ?
. Plus précisément, le pH mesure la concentration d'une solution aqueuse en ions oxonium H3O+.
Quels sont les formules de pH ?
. Le pH est depuis devenu un indicateur de l'acidité -- lorsque le pH est inférieur à 7 -- ou de l'alcalinité -- lorsque le pH est supérieur à 7 -- d'une solution.
Qui a défini le pH ?
. P.
. L.
. Sørensen (né à Havrebjerg au Danemark le 9 janvier 1868 et mort le 12 février 1939 ), est un chimiste danois.
. Il est connu principalement pour avoir introduit la notion de potentiel hydrogène (plus couramment appelé pH) en 1909.
|
Concept et notion ne sont pas des synonymes - Portail pour l
enseignement:le couple notion et concept utilisé dans les les termes concept et notion, employés sans distinction maîtriser2 les notions scolaires, mais pas |
|
Quelques notions mathématiques de base - Christophe Chesneau
− = {nombres réels négatifs non nuls} =] − ∞,0[ C Chesneau 7 Page 8 1 Notions sur les ensembles |
|
Sur la notion de « terme » - Érudit
Notre dic- tionnaire fournit de nombreux détails sur le sens et le fonctionnement linguistique des termes, mais évite de donner de longs développements |
|
Notion : Les biens économiques - Français des affaires
Les biens sont les moyens qui permettent de satisfaire les besoins En amont, on peut relever l'existence de deux types de biens : ➢ les biens naturels ou biens |
|
Notion : Le produit - Français des affaires
Du point de vue mercatique, le produit est un amalgame de caractères standard et d'attributs spécifiques Un vélo n'est pas seulement un produit qui permet de |
|
QUELQUES NOTIONS autour de la culture et de linterculturel
La notion de culture recouvre selon la formule de Ward Goodenough, anthropologue (1964) : « Tout ce qu'il faut savoir pour être membre la culture d 'une |
|
Étude critique de la notion de collectif - Numdam
NOTION DE COLLECTIF INTRODUCTION Le présent travail m'a été inspiré par une conférence tenue par M Wald au Séminaire |
|
1 La notion de marché 2 Loffre et la demande - Collège Henri
L'offre : La notion d'offre englobe les producteurs et les distributeurs (c'est-à-dire tous ceux qui proposent un produit ou un service à la vente L'analyse de l'offre |
|
La notion de compétence
La compétence est de l'ordre du savoir‐mobiliser (Guy le Boterf – 1994) – Une compétence permet de faire face à une situation complexe, de construire une |