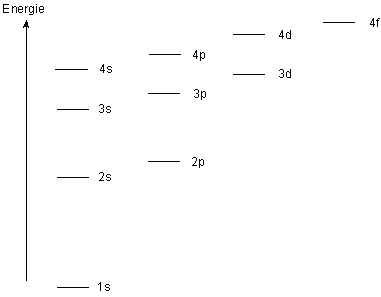ordre de remplissage des orbitales
|
ChapII-klechkowski et remplissage des-orbitales
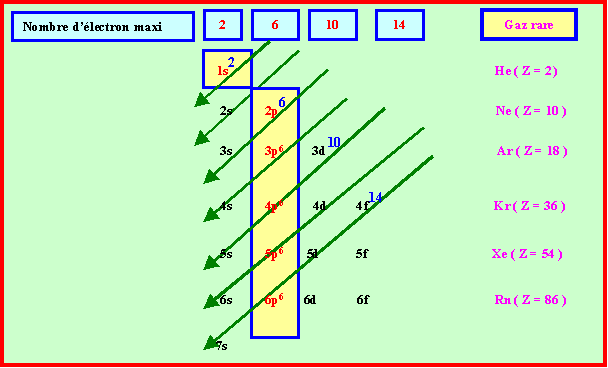
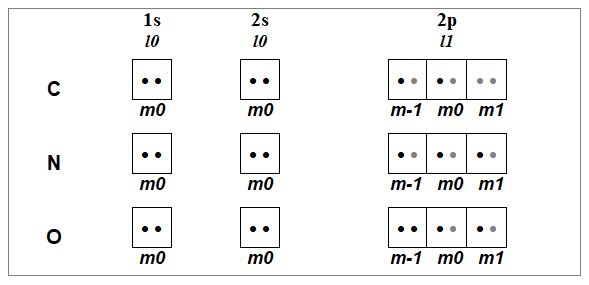
On obtient donc l'ordre de remplissage suivant : n+ l = 1 : n=1 l = 0 → 1s n+ l = 2 : n=2 l = 0 → 2s n+ l = 3 : n=2 l = 1 → 2p n=3 l = 0 → 3s |
|
ChapitreIII La configuration electronique 2023-2024 (E+F)pdf
remplissage débute par l'orbitale 2s puis l'orbitale 2p Concernant l'ordre de remplissage des orbitales 2p 3s (même valeur de (n + ℓ) ) se fait selon la |
|
Nombres quantiques et Orbitales Atomiques (OA)
Il définit la forme et la symétrie OA (orbitales s p d f etc ) ml Nombre quantique tertiaire (ou magnétique) -l ≤ ml ≤ +l entier (2 l +1) valeur(s) |
|
Règles de remplissage pour les atomes polyélectroniques
Afin de répartir tous les électrons d'un atome dans les différentes orbitales atomiques celles-ci sont classées par énergie croissante et les électrons sont |
|
Règles-de-remplissagepdf
c- Règle de Hund : les électrons occupent un maximum d'orbitales définies par le nombre quantique azimutal l avant de les compléter par un deuxième électron |
Quel est l'ordre de remplissage des sous-couches ?
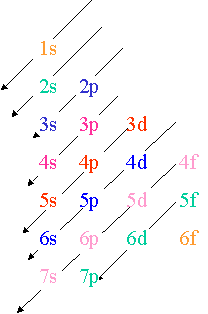
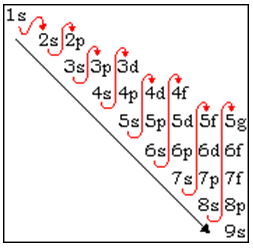
L'ordre de remplissage des sous-couches électronique des atomes électriquement neutres à l'état fondamental rangés par numéro atomique croissant est donc : 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Comment remplir les orbitales atomiques ?
Selon le principe de l'Aufbau, les électrons remplissent d'abord les sous-couches du niveau d'énergie le plus bas.
Par conséquent, deux électrons vont d'abord remplir l'orbitale simple de .
Deux autres électrons rempliront ensuite l'orbitale unique de , la sous-couche dont le niveau d'énergie est le plus bas suivant.Pourquoi on remplit la 4s avant la 3d ?
Pourquoi 4s avant 3d ? Parce que les électrons de la 4s ont un pouvoir de pénetration supérieur à celui de l'orbitale 3d.
- Jusqu'à 18 électrons, les sous-couches se remplissent selon l'ordre suivant : 1s → 2s → 2p → 3s → 3p.
Au-delà de 18 électrons, il faut suivre la règle de Klechkowski (doc. 2).
|
Règles de remplissage pour les atomes polyélectroniques
Afin de répartir tous les électrons d'un atome dans les différentes orbitales atomiques celles-ci sont classées par énergie croissante et les électrons sont |
|
Corrigé
1) Nommer et énoncer la règle qui permet d'obtenir l'ordre de remplissage des orbitales atomiques pour obtenir la configuration électronique d'un atome. |
|
REGLES DE REMPLISSAGE (2016-2017) a- Règle de
L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) c- Règle de Hund : les électrons occupent un maximum d'orbitales définies par le. |
|
Chapitre I – Structure des atomes
Les orbitales sont définies par les trois nombres quantiques n l et m (nombres Respecter l'ordre de remplissage selon la règle de Klechkowski (règle. |
|
4-La configuration électronique
facilement l'ordre énergétique des orbitales atomiques et par le fait même leur ordre de remplissage ce qui constitue un outil fort avantageux |
|
Chapitre 1 - Configuration électronique
des volumes appelés orbitales dans lesquels l'électron a le plus de chance de de retrouver l'ordre de remplissage des couches électroniques d'un élément. |
|
Sans titre
quantique magnétique pour prévoir l'ordre de remplissage des orbitales atomiques. E. Des atomes appartenant à la même famille ont généralement un même. |
|
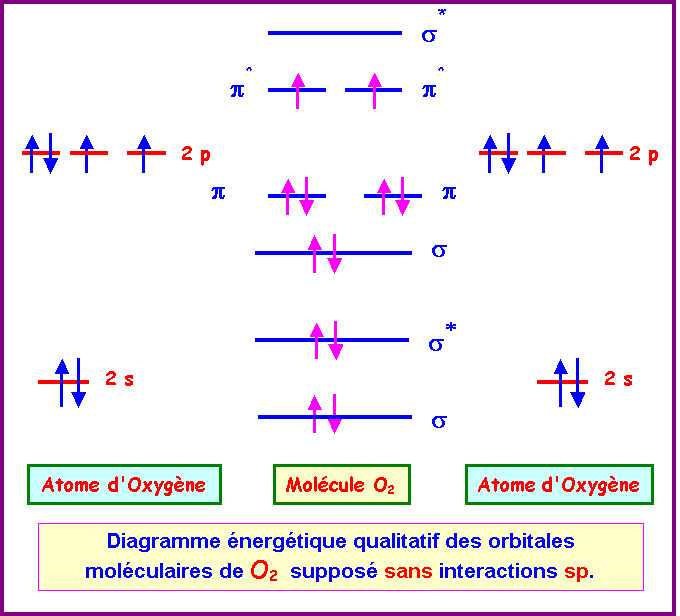
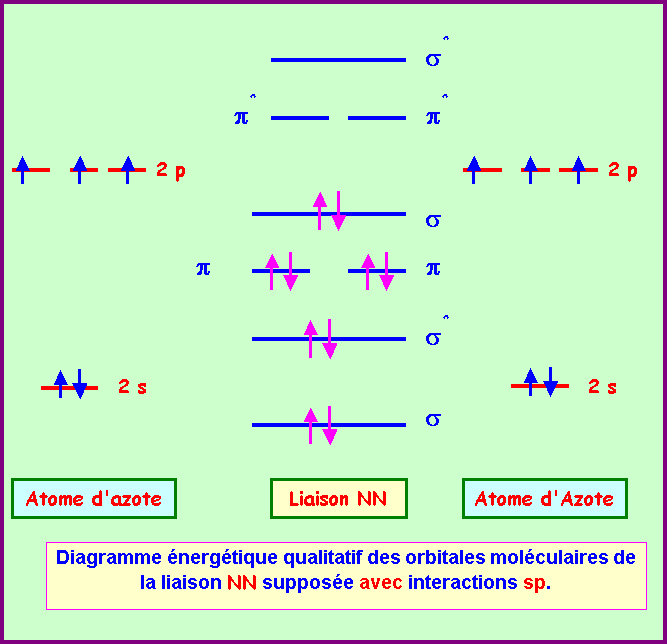
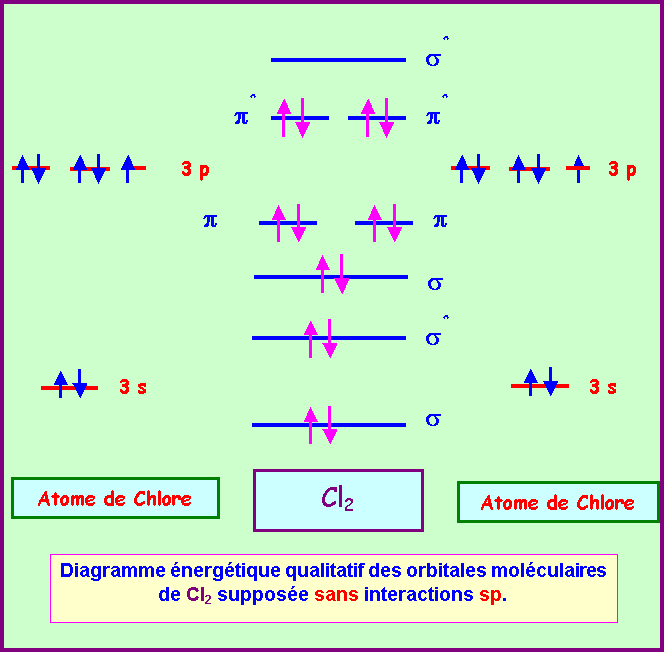
Les orbitales moléculaires
+ 1.1 LCAO 1.2 L'orbitale moléculaire ?+ 1.3 ?. 2. Diagramme d'énergie moléculaire. 2.1 H. 2. 2.2 He. 2. 2.3 Ordre de la liaison 2.4 Règles de construction. |
|
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
L'ordre de remplissage des orbitales atomiques se fait suivant la règle de Klechkowski : L'ordre est par ordre croissant d'énergie. |
|
Diapositive 1
On obtient donc l'ordre de remplissage suivant : Cette règle traduit le fait que les orbitales se remplissent dans l'ordre suivant :. |
|
Règles de remplissage pour les atomes polyélectroniques
Règle de Hund: pour une sous-couche donnée la configuration électronique de plus basse énergie est obtenue en plaçant un maximum d’électrons de même spin (même valeur de ms) dans des orbitales différentes (cf Principe d’exclusion de Pauli) avant d’apparier des électrons de spins opposés (valeurs de ms opposées) |
|
1 Atomistique - editions-ellipsesfr
A Les orbitales s sont de forme sphérique B Selon les règles de l’Aufbau Principe les orbitales 4s se remplissent après les orbitales 3d C Toutes les liaisons chimiques se forment lors d’un échange d’électrons entre atomes D En liant des atomes pour former une molécule on forme une structure |
|
La Classification Périodique - chemphysfr
l'ordre de remplissage des orbitales atomiques d'un atome polyélectronique 1s2 2s2 2p6 3s2 3p6 =18 e-puis: E 4s < E 3d OA 4s se remplit avant OA 3d E 5 s < E 4d E 5 d ? E 4f dans le lanthane (Z=57) 5d se remplit avant 4f E 6 d ? E 5f dans l'actinium (Z=89) 6d se remplit avant 5f K L M N O P Q |
|
Searches related to ordre de remplissage des orbitales PDF
la somme des énergies des électrons de la molécule: E = E = ?? n n i EE i E = 2 E( 1s) = 2 (1597) = 3194 eV La molécule H 2 est plus stable que les 2 H séparés car son niveau d'énergie est plus bas L'énergie de stabilisation ?E de l'orbitale liante est inférieure en valeur |
Comment remplir les orbitales ?
Pourquoi on remplit la 4s avant la 3d ?
Comment remplir les couches ?
|
Règles de remplissage pour les atomes polyélectroniques
Afin de répartir tous les électrons d'un atome dans les différentes orbitales atomiques, celles-ci sont classées par énergie croissante et les électrons sont répartis |
|
LA LIAISON CHIMIQUE 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
le tableau périodique des éléments et examiner le remplissage électronique s, p, d et f correspondent aux orbitales atomiques qui, par définition, nous 3) La règle de Hund donne des instructions quant à l'ordre selon lequel les orbitales |
|
Corrigé
1) Nommer et énoncer la règle qui permet d'obtenir l'ordre de remplissage des orbitales atomiques pour obtenir la configuration électronique d'un atome |
|
Les orbitales moléculaires
+ 1 1 LCAO 1 2 L'orbitale moléculaire Ψ+ 1 3 Ψ 2 Diagramme d'énergie moléculaire 2 1 H 2 2 2 He 2 2 3 Ordre de la liaison 2 4 Règles de construction 3 |
|
Chapitre I – Structure des atomes - Editions Ellipses
Les orbitales sont définies par les trois nombres quantiques n, l et m (nombres Etape 1 Respecter l'ordre de remplissage selon la règle de Klechkowski (règle |
|
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
L'ordre de remplissage des orbitales atomiques se fait suivant la règle de Klechkowski : l'orbitale 3d a bien une énergie inférieure à l'orbitale 4s, du fait que la |
|
La structure électronique des atomes - DSFM
pour l'atome d'hydrogène, la valeur de n détermine l'énergie de l'orbitale • ceci n' est pas ordre de remplissage des orbitales Donc l'ordre est : 1s, 2s, 2p, 3s, |