composition chimique de la craie scolaire
|
UNIVERSITE DANTANANARIVO FACULTE DES SCIENCES
24 févr. 2007 Puisque les établissements scolaires se multiplient rapidement ainsi ... Tableau n° 31.Composition chimique de craie de couleur en pourcentage. |
|
VOLONTAIRES POUR LASSISTANCE TECHNIQUE par Dr. Louis
Ces mat~riaux naturels sont souvent cass~s ou ont des fissures internes qui sont un d~savantage lors de la coupe en b~tons. Nom commun. Formule chimique craie. |
|
TARIF DOUANIER
a) des éléments chimiques isolés ou des composés de constitution chimique définie entrer dans la composition de préparations pour l'impression des textiles. |
|
Module de formation des acteurs de leducation sur la gestion
NB : Une hormone est une substance chimique fabriquée par une glande (organe) Potable |
|
COMPORTEMENT ET MODELISATION DE LA CRAIE
14 nov. 2020 Tableau 1-2 - Composition des craies par fluorescence semi-quantitative ... composition chimique. Donc des transformations de texture dans la ... |
|
THESE DOCTEUR en Génie Civil Jaouad NADAH VALORISATION
Des traitements physico- chimiques expérimentés sur la craie au laboratoire de l'Ecole Centrale de Lille sont décrits et analysés afin de souligner l'impact |
|
Untitled
443 - Composition chimique des eaux de la craie. 22. 4431 - en nappe libre - forage du groupe scolaire Roger Salengro à Ostricourt (20.6.45). - forages 1 et ... |
|
Valorisation dune craie du Nord de la France en assise de
23 juin 2010 Des traitements physico- chimiques expérimentés sur la craie au laboratoire de l'Ecole Centrale de Lille sont décrits et analysés afin de ... |
|
Comprendre les titrages - Représentations délèves de première et
3 mars 2014 On place de la craie (carbonate de calcium de formule CaCO3) dans une solution d'acide ... « Composition du système chimique ». Enfin nous ... |
|
Classe CM2 2ème trimestre
craie ficelle |
|
UNIVERSITE DANTANANARIVO FACULTE DES SCIENCES
24 févr. 2007 Composition chimique des craies 30. II.2.1. ... Puisque les établissements scolaires se multiplient rapidement ainsi la demande. |
|
VOLONTAIRES POUR LASSISTANCE TECHNIQUE par Dr. Louis
de craie a partir de la poudre sont d~crites: (1) pression Formule chimique craie. CaCO 3 pyrophylitte. A12 03 * 4Sio 2 . 1H2 0. Talc steatite |
|
Valorisation dune craie du Nord de la France en assise de
23 juin 2010 chimiques expérimentés sur la craie au laboratoire de l'Ecole Centrale de ... routières chacune ayant une composition et une manière de ... |
|
Untitled
443 - Composition chimique des eaux de la craie. 22. 4431 - en nappe libre forage du groupe scolaire Roger Salengro à Ostricourt (20.6.45). |
|
MODULES DE FORMATION
20 déc. 2019 DPFC/CND Physique-Chimie/document de formation des Enseignants ... Un manuel scolaire est un matériel imprimé structuré destiné à être ... |
|
FORMATION DES ENSEIGNANTS DES ETABLISSEMENTS PRIVE
Ainsi l'enseignement de la Physique et de la Chimie a pour finalité de former des Un manuel scolaire est un matériel imprimé |
|
Chapitre 6 : Les transformations chimiques - Activité C4
Activité C5 : Comment évolue la masse au cours d'une transformation chimique ? Pour faire l'expérience ci-dessous muni du matériel suivant : - une craie. - 2 |
|
Guide pédagogique: sciences physique chimique et technologique
d'appuyer les éléments de réflexion sur la pédagogie de l'enseignement des sciences physique chimique et de technologie. > STRUCTURE ET CONTENU. |
|
Manuel-du-kit-scolaire.pdf
structure provisoire (par ex. une école l'espace abrité par un arbre ou un bâtiment rugueuses consomment plus de craie et l'écriture y est moins. |
|
Brochure_tec_der_170117.pdf
Dans sa structure actuelle le Droit de Douane comprend cinq catégories de Produits chimiques inorganiques; composés inorganiques ou organiques de ... |
|
Composition chimique de la craie scolaire PDFDoc Images - PDFprof
composition chimique de la craie scolaire PDFDoc Images UNIVERSITE DANTANANARIVO FACULTE DES SCIENCES 24 févr 2007 Composition chimique des craies |
|
Composition de la craie scolaire - Galerie-Creation
Composition de la craie scolaire La craie scolaire est fabriquée à partir de carbonate de calcium qui est la principale composante de la craie Cependant la |
|
Fabrication de La Craie PDF Calcaire - Scribd
Avis 48 |
|
UNIVERSITE DANTANANARIVO FACULTE DES SCIENCES
24 fév 2007 · Composition chimique des craies 30 II 2 1 Interprétation des résultats 32 II 3 Caractérisation par Spectrométrie de Fluorescence X 33 |
|
Quelle est la composition chimique de la craie ?
La craie est du carbonate de calcium et a la même composition chimique que le calcaire le marbre le carbonate de calcium broyé et le carbonate de calcium |
|
FABRICATION DE BATONS DE CRATf
de craie a partir de la poudre sont d~crites: (1) pression Formule chimique craie CaCO 3 pyrophylitte A12 03 * 4Sio 2 1H2 0 Talc steatite |
|
La Craie Scolaire - Forum FS Generation
Il dit que la craie scolaire contient du carbonate de calcium et du sulfate de calcium Mais il ne dit pas la proportion de ces deux |
|
Formule de composition de la craie scolaire - Togo
19 sept 2021 · il nous sera convenable de savoir la composition chimique pour cela pierre roche craie sans poussière - annonce agroalimentaire espaceagro |
|
Quelle est la formule chimique de la craie? - Réponse Rapide
25 nov 2019 · Les formules chimiques les plus courantes pour la craie sont CaCO3 (carbonate de calcium) et CaO (oxyde de calcium) La craie est une roche |
|
Craie - Wikipédia
La craie est une roche sédimentaire calcaire blanche marine de type biomicrite de texture Composition chimique CaCO3 (~90 ) et silicates (~10 ) Minéraux accessoires argile quartz Couleur généralement blanche Densité 14 à 22 g/cm3 |
Quelle est la composition chimique de la craie ?
La craie est une roche sédimentaire calcaire blanche marine de type biomicrite, de texture mudstone à packstone, à grain généralement très fin, tendre, marquante, poreuse et perméable, et assez pure contenant presque exclusivement du carbonate de calcium CaCO3 (90 % ou plus) et un peu d'argile.Comment fabriquer craie scolaire ?
Comment faire?
1Retirer complètement la membrane des coquilles d'oeufs.2Moudre les coquilles jusqu'à obtention d'une fine poudre.3Mélanger 2 parts de farine ou de plâtre avec une part de poudre de coquilles d'oeufs.4Ajouter une quantité d'eau suffisante pour former une pâte dure.5Modeler la pâte en bâtons.Comment fabriquer la craie scolaire lourde ?
Dans un verre, versez un fond d'eau. Demandez à vos apprentis artistes de la mélanger avec de la poudre de plâtre et de la peinture (disponible en magasin spécialisé). Jaune, vert, bleu, rose ? À eux de choisir la couleur qu'ils souhaitent donner à leur craie.- Trois techniques g6n~rales pour fabriquer des batons de craie a partir de la poudre sont d~crites: (1) pression d'une poudre a l'dtat humide, (2) extrusion d'une masse plastique, (3) coulage d'une suspension crdmeuse dans un mcule. Simples morceaux de craie obtenus par coupage de matd riaux solides.
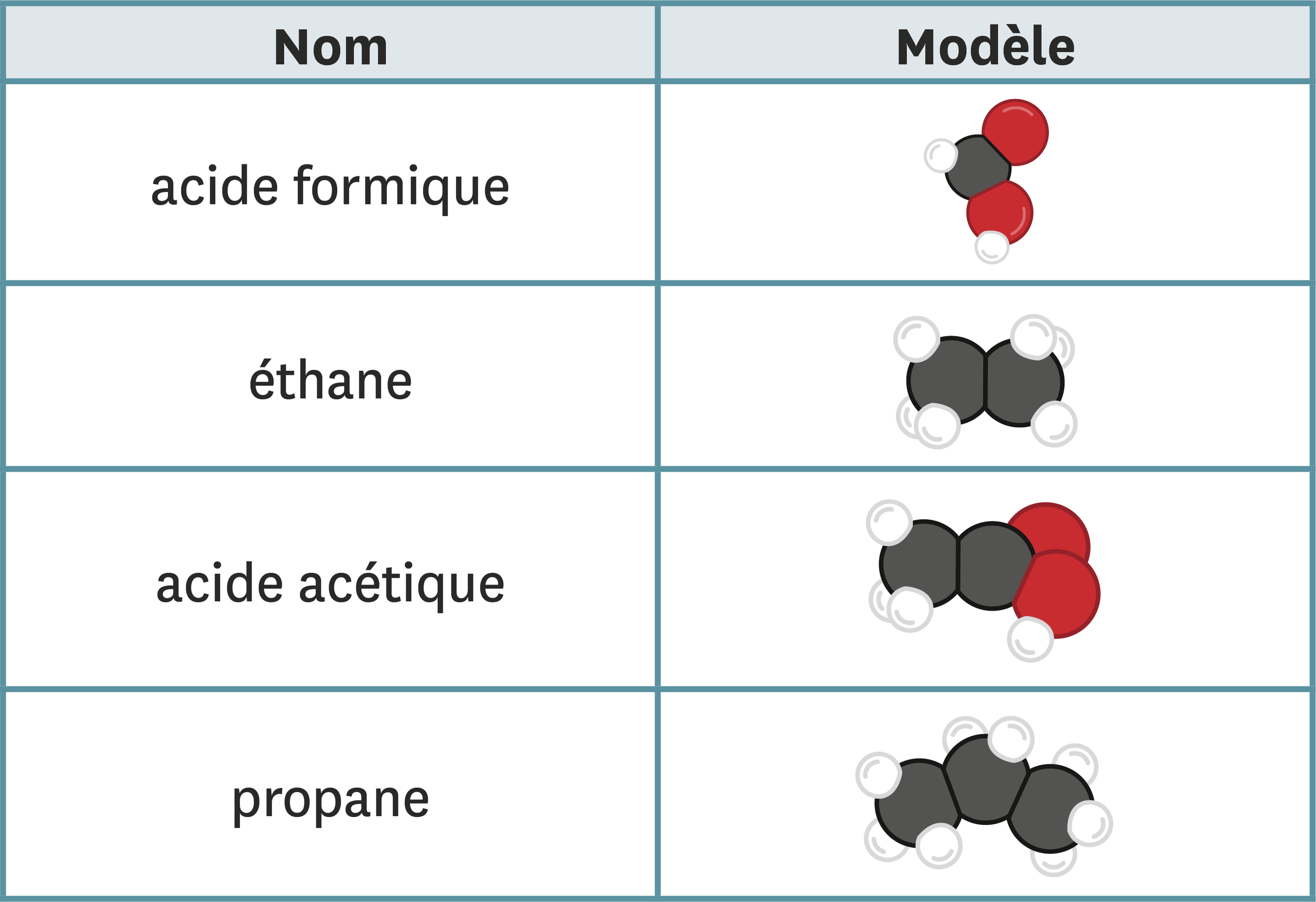
Composition chimique de la craie scolaire
La craie scolaire, souvent utilisée pour écrire sur les tableaux noirs, est principalement composée de carbonate de calcium. Voici une analyse détaillée de sa composition chimique :
- Carbonate de calcium (CaCO3): La composante principale de la craie, représentant généralement plus de 90% de sa composition. Le carbonate de calcium est un minéral abondant dans la nature et est également utilisé dans diverses autres applications, telles que les suppléments alimentaires et les matériaux de construction.
- Autres composants mineurs : En plus du carbonate de calcium, la craie peut contenir de petites quantités d'impuretés telles que du talc, du kaolin ou du quartz, qui peuvent varier selon la source et le processus de fabrication.
Exemples
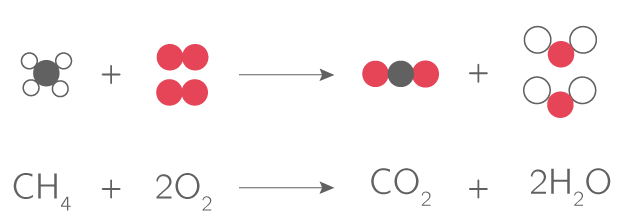
1. Lorsque de la craie est immergée dans de l'acide chlorhydrique, elle réagit en produisant du dioxyde de carbone.
2. Chauffer de la craie entraîne sa décomposition en oxyde de calcium et en dioxyde de carbone.
3. La craie broyée peut être utilisée comme additif dans la fabrication du papier pour améliorer sa blancheur.
4. Le carbonate de calcium présent dans la craie est également utilisé comme complément alimentaire pour fournir du calcium dans l'alimentation humaine et animale.
Exercices
- Calculer la masse molaire du carbonate de calcium.
- Écrire et équilibrer l'équation chimique de la réaction entre la craie et l'acide chlorhydrique.
- Déterminer la quantité de dioxyde de carbone produite lors de la décomposition thermique de 100 g de craie.
- Identifier les impuretés potentielles dans un échantillon de craie en utilisant des techniques d'analyse chimique.
Solutions :
- La masse molaire du carbonate de calcium (CaCO3) est calculée en additionnant les masses atomiques des atomes de calcium, de carbone et d'oxygène présents dans la formule. La masse molaire du CaCO3 est environ 100,09 g/mol.
- L'équation chimique équilibrée pour la réaction entre la craie (CaCO3) et l'acide chlorhydrique (HCl) est : CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
- En utilisant les coefficients stoechiométriques de l'équation de décomposition thermique de la craie, on peut déterminer que 100 g de craie produiront environ 44,02 g de dioxyde de carbone.
- Les impuretés dans un échantillon de craie peuvent être identifiées en utilisant des méthodes telles que la spectroscopie infrarouge, la spectroscopie de masse ou la chromatographie. Chaque technique fournit des informations sur les composants présents dans la craie.
Étude de cas
Imaginez une classe de chimie où les étudiants doivent analyser la composition chimique de différents échantillons de craie provenant de différentes régions géographiques. Ils utilisent diverses techniques d'analyse pour identifier les composants principaux et les impuretés dans chaque échantillon. Ensuite, ils comparent les résultats pour comprendre comment la composition de la craie peut varier en fonction de son origine géographique et de son processus de formation.
Sous-catégories
La composition chimique de la craie peut être subdivisée en plusieurs aspects, tels que :
- Composition minéralogique
- Impuretés et contaminants
- Réactivité chimique
- Utilisations industrielles
Notes
1. La craie est largement utilisée dans les salles de classe pour écrire sur les tableaux noirs en raison de sa texture douce et de son faible coût.
2. Le carbonate de calcium présent dans la craie est également un ingrédient commun dans les produits pharmaceutiques, les produits alimentaires et les matériaux de construction.
3. La craie peut être transformée en poudre fine et utilisée comme abrasif doux dans les produits de nettoyage et les dentifrices.
4. L'exploitation minière de la craie peut avoir des impacts environnementaux, notamment l'érosion des sols et la pollution des eaux souterraines.
Guide étape par étape
- Collectez un échantillon représentatif de craie à analyser.
- Préparez l'échantillon en le broyant ou en le réduisant en poudre si nécessaire.
- Choisissez la méthode d'analyse appropriée en fonction des objectifs de l'étude.
- Effectuez l'analyse en suivant les protocoles établis et en utilisant des équipements de laboratoire appropriés.
- Interprétez les résultats et tirez des conclusions sur la composition chimique de la craie.
- Comparez les résultats avec d'autres études ou échantillons pour valider les conclusions.
- Documentez soigneusement les méthodes et les résultats pour référence future.
Cas et scénarios
1. Cas : Un enseignant utilise des craies de différentes marques pour écrire sur un tableau noir. Il remarque que certaines craies produisent plus de poussière que d'autres, ce qui affecte la lisibilité des écritures. Solution : L'enseignant décide d'analyser la composition chimique de différentes marques de craie pour comprendre pourquoi certaines produisent plus de poussière que d'autres.
2. Cas : Une usine de fabrication de craie cherche à améliorer la qualité de ses produits en réduisant la présence d'impuretés. Solution : L'usine met en place des procédures de contrôle de la qualité strictes et utilise des techniques d'analyse avancées pour détecter et éliminer les impuretés des matières premières.
3. Cas : Un chercheur étudie les effets de la composition chimique de la craie sur son utilisation dans les produits cosmétiques. Solution : Le chercheur analyse différentes craies pour évaluer leur aptitude à être utilisées comme ingrédient dans les produits cosmétiques et identifie les composants qui pourraient avoir des avantages ou des inconvénients pour la peau.
Questions et réponses
- Question : Pourquoi la craie réagit-elle avec l'acide chlorhydrique?
- Réponse : La craie réagit avec l'acide chlorhydrique en raison de la présence de carbonate de calcium dans sa composition. L'acide chlorhydrique réagit avec le carbonate de calcium pour former du chlorure de calcium, du dioxyde de carbone et de l'eau.
- Question : Comment peut-on identifier les impuretés dans la craie?
- Réponse : Les impuretés dans la craie peuvent être identifiées en utilisant des techniques d'analyse chimique telles que la spectroscopie infrarouge, la spectroscopie de masse ou la chromatographie, qui permettent de détecter la présence de substances étrangères dans l'échantillon.
- Question : Quelle est l'utilité industrielle du carbonate de calcium présent dans la craie?
- Réponse : Le carbonate de calcium est largement utilisé dans diverses industries, notamment dans la fabrication du papier, des plastiques, des produits pharmaceutiques et des produits alimentaires en raison de ses propriétés de charge, de remplissage et de stabilisation.
- Question : Comment la composition chimique de la craie peut-elle influencer sa réactivité chimique?
- Réponse : La composition chimique de la craie peut influencer sa réactivité chimique en déterminant sa capacité à réagir avec d'autres substances, telles que les acides, les bases ou la chaleur, ce qui peut entraîner des changements physiques ou chimiques dans la craie.
Questions à choix multiples
- Question : Quel est le composant principal de la craie scolaire?
- Réponse A : Silice
- Réponse B : Carbonate de calcium (Correct)
- Réponse C : Argile
- Réponse D : Quartz
- Question : Quelle réaction se produit lorsque de la craie est chauffée?
- Réponse A : Elle fond
- Réponse B : Elle explose
- Réponse C : Elle se décompose en oxyde de calcium et dioxyde de carbone (Correct)
- Réponse D : Elle devient fluorescente
- Question : Quel est l'effet de la présence d'impuretés sur la qualité de la craie?
- Réponse A : Aucun effet
- Réponse B : Elle devient plus solide
- Réponse C : Elle produit plus de poussière (Correct)
- Réponse D : Elle devient plus résistante à l'usure
- Question : Quelle est l'utilité principale du carbonate de calcium dans la craie?
- Réponse A : Coloration
- Réponse B : Propriétés magnétiques
- Réponse C : Propriétés antioxydantes
- Réponse D : Propriétés de charge et de remplissage (Correct)
Éléments à retenir
- La craie scolaire est principalement composée de carbonate de calcium.
- Des impuretés peuvent être présentes dans la craie, affectant ses propriétés physiques et chimiques.
- Le carbonate de calcium est largement utilisé dans diverses industries en raison de ses nombreuses applications.
- L'analyse de la composition chimique de la craie peut être réalisée à l'aide de différentes techniques d'analyse.
|
UNIVERSITE DANTANANARIVO FACULTE DES SCIENCES
24 fév 2007 · Composition chimique des craies 30 II 2 1 Puisque les établissements scolaires se multiplient rapidement, ainsi la demande augmente |
|
Valorisation dune craie du Nord de la France en assise de
23 jui 2010 · chimiques expérimentés sur la craie au laboratoire de l'Ecole routières, chacune ayant une composition et une manière de répartir les |
|
Classeur dactivités Craies en Mains - Pays de Savoie solidaires
Année scolaire 2008-2009 : Poursuite des activités et prépa- ration du second la dégradation des sols (abus d'engrais chimiques et d'insecticides « tuant » les jouer un rôle intérêt pour la structure du conte en randonnée Prolongement : |
|
Mémento roches et minéraux industriels - InfoTerre - BRGM
11 - Composition chimique de matières premières caractère pouzzolanique - secteur du bâtiment : logements, bâtiments scolaires et industriels etc ; -génie civil mondiale L'utilisation de la craie, la matière première pour chaux et ciment, |
|
Activity 1: Its just a phase - Scientists in School
Les œufs, les coquilles, les os et la plupart des craies pour tableau contiennent du carbonate de calcium Les élèves observeront une réaction chimique lorsque le |
|
BURUNDI - SGS
10 mar 2015 · Craie 25 10 Phosphates de calcium naturels, phosphates chimique définie ou non; amalgames de métaux précieux 28 44 et autres articles scolaires, de bureau ou de papeterie, y compris les Joints métalloplastiques; jeux ou assortiments de joints de composition différente présentés en pochettes, |
|
BREF Fabrication des produits céramiques - Document intégral - AIDA
Tableau 2 6 : Composition chimique de l'argile dans la fabrication des tuyaux en Le quartz, le feldspath, la craie dans certains cas, la dolomite, la wollastonite |
|
FICHES PARS II PROGRAMME DAPPUI A LA RÉUSSITE SCOLAIRE
l'ensemble des élèves quelques soient leurs niveaux scolaires Les élèves fréquentant La structure de la fiche PARS II de Physique-Chimie Morceau de craie, un fil, une bouteille en plastique transparent, un flacon contenant une solution |
|
1 La chimie des chaux aériennes - Maisons Paysannes de Lorraine
Image d'un four à chaux, manuel scolaire 1906 L'oxyde de calcium obtenu de formule chimique CaO est plus couramment appelé chaux vive C'était extrêmement trompeur car il s'agissait en fait de la composition du mélange avant |