 Chapitre X Vibrations moléculaires Absorption infra-rouge et
Chapitre X Vibrations moléculaires Absorption infra-rouge et
En considérant le moment dipolaire total comme la somme de deux moments de liaison μOH on Le calcul des caractères des opérations est immédiat pour les ...
 Untitled
Untitled
pour calculer le moment dipolaire. Pour éliminer l'ambiguïté on peut trouver expérimentalement le moment dipolaire du 5-nitroacénaphtène. (5 D environ). Le
 Exercice 8 : moment dipolaire
Exercice 8 : moment dipolaire
5) Calculer alors la valeur du moment dipolaire résultant apparaissant sur ces trois composés en fonction du moment dipolaire de la liaison C-Cl (on négligera
 Chapitre 9 – Propriétés physiques Me = 1056x10 C.m M = 2
Chapitre 9 – Propriétés physiques Me = 1056x10 C.m M = 2
https://share.polymtl.ca/alfresco/service/api/path/content;cm:content/workspace/SpacesStore/Company%20Home/Sites/des-materiaux-web/documentLibrary/I.%20Solutions%20-%20Chapitre%209/Cor9_19.pdf?a=true&guest=true
 Exercices et Problèmes Résolus de liaisons chimiques moments
Exercices et Problèmes Résolus de liaisons chimiques moments
Quelle est la géométrie de l'isomère ayant le plus fort moment dipolaire ? Calculer ce moment. Solution. Il y a trois types d'isomères géométriques du
 Architecture de la matière
Architecture de la matière
Calculer le moment dipolaire de chacune des liaisons S-H. 2. Calculer le pourcentage ionique de cette liaison connaissant sa longueur : d = 13356 pm. On
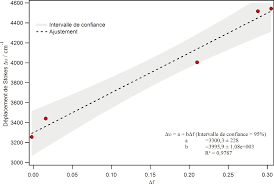 Détermination de la variation du moment dipolaire entre létat
Détermination de la variation du moment dipolaire entre létat
12 avr. 2023 (1) La méthode AM1 est une méthode de calcul de chimie quantique s'appuyant sur une approche Hartree-. Fock semi-empirique. Cette approche se ...
 L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
3) A partir du moment dipolaire global de la molécule SO2 calculer le moment dipolaire partiel d'une liaison. SO. On négligera le moment dipolaire associé
 Développement du moment dipolaire des molécules en fonction des
Développement du moment dipolaire des molécules en fonction des
(Laboratoires de Chimie Physique). Résumé. 2014 On rappelle l'état actuel des calculs sur les intensités des bandes d'absorption infrarouge pour
 Le moment dipolaire dune molécule
Le moment dipolaire dune molécule
Pour qu'une molécule soit polaire il faut qu'elle possède au moins une liaison polarisée et que le barycentre des charges négative ne coïncide pas avec le
 Le moment dipolaire dune molécule
Le moment dipolaire dune molécule
Le moment dipolaire mesure la polarité de la molécule. On utilisera cette relation pour calculer l'élément inconnu ( µliaison.
 L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
a) En utilisant longueur et moments dipolaires des liaisons 3) A partir du moment dipolaire global de la molécule SO2 calculer le moment dipolaire ...
 Electromagnétisme : PEIP 2 Polytech
Electromagnétisme : PEIP 2 Polytech
Nous verrons dans le prochain chapitre comment retrouver ce résultat avec beaucoup calcule le moment dipolaire autour d'une autre origine O . Le moment ...
 Architecture de la matière
Architecture de la matière
A. DEFINITION ET CALCUL V – MOMENT DIPOLAIRE DES MOLECULES : POLARITE DES MOLECULES ... Elle se calcule ainsi : Zf = Natome – (Npropre + ½. Nliant).
 Untitled
Untitled
a) Calculer le moment dipolaire de la liaison S-H dans cette molécule. b) Calculer le caractère ionique partiel de cette liaison connaissant la longueur de
 CORRIGE
CORRIGE
Exercice 8 : moment dipolaire. 1) Donner les représentations de 5) Calculer alors la valeur du moment dipolaire résultant apparaissant sur ces trois.
 Cours LP203 – 2012-2013 – Chapitre 4 – Le dipôle électrostatique
Cours LP203 – 2012-2013 – Chapitre 4 – Le dipôle électrostatique
4.2 Moment dipolaire. Le moment dipolaire noté p. ? est défini par : des équipotentielles
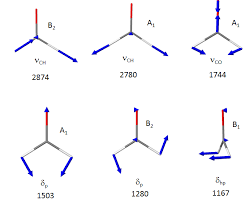
 Spectroscopie infrarouge
Spectroscopie infrarouge
Le moment dipolaire doit varier quand les atomes se déplacent les uns par rapport aux autres. Conséquences : ? Le mode normal d'élongation des molécules.
 Développement du moment dipolaire des molécules en fonction des
Développement du moment dipolaire des molécules en fonction des
(Laboratoires de Chimie Physique). Résumé. 2014 On rappelle l'état actuel des calculs sur les intensités des bandes d'absorption infrarouge pour
 Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Dans le cas de l'atome d'hydrogène le moment dipolaire se réduit à r calculer la projection du moment magnétique total ? sur ? . Le calcul de gj ...
Atomes et molécules - PCSI - Page 1 sur 28 DL ArchitecturedelamatièreChapitre6:élémentetatomeChapitre7:laclassificationpériodiquedesélémentsChapitre8:moléculesetsolvantsCours de chimie de première période de PCSI
Atomes et molécules - PCSI - Page 2 sur 28 DL DescriptionsdesentitéschimiquespolyélectroniquesObjetsetobjectifsdecechapitrePrésentationLaconnaissancedelastructureélectroniquedesmoléculesestfondamentalepourcomprendreleurgéométrie,leurspropriétésetleurréactivité.Ainsi,leschimistesont-ilsessayédedonnerunereprésentationdesmoléculesquiytraduiselemieuxpossiblelarépartitiondesélectrons.Silaq uantiqueapermisunecompré hensio napprofondiede lastructure électroniquedesatomesetmolécules,desmodèlessimplesetdonnantdesindicationsimportantessonttoujoursutilisésparleschimistes:ils'agitdelathéoriedeLewis,oùlesreprésentationsdesmoléculessontplanes,etdelaméthodeVSEPR,prolongementstéréochimiquesil'onpeutdire,delathéoriedeLewis.Toutesdeuxsontdéveloppéesdanscechapitre.Lesélectronsdecoeur,trèsliésaunoyau,neparticipentpasàlaformationdesliaisonschimiques:nousneconsidér erons,dans lasuite,quelesseulsélectronsde valencedesatomes,seulsresponsablesdelaréactivitédel'atomeetseulsmisenjeudansl'édificepolyatomiquequ'es tl'entitéchimique.Enfin,notons qu'uneentitéchimiqueeststableparcequel'énergietotaledesatomesliéspardesliaisonschimiquesestinférieureàcelledecesatomesséparés.Objectifsdecechapitre1)EcrireleschémadeLewisd'unédifice2)Repérerlesliaisonscovalenteslocaliséesetcellesquisontdélocalisées3)PrévoirlagéométriedesédificesparlaméthodeV.S.E.P.R
Atomes et molécules - PCSI - Page 3 sur 28 DL I-LALIAISONCOVALENTELOCALISEEDANSLATHEORIEDELEWIS41.DEFINITIONDELALIAISONCOVALENTELOCALISEE:THEORIEDELEWISETDELANGMUIR42.SCHEMADELEWISD'UNATOME53.REGLEDEL'OCTET5A.ENONCE5B.EXEMPLES:DISTINCTIONDOUBLETLIANT/DOUBLETNON-LIANT(LIBRE)64.LESLIMITESDELAREGLEDEL'OCTET7A.COMPOSESDEFICIENTSENELECTRONS-ACIDESDELEWIS7B.EXPANSIONDELACOUCHEDEVALENCE-ATOMESHYPERVALENTS.7C.REGLEDES18ELECTRONS8D.COMPOSESANOMBREIMPAIRD'ELECTRONS95.CHARGEFORMELLED'UNATOMEDANSUNEDIFICEPOLYATOMIQUE10A.DEFINITIONETCALCUL10B.EXEMPLES10II-ENERGIEDELIAISONETLONGUEURDELIAISON111.L'ENERGIEDELIAISON,INDICATEURDELAFORCEDELALIAISON112.LALONGUEURDELALIAISONENTREDEUXATOMES113.ORDRESDEGRANDEURSDESENERGIESETLONGUEURSDELIAISONSSIMPLESOUMULTIPLES12III-MESOMERIE;LIAISONSDELOCALISEES131.PRENONSDESMESURES...132.REGLESD'ECRITUREDESFORMESMESOMERES153.ENCHAINEMENTSDONNANTLIEUAUNEDELOCALISATIONELECTRONIQUE:EXEMPLES15A.SYSTEMECONJUGUE:DEFINITIONSETPROPRIETES15B.EXEMPLES16α-danslanature16β-danslelaboratoiredechimie18IV-PREVISIONDELAGEOMETRIEDESEDIFICESPARLAMETHODEVSEPR191.PRINCIPEDELAMETHODEVSEPR:TRAVAUXDEGILLESPIE192.LESDIFFERENTESGEOMETRIESDESEDIFICESPOLYATOMIQUES213.PREVISIONSPLUSELABOREES24V-MOMENTDIPOLAIREDESMOLECULES:POLARITEDESMOLECULES25VI-CONCLUSIONAUCHAPITRE:LIMITESDUFORMALISMEDELEWIS.28 LePlanducours
Atomes et molécules - PCSI - Page 4 sur 28 DL I-laliaisoncovalentelocaliséedanslathéoriedeLewis 1.Définitiondelaliaisoncovalentelocalisée:théoriedeLewisetdeLangmuir En1916,GilbertNewtonLewissuggèreque:"L'établissementd'uneliaisonchimiqueentredeu xatomesrésultedelami seencomm und'und oubletd'él ectronsd evalence».Pourformerune liaison,chacund esélectron sapporteunélectronoul'un desdeuxélectronsapporteledoublet:ChacundesatomesAetBapporteunélectronpourconstituerlaliaisoncovalente.Laliaisonestsymboliséeparuntiret:Ilyadéplacementd'unseulélectron:demi-flècheC'estunseulato mequiapp orteledouble td'électronsp ourconstit uerlaliaisoncovalente. L'espècequiapporteledoubletestledonneur:ilestappelébasedeLewis L'espècequiaccepteledoubletestl'accepteur:ilestappeléacidedeLewis Ilyaformationd'unadduitdeLewis Laliaisoncovalenteforméeestappeléedanscecasliaisondecoordination.Ilyadéplacementd'undoubletd'électrons:flècheentièreRem:les liaisonsson tassuréespardespaires d'électronsdi tesliantes,lesatomespeuventporterdespaireslibres.HCl
HCl AlCl Cl Cl NH H H N H H H Al Cl Cl Cl acide de Lewisbase de Lewis adduit de LewisAtomes et molécules - PCSI - Page 5 sur 28 DL 2.SchémadeLewisd'unatome LeschémadeLewisd'unatomenefaitapparaîtrequesesélectronsdevalence,disposésautourdusymbolechimiquedel'atome.Onydistinguelespairesd'électronsfiguréespardeuxpointsouuntiret,etlesélectronsseuls,figurésparunpoint. Eléments de la première et de la seconde période : Un doublet électronique peut être représenté soit p ar deux points proches ou bien par un tiret. Eléments de transition : Ex : cobalt : Z =27 : 1s2 2s2 2p6 3s2 3p6 4s2 3d7 : Co possède 2+7 = 9 électrons de valence : Un doublet électronique peut être représenté soit par deux points proches ou bien par un tiret. 3.Règledel'octeta.énoncé CetterèglefutintroduiteparlechimisteallemandRichardAbegg,dès1904: HHeLiBeBCNOFNe
Atomes et molécules - PCSI - Page 6 sur 28 DL Richard Abegg 1869- 1910 " A partir de la deuxième période de la classification périodique, les atomes tendent à s'entourer de quatre paires d'électrons de façon à acquérir la configuration électronique stable en ns2np6 du gaz rare le plus proche dans la classification périodique. » Rem:pourH:règleduduet. b.exemples:distinctiondoubletliant/doubletnon-liant(libre)EcrituredequelquesschémasdeLewis:ilyadesdoubletsliantsetdesdoubletsnon-liants(libres).édifice Schéma HCl Cl : Z=17 Cl : Z=17 H : 1 électron de valence Cl : 7 électrons de valence 1+7 = 8 8/2 = 4 Cl2 Cl : Z=17 N2 N : Z=7 NH4+ N : Z=7 H : Z=1 CO32- C : Z=6 O : Z=8 PH3 P : Z=15 H : Z=1
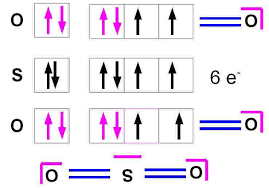
Atomes et molécules - PCSI - Page 7 sur 28 DL 4.Leslimitesdelarègledel'octet Sil'écrituredesschémasdeLewisestsimple,ilyacependantdenombreusesexceptionsàlarègledel'octet.Voyons-enquelquesunes. a.composésdéficientsenélectrons-acidesdeLewis ProposonsleschémadeLewisdutrichlorured'aluminiumAlCl3:AlCl3 Al : Z=13 Cl : Z=17 L'atomecentrald'alumi niumnerespectepasla règledel'octet:il yaundou blet d'électronsmanquant:cedéficitestsymboliséparunelacuneélectronique,représentéparunecasevide: Définition : Ainsi:réactionacide/baseausensdeLewis: NH3 + BF3 = H3N-B-F3 adduitdeLewis b.expansiondelacouchedevalence-atomeshypervalents. ProposonsleschémadeLewisdelamoléculed'hexafluoruredesoufreSF6:
Atomes et molécules - PCSI - Page 8 sur 28 DL SF6 S : Z=16 F : Z=9 Autreexemple:lamoléculedepentachloruredephosphorePCl5: PCl5 P : Z=15 Cl : Z=17 Larègledel'octetestbienvérifiéepourchacundesatomesdefluor,maisl'atomecentraldesoufre estluient ouréde12él ectrons,soit6doublet s.Cettemolécu leexi stecependantbeletbien!Conclusion:certainsatomespeuventêtreentourédeplusde8électrons:cesontdesatomesdits"hypervalents».Ilsdi sposentd'O Andsusceptiblesd'accueillir desélectrons.Apartirdelatroi sièmepé riodede laclassification,lesatomespeuvents'entourerdeplusde8électrons(ilspeuventformerunnombredeliaisonsimpleégalàleurnombred'électronsdevalence),ilsonthypervalents.Cettehypervalenceesttotalementexcluepourlesatomesdelapérioden°2:C,N,OetF.Finalement,larègledel'octetn'eststrictementsuiviequepourC,N,OetF.c.règledes18électrons Au-delàdelatroi sièmepér iode(ave cl'argoncommegazrare),laconfigu rationélectroniquestableestcelledugazrareavecdésormaislaconfigurationexternens2(n-
Atomes et molécules - PCSI - Page 9 sur 28 DL 1)d10np6.Lesélémentstendentalorsàacquerircetteconfigurationélectroniqueexterne,à18électrons:Règledes18électrons(Sidgwick1927):" A partir de la quatrième période, les éléments tendent à s'entourer de 18 électrons de façon à acquéri r la confi guration électro nique stable ns2(n-1)d10np6 ». Attention,noto nsbienquecetterè glen'estpasa ussiunifor mémentsuiviepar lesélémentsdublocdquen el'estl arègledel'o ctetp ourlesélé mentsdes premièrespériodes. d.composésànombreimpaird'électronsC'estlecasdelamoléculeNO.Une espèce possédant un ou plusieurs électrons non appariés (c'est à dire seul dans une OA) est un radical, ou espèce radicalaire. Ellepossèdeunepropriétémagnétiqueparticulière:elleestparamagnétique.(ElleestdétectéeparspectroscopieR.P.ERésonanceParamagnétiqueElectronique). NO N : Z=7 O : Z=8
Atomes et molécules - PCSI - Page 10 sur 28 DL 5.Chargeformelled'unatomedansunédificepolyatomiquea.DéfinitionetcalculC'estlacharge,quenousnoteronsZf,queporteunatomedansunédificeenadmettantquelesélectronsdesliaisonssontéquitablementpartagésentrelesatomesliés.Ellesecalculeainsi:Zf=Natome-(Npropre+½.Nliant)Formuledanslaquelle:Natome=nombred'électronsdevalencedel'atomeNpropre=nombred'électronsqueporte"seul»l'atomedansl'édifice(électronsdespaireslibresetéventuellementélectronlibre)Nliant=nombretotald'électronsliantsquepartagecetatomedansl'édifice.b.exemples Exemplesdecalculsdechargesformelles. ClO4- Cl : Z=17 O : Z=8 NO3- N : Z=7 O : Z=8 CO C : Z=6 O : Z=8
Atomes et molécules - PCSI - Page 11 sur 28 DL Achaquefois,ons'assureraquelasommedeschargesformellesestbineégaleàlachargequeportel'édifice.II-Energiedeliaisonetlongueurdeliaison 1.L'énergiedeliaison,indicateurdelaforcedelaliaisonNousdéfinissons,àcestadedel'année,l'énergiedeliaisoncommesuit. L'énergiedeliaisonnotéeDABdelaliaisonABestl'énergieàfournirafindedissocierlamoléculesenlesatomesAetB(oulesgroupesd'atomes),enphasegazeuse.DABestdoncassociéeàlaréaction:AB(g)=A(g)+B(g)DABestlaplupartdutempsexpriméeenkJ.mol-1 • Ilfautfournirdel'énergieafindecasserlaliaison:DABestpositive.2.LalongueurdelaliaisonentredeuxatomesLalongueurdelaliaisonABdABestégaleàladistanceentrelesnoyauxdesatomesAetBàl'équilibre.
Atomes et molécules - PCSI - Page 12 sur 28 DL Initialement,lesdeuxatomessontsuffi sammentéloig néspourqu'il n'yaitpasd'interactionentreeux;onconsidèrequel'énergiedusystèmeestnullelorsquelesatomessontinfinimentéloignésl'undel'autre.Aufuretàmesurequ'ilsserapprochentl'undel'autre,l'énergiediminuejusqu'àladistancedHH=74,14pm:c'estladistanceàl'équilibre,elleestappeléelongueurdeliaison;ensuite,l'énergieaugmenteaufuretàmesurequel'onrapprochelesdeuxatomes,àcausedelarépulsionentrelesnoyaux.D'aprèslacourbe,lavaleurminimaledel'énergieest-436kJ.mol-1;parconséquentl'énergieàfournirpourromprelaliaison(plusexactementici,unemoledeliaison)estégaleà436kJ.mol-1:c'estl'énergiedelaliaisonHH:DHH=436kJ.mol-1.3.Ordresdegrandeursdesénergiesetlongueursdeliaisonssimplesoumultiples• Onremarquequ'uneliaisonestd'autantpluscourtequ'elleestforte.Uneliaisonmultipleestplusfortequ'uneliaisonsimpleentrelesmêmesatomes.Quelquesexemplesd'énergie(valeursmoyennesenkJ.mol-1)etdelongueurdeliaisons(moyennesenpm): A-B DAB dAB A-B DAB dAB A-B DAB dAB H-H 436 74,14 O-H 467 96 C-C 347 154 H-F 565 92 O-O 146 147 C=C 614 134 H-Cl 427 127 C≡C 839 120 H-Br 366,35 141 F-F 154 142 H-I 298,4 161 Cl-Cl 239 199 O=O 495 121 Br-Br 193 229 C=O 745 120 C-H 413 109 I-I 149 267 C≡O 1 072 113 C-C 347 154 N≡N 941 110 C-O 358 143 C≡N 891 116 C-N 305 147 74,14 pm
- 436 kJ.mol -1 HH HH HH H H distance internuclÈaireÈnergie potentielle en kJ.mol
-1 0Atomes et molécules - PCSI - Page 13 sur 28 DL III-Mésomérie;liaisonsdélocalisées 1.prenonsdesmesures... L'ionnitriteapourformulechimiqueNO2-,c'estunconservateurutilisédansl'industrieagro-alimentaire(nitritedesodium).ProposonsunschémadeLewispourl'entitéchimiqueNO2-:Examinonslesrésultatsexpérimentaux:Onylit:IonnitriteNO2-:d(NO)=120pmetα=115°CONCLUSION:lesdeuxliaisonsNOontlamêmelongueur...Rendons-nousàl'évidence :ila rrivepa rfoisqu'unseulsché madeLewisserévèleinsuffisantpourdécrireunédificeréel.Sileseulschémadegauche-ouceluidedroite-suffisait,celasignifieraitqu'ilyadeuxlongueursdeliaisons différentes dansl'ionnitrite.Or,cen'estp aslecasexpérimentalementpuisqu'onnemesurequ'uneseulelongueurNO,quivaut120pm.Ilenestexactementdemêmepourlamoléculed'ozoneci-dessous:
Atomes et molécules - PCSI - Page 14 sur 28 DL OzoneO3:onsait,parl'expérience,quelamoléculed'ozonen'estpascycliqued'unepart,etd'autre part,on peutreleverlalongueurd eliaisondOO=127,8pm etα=117,47°ChacundesédificesprécédentsestdoncmieuxdécritparunensemblededeuxschémasdeLewis.Chacundesschémasaidantàladescriptiondel'édificeréelestappeléuneformemésomère.Desformesmés omères,ouf orme slimites,sontdesschémasdeLewis aidantàlareprésentationd'unemoléculeréellepossédantdesélectronsdeliaisondélocalisés.Danscesformesmésomèreshypothétiques,touslesélectronssontlocalisés.Lamoléculeréelleestunintermédiaireentrecesdifférentesformeslimites.Aucuneformemésomèren'existeréellement.CenesontquedesschémasdeLewissurlepapier,quipermettentdedécrirel'édificeréel.Celui-ciestunhydridederésonancedesdifférentesformesmésomèresledécrivant.Deuxformesmésomèressontliéesentreellesparladoubleflècheetuniquementparcettedoubleflèche:
Atomes et molécules - PCSI - Page 15 sur 28 DL Attention:cettedoubleflè chenetraduitaucunéquilibrepuisquedesformes mésomèresn'existentpas!2.Règlesd'écrituredesformesmésomères Parmilesformesmésomèresquel'onpeutécrirepourdécrireunemolécule(ouunion)réelle,certainesontunecontributionforte,etd'autresont"unpoids»trèsfaible.Lesformesayantleplusdepoidssontcellestellesque: Leschargesformellessoientminimiséesdansl'édifice Leschargesformellessoi entenaccordaveclesélec tronégativitésdesatomes. Larègledel'octetsoitsatisfaitepourC,N,OetF. Voirfeuilledistribuée 3.Enchaînementsdonnantlieuàunedélocalisationélectronique:exemplesLesexemples oùl'ondoitdécrireun édifice réelenutilis antplusieurs formesmésomèressontnombreuxetvariés,ilsserontaussisouventempruntésàlachimieorganiqueoùla mésomérieintervie ntfréquemmentpourjustifierla stabilitéd' unemoléculeoud'unintermédiaireréactionnel.Desespècespouvantêtredécritesparplusieursformesmésomèressonteneffetparticulièrementstables. a.Systèmeconjugué:définitionsetpropriétés Unsystèmeconjuguéestunsystèmedanslequelo nremarquerala successionsuivante:Forme
mésomère 1 Forme mésomère 2 crochetcrochetdouble flècheAtomes et molécules - PCSI - Page 16 sur 28 DL π-σ-π π-σ-nπ-σ-lIlenexisteplusieursdifférents,ilfautsavoirlesreconnaître.• Dansunsystèmeconjugué,lesélectronsdusystèmeconjuguéssontdélocaliséssurl'ensembledesatomesquiparticipentàlaconjugaison.• Lessystèmesconjuguéssontplans.• Laconjugaisonestunfacteurstabilisantetcettestabilisationpeutêtreévaluéeexpérimentalement.Cettestabilisationremarquablee xpliqueenpartic ulierlaréactivitétouteparticulièredubenzène,etdetouslescomposésditsaromatiques.• Lessystèmesconjuguésabsorbenttrèssouventlesradiationsdudomaineduvisible.b.Exemplesα-danslanatureCommençonsparidentifierpe ut-êtredessystè mesconjugués danslesmoléculessuivantes:liaison
multiple liaison simple liaison multipledoublet non liantlacune électroniqueAtomes et molécules - PCSI - Page 17 sur 28 DL Aprèslesgrandesmarées,lapêcheauxétrillessetermineparlabonnedégustationdecelles-ci,la cuissonarévéléela couleur orange,dueà lapré senced'unemolécule,l'astaxanthine.Identifierlesystèmeconjugué.Leflamandrosen'estpasenreste:sanourritureestfaitedecrevettesetpetitscrustacésquicontiennentduβ-carotène,entr'autres,quicoloresuperbementsonplumage!
CH 3 !"#$%#&'(#)*%."&-*"#0 '"##%)"#1(,2&34*(-/5,%6,+)%#$'(#)*%-()/*/7
!r!"#r$%&'()(*8r!r#r$%&'()(*%+',-)(*7/$,"#
6,+7&,)%&,%#!
'%$"&)*%)$%,15#%) /31",$(#$%CEr./-'0)(*
*(7(,"$$%C *9(&$"3#%1(,*(7.*","1.>**%C astaxanthineUne protéine masque la couleur rose cuissonProtéine dénaturée : couleur orangeAtomes et molécules - PCSI - Page 18 sur 28 DL β-danslelaboratoiredechimieExemple1Lamolécule debuta-1,3-dièneestplaneet représentéepar laformul esemi-développéesuivante:Laliaison centralepossèdeuncaractèrededouble liaisonCC, cedontnerendpascomptebienentend uceschémadeLewis.Cetteconstatat ionpeuts'expliquerparl'écrituredeplusieursformesmés omères.La moléculeréelleaunestructu re"intermédiaire»entrelestrois.L'onutiliseleplussouventlaformequiestneutre.Parailleurs,l'étudedeslongueursdeliaisonfournitlesrésultatssuivants:137-147-137pm.Onnotequelaliaisoncentraleauncaractèreprincipalementdeliaisonsimple,maisquandmêmeunpetitcaractèredeliaisondoubleaussi.Exemple2Lamoléculedebenzèneaunestructureaujourd'huiparfaitementdécrite,maisellefuttrèslongtempsintriganteettrèsdifficileàdécrire.béta-carotène
CH 3Contenuedanslatérébenthine
Contenudanslehoublon,
donnesonparfumàlabièrePrésentdanslebasilic
citronPrécurseurenC
5 detouslesterpènes importante.Ercarotène
lacarotte. l'automneparlachlorophylle.CH2CHCHCH2
Atomes et molécules - PCSI - Page 19 sur 28 DL D'autresexemplesempruntésàlachimieorganiquepeuventêtreutilisés:enparticulier,laspectroscopieinfrarougepermetladétectiondeconjugaisondansunemolécule.IV-PrévisiondelagéométriedesédificesparlaméthodeVSEPR V.S.E.P.R:ValenceShellEl ectronicPairsRepulsionOuRépulsionsdesPairesElectroniquesdelaCouchedeValence:R.P.E.C.V1.PrincipedelaméthodeVSEPR:travauxdeGillespie Laméthode VSEPRestuneméthod equipermetdeprévoirlagéométrieautourd'unatome, identifiécommel'atomecentraldel'édifice.CetteméthodeaétéexposéeparGillespieen1957,etpeutêtreperç uecommeleprol ongementstéréochimiqueduformalismedeLewis. L'approximationdedépartdelathéorieconsisteàassimilerlespairesd'électronsàdeschargesélectriquesponctuelles.Cellesdelacouchedevalenceévoluentàunedistance
Atomes et molécules - PCSI - Page 20 sur 28 DL comparabledunoyaudel'atome.Enpremièreapproximation,ellessontassujettiesàsedéplacersurunesphèredo ntlecentre estoccupé parlenoyau.L'arra ngementgéométriquequ'ellesadoptentsurcettesphèreestlaconséquencedeleurrépulsionmutuelle.Bienqu'ilnes'agissepasàproprementparlerd'uneinteractionélectrostatiqueentrechargesponctuelles,ca rlecomportementdesélectronsestrégi parleslo isdela mécaniquequantique,onobtientunrésultatcorrectenrecherchantl'arrangementquirendmaximumlesdistancesentrelespairesd'électrons.Ainsi:Al' intérieurd'unédificepolyatomique, lespairesél ectroniqueslibresoul iantesautourd'unatomecentralAsontdisposéesautourdecelui-cidefaçonàminimiserlesrépulsionsentreelles.Cela estobtenuenéloignant lepluspossible cespairesd'électronsdansl'espace.L'édificeestnotéAXpEq! Aestl'atomecentral! XestunatomeconnectéàA:ilyenap! EestundoubletlibreportéparA(peut-êtreunélectronseuldansquelquescas):ilyaenaq.Acepremierniveaud'approximation,iln'yapasdedistinctionàfaireentreundoubletliantetundoubletnonliant.Danscescondit ions,l'arr angementquiminimiselarépulsiondes doubletsdépendseulementdeleurnombre:p+q.Celacorrespondauxfiguresgéométriquessuivantesenselimitantàlacoordinationsix(commelestipuleleprogramme).
Atomes et molécules - PCSI - Page 21 sur 28 DL p + q = nFigure géométrique de répulsion2Segment de droite3Triangle 4Tétraèdre 5Bi-pyramide à base triangulaire 6Octaèdre Maisàcescinqtypesdefiguresgéométriques,correspondentdavantaged'arrangementsdespairesd'électronsquenousallonspasserenrevue. 2.Lesdifférentesgéométriesdesédificespolyatomiques En première approximation, les liaisons multiples sont traitées comme si elles ne faisaient intervenir qu'un seul doublet. Nousprendronsdesexemplesdemoléculesavecdesliaisonssimplesetdesmoléculesavecdesliaisonsmultiples.
Atomes et molécules - PCSI - Page 22 sur 28 DL p + q = 2 AX2E0 d(Be-Cl) = 0,117 nm α = 180 ° Linéaire α=180° d(C-O) = 0,116 nm α = 180 ° d(H-C) = 0,107 nm d(C-N) = 0,116 nm α = 180 ° p + q = 3AX3E0 d(B-F) = 0,130 nm α = 120 ° Planetriangulaire α=120° Valeurs suivantes en phase gazeuse : d(S-O) = 0,143 nm α = 120 ° d(C-Cl) = 0,174 nm d(C-O) = 0,117 nm α = 113,2 ° AX2E1 d(Sn- Cl) = 0,242 nm α = 95 ° Coudée α < 120° d(O-O) = 0,128 nm α = 117,47°
Atomes et molécules - PCSI - Page 23 sur 28 DL p + q = 4AX4E0 d(C-H) = 0,1094 nm α = 109,5 ° Tétraédrique α=109°28' d(S-O) = 0,150 nm α = 109 ° AX3E1 d(N-H) = 0,102 nm α = 107,8° Pyramidaleàbasetriangulaireα<109°28' d(P-I) = 0,243 nm α = 102 ° AX2E2 d(O-H) = 0,096 nm α = 104,5° Coudée α<<109°28' d(N-H) = 0,103 nm α = 104 ° p + q = 5AX5E0 d(P-Cléq) = 0,202 nm d(P-Clax) = 0,214 nm α(ClPCl) = 90 ° ; α (ClPCl) = 120 ° Bi-pyramidaleàbasetriangulaireα =90°et
Atomes et molécules - PCSI - Page 24 sur 28 DL d(Xe-O) = 0,180 nm d(Xe-F) = 0,200 nm α (OXeO) = 120 ° (valeurs estimées) α =120° p + q = 6 AX6E0 d(S-F) = 0,1564 nm α = 90° Octaèdre α =90° d(I-O) = 0,19 nm (valeur estimée) d(I-F) = 0,20 nm (valeur estimée) 3.Prévisionsplusélaborées a-InfluencedelanaturedesdoubletssurlesanglesentrelesliaisonsLesdoubletsnonliants,quisontmoinsconfinésdansl'espaceinternucléairequelesdoubletsliants,occupentunvolumemoyenplusélevé.Oninterprèteainsiladiminutionprogressivedel'angleentrelesliaisonsquandonpassedeCH4àNH3puisH2O.CH4AX4E0109,5°NH3AX3E1107,8°H2OAX2E2104,5° Répulsions (E/E) > Répulsions (E/X) > Répulsions (E/E)
Atomes et molécules - PCSI - Page 25 sur 28 DL b-InfluenceduvolumedesliaisonsmultiplesLesliaisons multiplesayantuneexpansionspat ialepl usgrande,leurprésencea tendanceàouvrirdavantagel'angleentreellesetlesautresliaisonsetdoncuneliaisonmultipleentraîneunefermeturedel'anglequiluiestopposé. HCHOAX2E1115,8°COCl2AX2E1111,3° Répulsions (A=X/A=X) > Répulsions (A=X/A-X) > Répulsions (A-X/A-X) V-Momentdipolairedesmolécules:polaritédesmolécules Undipôleélectrostatiqueestconstituédechargesdesigneopposé+qet-qdistantesd'unedistanced.Onappellemomentdipolairelevecteurdontlanormeestégaleauproduitdelachargeqparladistancedquiséparelesdeuxpoints. Lemomentdipolaireestunegrandeurvectorielle:2charges+qet-qdistantesdedformentundipôle .Lemomentdipolaireestunvecteurorientédu" -"vers le"+"etsanormevaut:=q.d(q>0).Siplusieursliaisonssontpolariséesdansunemolécule,lemomentdipolairetotalestlasommevectorielledecesmomentsdipolaires.- q+ qd
Atomes et molécules - PCSI - Page 26 sur 28 DL Pourcetteraison,lesmoléculesCO2,CCl4ouencoreSO3,quipossèdentdesliaisonspolarisées,ontunmomentdipolairetotalnulcar.Revenonsànosmolécules.Ladifférenced'électronégativitéentredeuxatomes(HetClparexemple)quisontengagésdansuneliaisonentraîneunedissymétriedeladensitéélectroniqueentrelesdeuxatomes.L'atomeleplusélectronégatif(Cl)vaattireràluiledoubletdelaliaisondanssonvoisinage,ladensitéélectroniqueestdoncaccrue:cetatomedevientporteurd'unechargenégative,notéed-Al'inverse,sur'autreatome(H),l'appauvrissementdeladensitéélectroniquevasetraduireparl'apparitiond'unechargepartiellepositive,notéed+Lesdeuxato mes,distantsd el(longueurdela liaison)constituentundipôle:lamoléculeHCIestditepolaire.LaliaisonH-Clestpolarisée.Autreexemple:lamoléculed'eauestpolaire:=1,8546DAutresexemples:sériedeshalogénuresd'hydrogène A-B µ / D d / pm δe = µ / d %I H-F 1,82 92 6,59.10-20 41 H-Cl 1,08 127 2,83.10-20 18 H-Br 0,79 142 1,85.10-20 12 H-I 0,38 161 7,86.10-20 5 Plusladifférenced'électronégativitéestgrandeentrelesdeuxatomes,pluslaliaisonestpolarisée.Cetteliaisonauncaractèreioniquedeplusenplusmarqué.Ainsi,pourHCI,onamesuréexpérimentalement:µ=1,1086Detd=127,46pm.Lepourcentageioniquedelaliaisonestégalà18,1.Exercice:calculerlanormedumomentdipolaireµdanslamoléculeHFsachantquelaliaisonH-Faunelongueurégaleà91,7pmetquelepourcentageioniqueestégalà41.Remarque:expressiondupourcentageioniqued'uneliaison:µliaisonsliaisons∑=0µ
ionique %.100 e.dAtomes et molécules - PCSI - Page 27 sur 28 DL Exercice:LemomentdipolairedelamoléculeH2Sestµ=0,978D.L'angleentrelesdeuxliaisonsS-Hvaut92,12°.1.CalculerlemomentdipolairedechacunedesliaisonsS-H.2.Calculerlepourcentageioniquedecetteliaisonconnaissantsalongueur:d=133,56pm.Ondonne1D=3,33.10-30C.mRem:onpeutcuireouréchaufferfacilementdesalimentsgrâceauxfoursmicro-ondes.Unrayonnementélectromagnétiquedefréquence2,45.109Hzobligelesmoléculesd'eaudesalimentsàs'orientersuivantlechampélectriquedurayonnement.Maislechamposcillant,lesmoléculesd'eaus eréorienten tdoncenpermanenceetce sontcesmouvementsincessantsetult rarapidesd'alignementsquiéchauffentl'ensembledu système.
Atomes et molécules - PCSI - Page 28 sur 28 DL VI-Conclusionauchapitre:limitesduformalismedeLewis. Planéitédeladoubleliaisondesalcènes,ouparamagnétismedeO2:voilàquelquesunsdesconstatsexpérimentauxquelathéoriedeLewisestincapabled'expliquer.Ilfaudraattendreunenouvellethéorie,lathéoriedesorbitalesmoléculaires,pourjustifieretinterprétercesobservations,maisceciestuneautrehistoire,unautrechapitre...diagrammed'orbitalesmoléculairesdeC2
quotesdbs_dbs50.pdfusesText_50[PDF] comment calculer un effectif a partir d'une frequence
[PDF] comment calculer un indice de refraction
[PDF] comment calculer un salaire médian
[PDF] comment calculer une année lumière en km
[PDF] comment calculer une fréquence cumulée croissante
[PDF] comment calculer une fréquence en pourcentage
[PDF] comment calculer une médiane dans un tableau
[PDF] comment calculer une proportion 5eme
[PDF] comment calculer une proportion avec des fractions
[PDF] comment capter rtbf avec antenne
[PDF] comment changer d'exercice sur ciel gestion commerciale
[PDF] comment changer mot passe caf
[PDF] comment changer pouzzolane fosse
[PDF] comment choisir un ordinateur portable performant
