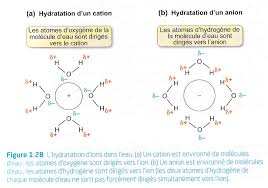
Chapitre 3 32 Polarité du trifluorure dazote 1. et 2. Les atomes
Chapitre 3 32 Polarité du trifluorure dazote 1. et 2. Les atomes
et le barycentre des charges partielles négatives G- est équidistant des trois atomes de fluor. G+ et G- étant distants
 Exercices : structure des molécules
Exercices : structure des molécules
CORRIGE. Exercices : atomes et molécules. PCSI lycée J .Dautet D.L. Page 2 sur 29 4) Les*molécules*et*ions*précédents*sontBils*polaires*?*. Tous*les*édifices ...
 CORRIGE
CORRIGE
8 nov. 2019 Exercice 2 : les métaux du groupe 2 (alcalino- terreux) ... L'urée est une molécule polaire des interactions de Van der Waals s'établissent donc.
 Atomes & molécules CORRIGE
Atomes & molécules CORRIGE
31 janv. 2019 EXERCICE 2 : LA MOLECULE CO. Le monoxyde de carbone de formule brute CO ... La molécule PCl5 est-elle polaire ? Justifier clairement votre ...
 écriture de lewis et géométrie de molécules et dions
écriture de lewis et géométrie de molécules et dions
Corrigé exercice 5. ÉCRITURE DE LEWIS ET GÉOMÉTRIE DE MOLÉCULES ET D'IONS. 1 La molécule est polaire. BF! et AlCl! La géométrie de ces molécules est le ...
 Corrigé des exercices
Corrigé des exercices
1CH.DF – Correction des exercices. 1. La matière. Module 1.7 : Autour de la molécule molécule est apolaire sinon elle est polaire (les moyennes sont les.
 Devoir surveillé n°2
Devoir surveillé n°2
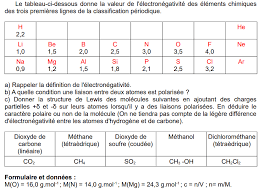
Exercice 2 (45 pts). Données : électronégativité des atomes. Azote : 3
 EXERCICES RATTRAPAGE SECONDE EXERCICES
EXERCICES RATTRAPAGE SECONDE EXERCICES
L'heptane de formule chimique C7H16
 Première générale - Exercices - Devoirs
Première générale - Exercices - Devoirs
Ces molécules sont-elles polaires ou apolaires ? Exercice 11 corrigé disponible. Dire si les molécules suivantes sont polaires ou apolaires : a. cyclohexane.
 EXERCICES
EXERCICES
Liste des exercices il faut le corriger car il manque une liaison entre le carbone et l'azote ... d. Déterminer si cette molécule est polaire.
 Première générale - Exercices
Première générale - Exercices
Exercice 8 corrigé disponible. Pour les molécules ou les ions suivants : - Représenter la formule de Lewis. - Indiquer si l'espèce chimique est polaire ou
 CORRIGÉ
CORRIGÉ
CORRIGÉ. Durée du devoir : 2 heures. ? EXERCICE 1 : 4 PTS de plus fortes interactions de type Keesom entre molécules polaires : sa température.
 TD n°4 SE2 Corrigé
TD n°4 SE2 Corrigé
TD n°4 SE2 Corrigé. Exercice 1 : extraction du diiode. 1-chloropropane : molécule polaire => s'ajoutent des interactions de type Keesom et Debye ...
 Atomes & molécules CORRIGE
Atomes & molécules CORRIGE
31 janv. 2019 EXERCICE 2 : LA MOLECULE CO. Le monoxyde de carbone de formule brute CO
 CORRIGE
CORRIGE
l'on*veu*utiliser*un*solvant(très(polaire*et*aprotique.*. *. *. Exercices : atomes et molécules. PCSI lycée J .Dautet D.L. Page 4 sur 29. Exercice 24 :
 Devoir surveillé n°2
Devoir surveillé n°2
3) Quelle est la molécule polaire ? Laquelle est apolaire ? Justifier. Exercice 3 (65 pts). On donne ci-dessus le modèle moléculaire du méthanol
 td corriges biochmv 2014-2015.pdf
td corriges biochmv 2014-2015.pdf
BIOCHIMIE - LES MOLECULES DE LA VIE. Exercices 2014-2015. PREPARATION de SOLUTIONS et PREPARATION du TP. EXERCICE 1 . Il faut préparer 500 mL d'une solution
 L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD N°6 – CORRIGE – Thierry BRIERE. Exercice 2 : La molécule SO2 a une géométrie en V ; l'angle des deux
 Corrigé TD Géométrie et polarité des entités chimiques
Corrigé TD Géométrie et polarité des entités chimiques
Exercice 2 - Géométrie et polarité de molécules. • HCHO : Ne =4+2+6=12 ? Nd = 6 La liaison C=O est polarisée : la molécule est polaire.
 [PDF] chapitre 4 de la structure à la polarité dune entité - EXERCICES
[PDF] chapitre 4 de la structure à la polarité dune entité - EXERCICES
Liste des exercices il faut le corriger car il manque une liaison entre le carbone et l'azote La molécule est polaire car les deux liai-
 [PDF] Correction exercices Chapitre 8 : De la structure à la polarité dune
[PDF] Correction exercices Chapitre 8 : De la structure à la polarité dune
La molécule de dioxygène ?Configuration électronique de l'atome d'oxygène : Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour
 [PDF] De la structure à la polarité dune entité - Exercices - Devoirs
[PDF] De la structure à la polarité dune entité - Exercices - Devoirs
Ces molécules sont-elles polaires ou apolaires ? Exercice 11 corrigé disponible Dire si les molécules suivantes sont polaires ou apolaires : a cyclohexane
 [PDF] Exercice 2 (45 pts)
[PDF] Exercice 2 (45 pts)
On donne ci-dessus le modèle moléculaire du méthanol de formule brute CH3OH ainsi que le modèle de la molécule d'eau Ces molécules sont polaires Données :
 [PDF] ex_chap7_correctionpdf
[PDF] ex_chap7_correctionpdf
EXERCICES RATTRAPAGE SECONDE La molécule de diazote est formée de deux atomes d'azote N (1s22s22p3) Préciser si cette molécule est polaire
 [PDF] DS4_corrigepdf - Chimie en PCSI
[PDF] DS4_corrigepdf - Chimie en PCSI
4 fév 2016 · CORRIGÉ Durée du devoir : 2 heures ? EXERCICE 1 : 4 PTS ? EXERCICE 2 : 4 PTS Le toluène est une molécule peu polaire
 [PDF] Atomes & molécules CORRIGE - Chimie en PCSI
[PDF] Atomes & molécules CORRIGE - Chimie en PCSI
31 jan 2019 · EXERCICE 1 : INTERACTIONS DE FAIBLES ÉNERGIES On donne les numéros atomiques suivant : H :1 P :15 S :16 On étudie les deux molécules PH3
 [PDF] Classe - AlloSchool
[PDF] Classe - AlloSchool
Exercice n°1 : Molécules moment dipolaire et solubilité 1 Pour les trois molécules suivantes : a) Attribuer à chaque atome les charges partielles
 Molécule polaire ou apolaire ? ? Exemple corrigé 1ère Chimie
Molécule polaire ou apolaire ? ? Exemple corrigé 1ère Chimie
20 fév 2022 · Molécule polaire ou apolaire ? Méthode ? exercice corrigé charge liaison polarité polaire Durée : 3:24Postée : 20 fév 2022
Comment déterminer une molécule polaire ?
Une molécule est polaire si les centres des charges partielles négatives et positives sont différents. Exemple : la molécule de sulfure d'hydrogène H2S. Une molécule est apolaire si les deux centres des charges partielles sont confondus.Comment savoir si un AA est polaire ?
Catégories d'acides aminés
La molécule sera plus polaire si la différence d'électronégativité entre les atomes est plus grande. Par exemple, les ramifications alcanes et les anneaux benzène sont considérés comme non polaires, mais les alcools et les amines sont polaires.- Une molécule polaire est une molécule qui ne partage pas uniformément les électrons à travers la liaison covalente et qui présente un dipôle sur les atomes impliqués.
CHIMIE PCSI
Devoir Surveillé n°4 Ȃ option PC et PSI
CORRIGÉ
Durée du devoir : 2 heures
EXERCICE 1 : 4 PTS
EXERCICE 2 : 4 PTS
EXERCICE 3 : 8 PTS
PROBLEME 1 : 30 PTS
PROBLEME 1 : 8 PTS
TOTAL RAMENÉ À UN BARÊME SUR 42 POINTS
Exercice 1 : éǀolution de tempĠratures d'Ġbullition t forces intermoléculaires et moment dipolaireA ² Evolution de PHPSpUMPXUHV G·pNXOOLPLRQ
Les électronégativités des halogènes (échelle de Pauling) et les températures
rassemblées ci-dessous :Halogéne X Cl Br I
Numéro atomique 17 35 53
P 3,16 2,96 2,66
Halogénure HX HCl HBr HI
Téb / °C - 85 - 67 - 35
En examinant seulement les électronégativités, cela ne correspond pas à ce que nous attendions parce que la liaison la plus polaire est la liaison H-Cl. Donc, en envisageant uniquement les interactions de Keesom, entre molécules2) Dans le cas où la réponse est négative, justifier le plus soigneusement possible
: il y a les interactions de London, les plus générales, qui doivent être prises en compte et sont importantes lorsque les molécules sont très polarisables, or la liaison la plus polarisable est la liaison HI. Et cette polarisabilité croissante des liaisons de HCl à HI va expliquer pourquoi les interactions de Debye sont beaucoup plus fortes entre moléc molécules HCl. La polarisabilité croissante des liaisons de HCl à HI explique donc pourquoi laébullition augmente de HCl à HI.
B - 0RPHQP GLSROMLUH G·XQH OLMLVRQ HP SRXUŃHQPMJH G·LRQLŃLPp0" ǯ±" ǡ n donne la longueur de la liaison et la norme du moment
Molécule HX HI
Longueur en nm 0,160
p en D 0,38 avec 1 D (debye) = 3,336.10-30 C.m.La norme du moment dipolaire p est : p = q.d
Où d est la longueur de la liaison entre H et I Ainsi, en ayant converti la norme du moment dipolaire en C.m :0,38 x 3,336.10-30 = q x 160.10-12
q = 7,92.10-21 = 0,0495 x e coulomb4) Calculer le ""...- ǯ...-±, qui sera noté Iion, de la liaison HI.
Si la liaison était purement ionique, alors la charge élémentaire serait égale à la
charge élémentaire e. ion vaut donc : Iion = 100x(0,0495 x e) /e = 4,95.Le pourcentage de ionicité vaut donc 4,95 %.
On donne : e = 1,6.10-19 C
Exercice 2 : solubilitĠ et tempĠratures d'Ġbullition et le phénol (90 g.L-1). Le toluène est un solvant aprotique : les molécules ne possèdent donc aucun hydrogène dit mobile. Le toluène est probablement peu polaire car les liaisons sont toutes très peu polarisées dans la molécule.Les int
un molécules : méthoxybenzène (154°C) et du phénol (182°C). ndon, et de faibles interactions de Keesom. Le méthoxybenzène est un composé polaire : outre les interactions de London, il y a de plus fortes interactions de type Keesom, entre molécules polaires : sa température Enfin, nous pouvons reprendre ce que nous venons de dire pour le méthoxybenzène sensiblement plus élevée du phénol.Données :
solvant eau Phénol Méthoxybenzène ToluèneSchéma de
Lewis H O H O H O CH3 CH3Exercice 3 : divers assemblages de C, N et O
A ² Assemblage atomique de C, N et O
Assemblons les atomes C, N et O, de différentes façons.1) Rappeler la configuration électronique fondamentale des 3 atomes 6C, 7N et 8O.
Identifier leurs électrons de valence.
C : 1s2 / 2s2 2p2
N : 1s2 / 2s2 2p3
O : 1s2 / 2s2 2p4
B ² O·LRQ Ń\MQMPH 2F1-
OCN-.2) Proposer deux formes structures de Lewis (formes mésomères) respectant les
règles de stabilité maximale pour cet anion.4+5+6+1 = 16 électrons de valence
16/2 = 8 doublets :
OCNOCN
es deux schémas, O et N, plus électronégatifs que C, peuvent accepter une charge négative. Gardons ces deux schémas de Lewis. lier à un cation métallique Mn+ de deux façons différentes ? type AX2E0 centré sur C un ion linéaire.C ² O·ion fulminate ONC-
composé extrèmement explosif.5) Proposer deux formes mésomères pour cet anion ONC-.
4+5+6+1 = 16 électrons de valence
16/2 = 8 doublets :
ONCONC
2 Voici deux formes mésomères mais qui, chacune, comportent beaucoup de charges formelles. Cet ion est pour ces raisons relativement instable.AX2E0 .
7) 1ǯ--ce qui peut justifier son instabilité à votre avis ?
Ce nombre de charge formelle importante justifie son instabilité. Rem : il est utilisé dans certains petits pétards par exemple. La colonne 15 contient les éléments azote N, phosphore P, arsenic As, antimoine Sb, et le bismuth est un métal. A ² découverte de composés uniquement M]RPpV MX ILO GHV VLqŃOHV"Dix-huitième siècle : ...ǯ- découverte de N2ǡ ""±- ǯ"ǡ --""± -
chimiste Daniel Rutherford, en 1772.1) Proposer le schéma de Lewis de la molécule N2.
N : 1s2 / 2s2 2p3
N2 : 10 électrons de valence / 5 doublets.
Schéma de Lewis :
NNDix-neuvième siècle : découverte de N3-, qui est synthétisé pour la première fois en 1890,
et qui est le constituant principal des airbag (NaN3).2) Proposer plusieurs formes mésomères de Lewis de la molécule N3-. Cet ion est-il
linéaire ? NNN 2NNNNNN
2Vingtième siècle : découverte de N5+, en 1999. La possible existence de cet ion et sa
également explosif.
Les formes mésomères décrivant cet ion sont représentées ci-dessous.NNNNNNNNNN
par une flèche. 2E1 Les répulsions impliquant un doublet libre étant plus forte, nous en déduisons que5) On mesure dans cet ion deux longueurs de liaison différentes : d1 = 110 pm et
d2 = 130 pm. Les indiquer sur un des schémas ci-dessous.NNNNNNNNNN
: elles sont plus courtes car laNNNNNNNNNN
Les longueurs peuvent donc être attribuées :NNNNNNNNNN
Liaison la plus courte : d1 = 110 pm
NNNNNNNNNN
Liaison la plus longue : d2 = 130 pm
B ² étude de composés phosphorés
B.1. Phosphates et acide sulfurique
de coke et de SiO2 dans un four électrique, à 1400°C :2 Ca3(PO4)(s) + 10 C(s) + SiO2(s) = 6 CaSiO3(s) + 10 CO(g) + P4(g)
des températures inférieures à 800°C, il se dissocie partiellement en des molécules P2.
La structure tétraédrique de la molécule P4 est la suivante : P P P P des atomes de phosphore dans la molécule tétraédrique P4 ? type AX3E1. base triangulaire observer autour de chacun des atomes de phosphore, avec des angles7) Cette réactivité très forte est due à la déformation de la molécule induite par le
valeur. Que valent-ils ? Ce qui veut dire que les angles valent tous 60°, r rapprochés : la molécule est instable. fortes pressions, il devient du phosphore noir, peu réactif. entendu plus électronégatif que P. augmente quand on monte dans une colonne et quand on parcourt une période de gauche à droite. La combustion du phosphore blanc dans le dioxygène est une réaction très vive,moléculaire de formule P4O10. La violence de cette réaction, ainsi que la toxicité du
phosphore et de son oxyde, font des bombes incendiaires au phosphore des armes particulièrement redoutables. Dans la fiche toxicologique sur le phosphore blanc, on trouve les pictogrammes et les phrases de danger suivants :9) 2..."" ǯ±quation de la réaction de combustion du phosphore (préciser en indice
P4(s) + 5 O2(g) = P4O10(s)
H3PO4.
PO ont rigoureusement la même longueur.
P : 5 électrons de valence O : 6 électrons de valence5+4x6+3 = 32 32/2 = 16 doublets
P O O OOPOO O O P O O OO POO O O11) Déterminer la géométrie de cet ion en utilisant la méthode VSEPR.
AX4E0 hore géométrie
tétraédrique différentes pour les longueurs de liaison PO : 152 et 157 pm. Dessiner la molécule H3PO4 et attribuer les longueurs de liaison PO. POO O O POO O O H H H H H H longues, elles mesurent 157 pm, et 2 sont plus courtes, elles mesurent 152 pm.Entre , , très
nombreuses13) Quelle est la formule du phosphate de sodium solide ? Le phosphate de sodium
dissolution par une équation de réaction. Préciser comment les molécules ǯ
Le phosphate de 43- et des ions sodium Na+.
Comme il doit être électriquement neutre, sa formule est donc : Na3PO4. + et des ions PO43- ionisant, et qui est dispersant aussi un solvant solvatant qui va donc solvater les ions : Solvatation des anions et solvatation des cations : source : Chimie3 / BURROWS / de Boeck B.2. Autres corps composés contenant du phosphoreB.2.1. La phosphine
d'un gaz incolore, légèrement plus dense que l'air, très toxique et extrêmement
1) Donner la géométrie de la phosphine prévue par la méthode VSEPR.
Schéma de Lewis de la phosphine : PH3
HPH H De type AX3E0, la molécule a une géométrie pyramidale à base triangulaire : H P HH2) Les angles expérimentaux HPH mesurent 93,5°. Commenter.
le Il est beaucoup plus petit parce que les répulsions qui mettent en jeu le doublet libre sont les fortes : liaisons HPH. de liaison. Dans les deux molécules, il y a un moment dipolaire. P est plus gros que N : la molécule de PH3 est plus polarisable, les interactions deLondon sont plus fortes dans PH3 que dans NH3.
Les deux molécules sont polaires, il y a donc dans les deux cas des interactions de type Keesom entre dipôles permanents et des interactions de Debye, entre moments permanents et induits. N étant plus électronégatif que P, on peut penser la molécule NH3 est plus polaire que la molécule PH3 que dans la phosphine. Notre conclusion est donc différente de celle basée sur les sont absentes dans la phosphine.B.2.2. Les halogénures de phosphore
pour substituer un groupe hydroxyle OH par un atome de chlore dans les molécules toxicité. pentachlorure de phosphore et dessiner soigneusement cette molécule en indiquant précisément la valeur des angles. PCl5 : 5 + 5x7 = 40 il y a 20 doublets à répartir ; ClPCl Cl Cl Cl ClPCl Cl Cl Cl vecteur moment dipolaire. Toutes les liaisons PCl sont polarisées mais la somme de tous les moments dipolaires est égale au vecteur nul : la molécule PCl5 est apolaire. En substituant un atome de chlore de PCl5 par un atome de fluor, on obtient la moléculePCl4F.
6) Montrer que deux isomères sont a priori possibles pour PCl4F.
Il y a deux types de position différente :
ClPCl Cl Cl ClCl en position axiale
F peut prendre la place de Cl dans la position axiale : ClPCl Cl F ClCl en position axiale
F en position axiale
F peut prendre la place de Cl dans la position équatoriale : FPCl Cl Cl ClCl en position axiale
)HQSRVLWLRQpTXDWRULDOH Il existe donc deux stéréoisomères différents. quotesdbs_dbs13.pdfusesText_19[PDF] pcl3 polaire
[PDF] taille organite
[PDF] relation entre couleur et structure chimique des pigments et colorants organiques
[PDF] fiche révision brevet physique chimie
[PDF] les molécules d'adhésion cellulaire
[PDF] fiche de révision brevet histoire nathan
[PDF] fiche sur les suites 1ere s
[PDF] comprendre le raisonnement par recurrence
[PDF] raisonnement par récurrence prepa
[PDF] le régime de vichy fiche de révision
[PDF] le régime de vichy résumé
[PDF] démonstration par récurrence d une inégalité
[PDF] oeuvre de molière en 1665
[PDF] moliere 1662