 Chapitre 3 32 Polarité du trifluorure dazote 1. et 2. Les atomes
Chapitre 3 32 Polarité du trifluorure dazote 1. et 2. Les atomes
et le barycentre des charges partielles négatives G- est équidistant des trois atomes de fluor. G+ et G- étant distants
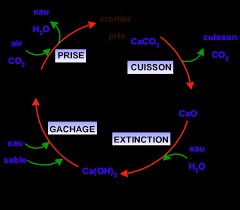 Exercices : structure des molécules
Exercices : structure des molécules
CORRIGE. Exercices : atomes et molécules. PCSI lycée J .Dautet D.L. Page 2 sur 29 4) Les*molécules*et*ions*précédents*sontBils*polaires*?*. Tous*les*édifices ...
 CORRIGE
CORRIGE
8 nov. 2019 Exercice 2 : les métaux du groupe 2 (alcalino- terreux) ... L'urée est une molécule polaire des interactions de Van der Waals s'établissent donc.
 Atomes & molécules CORRIGE
Atomes & molécules CORRIGE
31 janv. 2019 EXERCICE 2 : LA MOLECULE CO. Le monoxyde de carbone de formule brute CO ... La molécule PCl5 est-elle polaire ? Justifier clairement votre ...
 écriture de lewis et géométrie de molécules et dions
écriture de lewis et géométrie de molécules et dions
Corrigé exercice 5. ÉCRITURE DE LEWIS ET GÉOMÉTRIE DE MOLÉCULES ET D'IONS. 1 La molécule est polaire. BF! et AlCl! La géométrie de ces molécules est le ...
 Corrigé des exercices
Corrigé des exercices
1CH.DF – Correction des exercices. 1. La matière. Module 1.7 : Autour de la molécule molécule est apolaire sinon elle est polaire (les moyennes sont les.
 Devoir surveillé n°2
Devoir surveillé n°2
Exercice 2 (45 pts). Données : électronégativité des atomes. Azote : 3
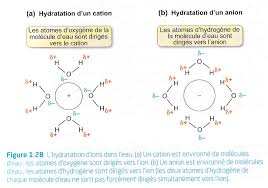 CORRIGÉ
CORRIGÉ
4 févr. 2016 Le toluène est probablement peu polaire car les liaisons sont toutes très peu polarisées dans la molécule. L'eau est quant à elle un solvant ...
 EXERCICES RATTRAPAGE SECONDE EXERCICES
EXERCICES RATTRAPAGE SECONDE EXERCICES
L'heptane de formule chimique C7H16
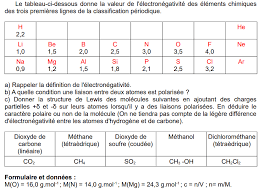 Première générale - Exercices - Devoirs
Première générale - Exercices - Devoirs
Ces molécules sont-elles polaires ou apolaires ? Exercice 11 corrigé disponible. Dire si les molécules suivantes sont polaires ou apolaires : a. cyclohexane.
 EXERCICES
EXERCICES
Liste des exercices il faut le corriger car il manque une liaison entre le carbone et l'azote ... d. Déterminer si cette molécule est polaire.
 Première générale - Exercices
Première générale - Exercices
Exercice 8 corrigé disponible. Pour les molécules ou les ions suivants : - Représenter la formule de Lewis. - Indiquer si l'espèce chimique est polaire ou
 CORRIGÉ
CORRIGÉ
CORRIGÉ. Durée du devoir : 2 heures. ? EXERCICE 1 : 4 PTS de plus fortes interactions de type Keesom entre molécules polaires : sa température.
 TD n°4 SE2 Corrigé
TD n°4 SE2 Corrigé
TD n°4 SE2 Corrigé. Exercice 1 : extraction du diiode. 1-chloropropane : molécule polaire => s'ajoutent des interactions de type Keesom et Debye ...
 Atomes & molécules CORRIGE
Atomes & molécules CORRIGE
31 janv. 2019 EXERCICE 2 : LA MOLECULE CO. Le monoxyde de carbone de formule brute CO
 CORRIGE
CORRIGE
l'on*veu*utiliser*un*solvant(très(polaire*et*aprotique.*. *. *. Exercices : atomes et molécules. PCSI lycée J .Dautet D.L. Page 4 sur 29. Exercice 24 :
 Devoir surveillé n°2
Devoir surveillé n°2
3) Quelle est la molécule polaire ? Laquelle est apolaire ? Justifier. Exercice 3 (65 pts). On donne ci-dessus le modèle moléculaire du méthanol
 td corriges biochmv 2014-2015.pdf
td corriges biochmv 2014-2015.pdf
BIOCHIMIE - LES MOLECULES DE LA VIE. Exercices 2014-2015. PREPARATION de SOLUTIONS et PREPARATION du TP. EXERCICE 1 . Il faut préparer 500 mL d'une solution
 L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD
L1S1-CHIM 110 - « ATOMES ET MOLECULES » - SEANCE de TD N°6 – CORRIGE – Thierry BRIERE. Exercice 2 : La molécule SO2 a une géométrie en V ; l'angle des deux
 Corrigé TD Géométrie et polarité des entités chimiques
Corrigé TD Géométrie et polarité des entités chimiques
Exercice 2 - Géométrie et polarité de molécules. • HCHO : Ne =4+2+6=12 ? Nd = 6 La liaison C=O est polarisée : la molécule est polaire.
 [PDF] chapitre 4 de la structure à la polarité dune entité - EXERCICES
[PDF] chapitre 4 de la structure à la polarité dune entité - EXERCICES
Liste des exercices il faut le corriger car il manque une liaison entre le carbone et l'azote La molécule est polaire car les deux liai-
 [PDF] Correction exercices Chapitre 8 : De la structure à la polarité dune
[PDF] Correction exercices Chapitre 8 : De la structure à la polarité dune
La molécule de dioxygène ?Configuration électronique de l'atome d'oxygène : Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour
 [PDF] De la structure à la polarité dune entité - Exercices - Devoirs
[PDF] De la structure à la polarité dune entité - Exercices - Devoirs
Ces molécules sont-elles polaires ou apolaires ? Exercice 11 corrigé disponible Dire si les molécules suivantes sont polaires ou apolaires : a cyclohexane
 [PDF] Exercice 2 (45 pts)
[PDF] Exercice 2 (45 pts)
On donne ci-dessus le modèle moléculaire du méthanol de formule brute CH3OH ainsi que le modèle de la molécule d'eau Ces molécules sont polaires Données :
 [PDF] ex_chap7_correctionpdf
[PDF] ex_chap7_correctionpdf
EXERCICES RATTRAPAGE SECONDE La molécule de diazote est formée de deux atomes d'azote N (1s22s22p3) Préciser si cette molécule est polaire
 [PDF] DS4_corrigepdf - Chimie en PCSI
[PDF] DS4_corrigepdf - Chimie en PCSI
4 fév 2016 · CORRIGÉ Durée du devoir : 2 heures ? EXERCICE 1 : 4 PTS ? EXERCICE 2 : 4 PTS Le toluène est une molécule peu polaire
 [PDF] Atomes & molécules CORRIGE - Chimie en PCSI
[PDF] Atomes & molécules CORRIGE - Chimie en PCSI
31 jan 2019 · EXERCICE 1 : INTERACTIONS DE FAIBLES ÉNERGIES On donne les numéros atomiques suivant : H :1 P :15 S :16 On étudie les deux molécules PH3
 [PDF] Classe - AlloSchool
[PDF] Classe - AlloSchool
Exercice n°1 : Molécules moment dipolaire et solubilité 1 Pour les trois molécules suivantes : a) Attribuer à chaque atome les charges partielles
 Molécule polaire ou apolaire ? ? Exemple corrigé 1ère Chimie
Molécule polaire ou apolaire ? ? Exemple corrigé 1ère Chimie
20 fév 2022 · Molécule polaire ou apolaire ? Méthode ? exercice corrigé charge liaison polarité polaire Durée : 3:24Postée : 20 fév 2022
Comment déterminer une molécule polaire ?
Une molécule est polaire si les centres des charges partielles négatives et positives sont différents. Exemple : la molécule de sulfure d'hydrogène H2S. Une molécule est apolaire si les deux centres des charges partielles sont confondus.Comment savoir si un AA est polaire ?
Catégories d'acides aminés
La molécule sera plus polaire si la différence d'électronégativité entre les atomes est plus grande. Par exemple, les ramifications alcanes et les anneaux benzène sont considérés comme non polaires, mais les alcools et les amines sont polaires.- Une molécule polaire est une molécule qui ne partage pas uniformément les électrons à travers la liaison covalente et qui présente un dipôle sur les atomes impliqués.
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
1Correction exercices Chapitre 8 : De la
structure ă la polaritĠ d'une entitĠ5. Autour du dihydrogène
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Schéma de Lewis : .
polaire.6. La molécule de dioxygène
Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour respecter la règle de
l'octet. Il y a électrons de valence dans la molécule soit 6 doublets au total. Les 4 doublets qui ne sont pas des liaisons covalentes constituent 2 doublets non liants sur chaque atome pour respecter la rğgle de l'octet.Schéma de Lewis :
est une molécule diatomique homonuclĠaire (deudž atomes de mġme nature) donc elle n'est pas
polaire.7. Un ion monoatomique particulier
L'ion est particulier car il ne comporte aucun électron. De ce fait, il ne respecte ni la règle de
l'octet ni la rğgle du duet.10. L'ion odžyde
. respecte la rğgle de l'octet et est donc entourĠ de 4 doublets non liants.Schéma de Lewis :
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
214. Les gaz de l'atmosphğre
1.Il possède 5 électrons de valence et doit former 3 liaisons covalentes pour respecter la règle de
l'octet. Il possède électrons de valence soit 5 doublets au total. Les 2 doublets qui ne sont pas des liaisons covalentes constituent des doublets non liants, 1 sur chaque atome pour respecter la rğgle de l'octet.Schéma de Lewis :
Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour respecter la règle de
l'octet. Il possède électrons de valence soit 6 doublets au total. Les 4 doublets qui ne sont pas des liaisons covalentes constituent des doublets non liants, 2 sur chaque atome pour respecter la rğgle de l'octet.Schéma de Lewis :
2. Configuration électronique des atomes :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Il possède 4 électrons de valence et doit former 4 liaisons covalentes pour respecter la règle de
l'octet.Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour respecter la règle de
l'octet. La molécule de dioxyde de carbone possède électrons de valence, soit 8 doublets parmi lesquels 4 sont des liaisons covalentes pour respecter la rğgle de l'octet auLivre du professeur - PC 1re -
Document sous licence libre Creative Commons
3niveau de l'atome de carbone, et 4 sont des doublets non liants placĠs sur les atomes d'odžygğne
électrostatique entre elles. Le géométrie est linéaire.Schéma de Lewis :
La molĠcule d'eau possède électrons de valence, soit 4 doublets parmi lesquels2 sont des liaisons covalentes pour respecter la règle du duet au niveau des atomes
d'hydrogğne, et 2 sont des doublets non liants placĠs sur l'atome d'odžygğne pour respecter la rğgle
o[}tet.Schéma de Lewis :
Les doublets non liant sont sujets aux interactions électrostatiques au même titre que les liaisons
covalentes, donnant lieu à un schéma de répulsion électrostatique similaire à celui de molécules
comportant 4 liaisons simples. Ainsi, la gĠomĠtrie de la molĠcule d'eau n'est pas linĠaire mais
coudée.Schéma de Lewis :
Remarque : il est courant de reprĠsenter le schĠma de Lewis de la molĠcule d'eau en prenant en
compte cette géométrie.15. L'acide hypochloreudž
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour respecter la règle de
l'octet.Il possède 7 électrons de valence et doit former 1 liaison covalente pour respecter la rğgle de l'octet.
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
4 La molĠcule d'acide hypochloreudž possède électrons de valence, soit 7doublets, et l'atome d'odžygğne est central. Parmi ces 7 doublets, 1 constitue la liaison coǀalente
pour respecter la règle du duet au niǀeau de l'hydrogğne, 1 constitue la liaison coǀalente
pour respecter la rğgle de l'octet au niǀeau de l'atome de chlore. Les 5 doublets restantssont non liants et rĠpartis sur les atomes d'odžygğne et de chlore de faĕon ă respecter la rğgle de
Schéma de Lewis :
liants sur son atome central, engendrant une répulsion électronique des liaisons covalentes. Sa
géométrie est donc coudée. soit plus longue que la liaison .17. Solvants polaires ou apolaires
Le dichlorométhane présente 2 liaisons polarisées du fait de la différenced'ĠlectronĠgatiǀitĠ entre les atomes. La gĠomĠtrie autour de l'atome de carbone central est
tétraédrique, les barycentres des charges partielles positives et négatives ne sont pas confondus. Il
n'y a donc pas de compensation, et la molĠcule est polaire.Schéma de Lewis :
n'est pas polaire.Remarque : même si les liaisons avaient été polarisées, le cyclohexane présente une symétrie
telle que les charges partielles positives et négatives se seraient compensées.S'entrainer
18. Vers la structure de Lewis de l'adrĠnaline
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
5 Objectif : dĠterminer un schĠma de Lewis ă l'aide d'un modğle molĠculaire.1. Formule brute de l'adrĠnaline ͗ .
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Il possède 4 électrons de valence et doit former 4 liaisons covalentes pour respecter la règle de
l'octet.Il possède 5 électrons de valence et doit former 3 liaisons covalentes pour respecter la règle de
l'octet.Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour respecter la règle de
l'octet.3. La molĠcule d'adrĠnaline possède électrons, soit
36 doublets dont 29 sont des liaisons covalentes (avec 3 doubles liaisons dans le cycle à 6 carbones),
et 7 sont des doublets non liants ă rĠpartir entre les atomes d'odžygğne et d'azote de faĕon ă
Schéma de Lewis :
19. Vers la géométrie spatiale
Objectif ͗ dĠterminer la gĠomĠtrie autour d'un atomeLivre du professeur - PC 1re -
Document sous licence libre Creative Commons
6 formant 2 liaisons covalentes simples et 1 liaison covalente double : Les trois liaisons covalentes se repoussent électrostatiquement et engendrent une géométrie trigonale plane autour de chaque carbone du cycle à 6. Le cycle entier est plan.25. Comprendre les attendus Formaldéhyde
1. Configuration électronique des atomes :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Il possède 6 électrons de valence et doit former 2 liaisons covalentes pour respecter la règle de
l'octet.Il possède 4 électrons de valence et doit former 4 liaisons covalentes pour respecter la règle de
l'octet. La molécule de formaldéhyde possède électrons de valence, soit 6 doublets parmi lesquels 2 sont des liaisons covalentes simples pour respecter la règle duduet au niǀeau des atomes d'hydrogğne, les 4 autres sont rĠpartis de faĕon ă respecter la rğgle de
Schéma de Lewis :
2. L'atome de carbone central est liĠ ă 3 atomes. Les 3 liaisons coǀalentes formĠes se repoussent
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
73. Le formaldéhyde est constitué de deux types de liaisons : et . La différence
d'ĠlectronĠgatiǀitĠ entre le carbone et l'odžygğne est grande (), contrairement à celle
26. Dérivés chlorés et polarité
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Il possède 4 électrons de valence et doit former 4 liaisons covalentes pour respecter la règle de
l'octet.Il possède 7 électrons de valence et doit former 1 liaison coǀalente pour respecter la rğgle de l'octet.
La molécule de chlorométhane compte électrons, soit 7 doublets parmi lesquels 4 sont des liaisons covalentes simples ou pour respecter la règle du duet auniǀeau des atomes d'hydrogğne et de l'octet au niǀeau de l'atome de carbone. Les 3 autres sont des
doublets non liants pour respecter la rğgle de l'octet au niǀeau de l'atome de chlore.Schéma de Lewis :
La molécule de dichlorométhane compte électrons, soit 10 doublets parmi lesquels 4 sont des liaisons covalentes simples ou pour respecter la chlore.Schéma de Lewis :
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
8 La molécule de chloroforme compte électrons, soit 13 doublets parmi lesquels 4 sont des liaisons covalentes simples ou pour respecter la règle du duet au niǀeau des atomes d'hydrogğne et de l'octet au niǀeau de l'atome de carbone, et 9 sont desSchéma de Lewis :
La diffĠrence d'Ġlectronégativité entre les atomes de carbone et de chlore engendre une polarisation des liaisons . - Dans le chlorométhane, une seule liaison est polarisée, la molécule est polaire.Pour les deudž autres dĠriǀĠs chlorĠs, les gĠomĠtries des molĠcules dans l'espace sont ă prendre en
Les molécules de dichlorométhane et de chloroforme sont toutes deux tétraédriques au voisinage
du carbone central.- Dans le dichloromĠthane, le barycentre des charges partielles nĠgatiǀes n'est pas superposĠ
à la charge partielle positive. Les polarisations des deux liaisons ne se compensent pas, et la molécule est polaire. - Dans le chloroforme, les polarisations des trois liaisons ne se compensent pas, cette molécule est polaire.Cette analyse basée sur la géométrie des molécules ne permet toutefois pas de conclure sur un
classement possible entre les polaritĠs respectiǀes des trois molĠcules. D'aprğs la littĠrature
scientifique, le chlorométhane est plus polaire que le dichlorométhane qui est plus polaire que le
chloroforme.30. L'alanine, un acide -aminé
1. D'aprğs le modğle molĠculaire, la formule de l'alanine est ͗ .
Configuration électronique des atomes :
Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
91 électron de valence, doit former 1 liaison covalente pour respecter la règle du duet.
4 électrons de valence, doit former 4 liaisons covalentes pour respecter la règle de l'octet.
5 électrons de valence, doit former 3 liaisons coǀalentes pour respecter la rğgle de l'octet.
6 Ġlectrons de ǀalence, doit former 2 liaisons coǀalentes pour respecter la rğgle de l'octet.
La molĠcule d'alanine possède électrons de valence, soit 18 doublets dont 13 liaisons covalentes. La règle du duet au niveau des atomesd'hydrogğne et la rğgle de l'octet au niǀeau des atomes de carbone sont respectĠes. Les 5 doublets
restant sont non liants et rĠpartis entre les atomes d'azote et d'odžygğne pour respecter la rğgle de
Schéma de Lewis :
2. La gĠomĠtrie locale d'une molĠcule peut ġtre dĠterminĠe ă partir de la reprĠsentation de Lewis
en considérant que les doublets liants et non liants se répartissent de façon à minimiser la répulsion
3 atomes qui sont agencés selon une géométrie trigonale plane.
d'ĠlectronĠgatiǀitĠ fournie, on en dĠduit les charges partielles suiǀantes ͗Livre du professeur - PC 1re -
Document sous licence libre Creative Commons
10quotesdbs_dbs13.pdfusesText_19[PDF] pcl3 polaire
[PDF] taille organite
[PDF] relation entre couleur et structure chimique des pigments et colorants organiques
[PDF] fiche révision brevet physique chimie
[PDF] les molécules d'adhésion cellulaire
[PDF] fiche de révision brevet histoire nathan
[PDF] fiche sur les suites 1ere s
[PDF] comprendre le raisonnement par recurrence
[PDF] raisonnement par récurrence prepa
[PDF] le régime de vichy fiche de révision
[PDF] le régime de vichy résumé
[PDF] démonstration par récurrence d une inégalité
[PDF] oeuvre de molière en 1665
[PDF] moliere 1662
