 SPECTRES DABSORPTION INFRAROUGES DES URÉES
SPECTRES DABSORPTION INFRAROUGES DES URÉES
type RNHCONHCHZ donnent i 7.05 p urle bande d'absorption constante qui semble caracteriser le groupement CHNH CONH-. Suit une explication g41l6rale.
 SPECTROGRAPHIE DABSORPTION INFRAROUGE ET ISOMERIE
SPECTROGRAPHIE DABSORPTION INFRAROUGE ET ISOMERIE
Tableau I. Bandes d'absorption infrarouge observees sur les spectres des tartrates droits (ou gauches) (Frequences exprimees en cm-1).
 Spectres infrarouges des minéraux salins et des silicates néoformés
Spectres infrarouges des minéraux salins et des silicates néoformés
On se contentera de rappeler ici que les bandes d'absorption infrarouge sont dues aux vibrations des atomes autour de leur position d'équilibre. La masse des
 Université de Montréal Analyse de spectres dabsorption avec creux
Université de Montréal Analyse de spectres dabsorption avec creux
calcul des spectres d'absorption des complexes avec ligand de type Tableau 5.2 : Comparaison entre les largeurs des bandes du spectre du complexe.
 Fiche professeur Lanalyse spectrale : spectroscopies IR et RMN
Fiche professeur Lanalyse spectrale : spectroscopies IR et RMN
Analyse de spectres et bandes d'absorption classiques. 1. Allure d'un spectre Point commun à tous les spectres : bandes d'absorption multiples entre.
 Université de Montréal Etude de systèmes de bandes dabsorption
Université de Montréal Etude de systèmes de bandes dabsorption
Les bandes provenant de transitions d-d permises par le spin sont visibles sur les spectres d'absorption de nombreux complexes des métaux de transition [4].
 COMPRENDRE - La spectroscopie infrarouge
COMPRENDRE - La spectroscopie infrarouge
l'absorbance en fonction de la lon- gueur d'onde est appelée le spectre. La matière interagit avec les ondes bandes d'absorption car la liaison peut.
 SPECTRES DÉMISSION ET DABSORPTION THEME : LUNIVERS
SPECTRES DÉMISSION ET DABSORPTION THEME : LUNIVERS
raie. Ils peuvent donc conclure à raison pour eux
 Activité 2 - Chapitre 4 : les spectres infrarouges (IR)
Activité 2 - Chapitre 4 : les spectres infrarouges (IR)
Une transmittance de 0% ? Justifier alors pourquoi les bandes d'absorption pointent vers le bas. ? Le domaine infra-rouge du spectre des radiations
 Spectres dabsorption et structure des molécules des dérivés
Spectres dabsorption et structure des molécules des dérivés
Les trois diiodobenzènes ne présentent aucune bande fine; le spectre d'absorption ultraviolet est absolument continu et commence aux environs de 3 000 ou 3
 Chapitre IX Introduction à la spectroscopie Spectroscopie de
Chapitre IX Introduction à la spectroscopie Spectroscopie de
Lorsque le signal enregistré présente une certaine largeur on parle de bande d’absorption (spectre de bandes) ; dans certains cas ces bandes étant très étroites on parle de spectres de raies Les spectres d’absorption dans le domaine UV-visible sont en général présentés sous la forme A = f( ) ou = f( ) Les bandes d
 I Description et origine d’un spectre infrarouge
I Description et origine d’un spectre infrarouge
5 Dans le spectre du pent-1-ène deux autres bandes d’absorption sont repérables A quel nombre d’onde sont-elles situées ? A quelles liaisons correspondent-elles ? Les repérer dans le spectre 6 Dans le spectre du propanoate d’éthyle une fine bande est également visible dans la zone de l’empreinte digitale La repérer dans le
 SUR LA STRUCTURE DE BANDE ET LE SPECTRE D'ABSORPTION DE Cu2O
SUR LA STRUCTURE DE BANDE ET LE SPECTRE D'ABSORPTION DE Cu2O
SUR LA STRUCTURE DE BANDE ET LE SPECTRE D'ABSORPTION DE CuO par Mme S BRAHMS J P DAHL(*) [et S NIKITINE Laboratoire de Spectroscopie et d'optique du Corps Solide Institut de Physique Université de Strasbourg Résumé - Des mesures du spectre de réflexion et d'absorption aux hautes et aux basses tempé-
 Searches related to spectre de bandes d+absorption PDF
Searches related to spectre de bandes d+absorption PDF
spectre II les spectres d’absorption : 1) Expériences : Avec un gaz : On fait brûler du sel dans la flamme du bec bunsen La flamme devient jaune On observe une raie noire qui apparaît superposée au spectre continu de la lumière blanche Avec une solution aqueuse : Rétroprojecteur + cuve de permanganate de potassium + réseau :
Comment trouver la fréquence d'un spectre ?
Si vous connaissez déjà la fréquence, consultez la table de fréquences IR ci-dessus. Pour utiliser une table de correspondance de spectres IR, commencez par chercher la fréquence ou le composé qui vous intéresse dans la première colonne, selon la table que vous consultez.
Qu'est-ce que la table de correspondance des spectres ?
La table de correspondance des spectres IR est un tableau destiné à être utilisé en spectroscopie infrarouge. Ce tableau répertorie les plages de fréquences, l'aspect de la vibration (intensité et largeur de la bande) et l'absorption des groupements fonctionnels en spectroscopie IR.
Quelle est la résolution d'un spectromètre?
Les échantillons sont analysés par spectrométrie infra- rouge à transformée de Fourier (IRTF) en mode trans- mission avec un spectromètre Nicolet Impact 410. Les spectres sont enregistrés avec une résolution de 2 cm
Quels sont les spectres de la silice?
Leurs spectres IRTF sont donc essentiellement caracté- risés par le triplet des vibrations Si-O de la silice, constitué : ? d'une bande large et intense à 1 080 cm–1, ? d'une bande de faible intensité à 780 cm–1, ? et d'une bande d'intensité moyenne à 470 cm–1.
Observer:
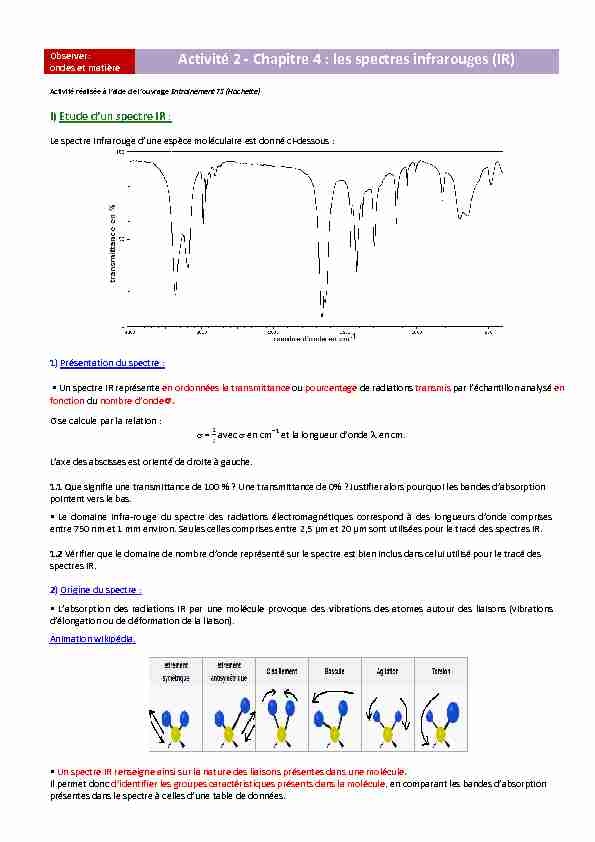
ondes et matière Activité 2 - Chapitre 4 : les spectres infrarouges (IR) ActiǀitĠ rĠalisĠe ă l'aide de l'ouǀrage Entrainement TS (Hachette)I) Etude d'un spectre IR :
Le spectre infrarouge d'une espğce moléculaire est donné ci-dessous :1) Présentation du spectre :
Un spectre IR représente en ordonnées la transmittance ou pourcentage de radiations transmis par l'Ġchantillon analysĠ en
fonction du nombre d'onde .ʍ se calcule par la relation :
avec en cm1 et la longueur d'onde en cm. L'adže des abscisses est orientĠ de droite ă gauche.1.1 Que signifie une transmittance de 100 % ? Une transmittance de 0% ? Justifier alors pourquoi les bandes d'absorption
pointent vers le bas.entre 750 nm et 1 mm environ. Seules celles comprises entre 2,5 µm et 20 µm sont utilisées pour le tracé des spectres IR.
spectres IR.2) Origine du spectre :
L'absorption des radiations IR par une molĠcule provoque des vibrations des atomes autour des liaisons (vibrations
d'Ġlongation ou de dĠformation de la liaison).Animation wikipédia.
Un spectre IR renseigne ainsi sur la nature des liaisons présentes dans une molécule.3) Analyse du spectre :
3.1 En se reportant à la table IR fournie et/ou à la table de données du livre page 594, déterminer si cette espèce peut contenir
les groupes ou liaisons :C=O, N-H, N-H2, C-C, C=C, C-N, Ctet-H.
Remarque : on notera les atomes de carbone Ctet pour un carbone tétraédrique (4 liaisons simples), Ctri pour un carbone
trigonal (1 liaison double), et Cdi pour un carbone digonal (1 liaison triple ou deux liaisons doubles).
3.2 Cette molécule peut-elle être : le propène, le propane, le propanamide, le N-méthyléthanamide ? Justifier.
II) Cas particulier des liaisons hydrogène :
Les figures 1 et 2 ci-dessous sont des edžtraits de spectres IR de l'Ġthanol.Le spectre de la figure 2 a ĠtĠ rĠalisĠ aǀec de l'Ġthanol en solution dans le tĠtrachlorure de carbone (CCl4), le spectre de la
figure 1 avec de l'Ġthanol en solution dans l'eau. Les solutions sont diluĠes.1. Ecrire la formule semi-dĠǀeloppĠe de l'Ġthanol.
2. La figure 1 et la figure 2 signalent toutes deux la présence de la liaison covalente O-H dans la molĠcule d'Ġthanol :
a) DĠterminer les nombres d'ondes correspondants. b) Quelles autres différences relève-t-on en comparant les deux liaisons O-H signalées ? c) Justifier la prĠsence de ces diffĠrences d'aprğs l'ĠnoncĠ et les donnĠes.3. Conclure sur l'influence de la formation de liaisons hydrogğne.
Remarque :
Pour les généralités concernant les bandes C-H, C=C, C=O, C-O et N-H/N-H2, se référer au paragraphe 3.3 p. 96 du livre.
On retiendra également :
En général, plus la liaison est forte, plus le nombre d'onde ʍ d'absorption est élevé.
Données : - reprĠsentation spatiale de la molĠcule d'eau H O H - la molécule de tétrachlorure de carbone est apolaire et n'Ġtablit pas de liaison hydrogğne aǀec l'éthanol O-H O-H Pour les acides carboxyliques en solution relativement concentrée, le déplacement de la bande O-H dû aux liaisons hydrogène provoque un chevauchement des bandes d'absorption des liaisons O-H avec la bande d'absorption Ctet-H.Observer:
ondes et matière Activité 2 - Chapitre 4 : les spectres infrarouges (IR)_Eléments de correction (PROF)I) Etude d'un spectre IR :
3) Analyse du spectre :
3.11650 cm1 possède un groupe C=O. Pour C=O = 1680 cm1 3100 cm1 cm1 et 3400 cm1, la molécule N-H2-H car il y aurait un simple pic non dédoublé. 1000 cm1 C-C. 1625 cm1 1000 cm1 liaisons C-N. 2800 cm1 liaisons Ctet-H. 3.2 car 2. Le propanamide a pour formule semi-développée : Il H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3 II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande -H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36
3100 cm1 cm1 et 3400 cm1, la molécule N-H2-H car il y aurait un simple pic non dédoublé. 1000 cm1 C-C. 1625 cm1 1000 cm1 liaisons C-N. 2800 cm1 liaisons Ctet-H. 3.2 car 2. Le propanamide a pour formule semi-développée : Il H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3 II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande -H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36
1000 cm1 C-C. 1625 cm1 1000 cm1 liaisons C-N. 2800 cm1 liaisons Ctet-H. 3.2 car 2. Le propanamide a pour formule semi-développée : Il H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3 II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande -H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36
1625 cm1 1000 cm1 liaisons C-N. 2800 cm1 liaisons Ctet-H. 3.2 car 2. Le propanamide a pour formule semi-développée : Il H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3 II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande -H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36
1000 cm1 liaisons C-N. 2800 cm1 liaisons Ctet-H. 3.2 car 2. Le propanamide a pour formule semi-développée : Il H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3 II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande -H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36
2800 cm1 liaisons Ctet-H. 3.2 car 2. Le propanamide a pour formule semi-développée : Il H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3 II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande -H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36
H3CCH2C
O NH2 Le N-méthyléthanamide a pour formule semi- développée : Il ne peut secondaire (groupe NH et non NH2) H3CC O NHCH3II) Cas particulier des liaisons hydrogène :
2. a) et b)
La liaison O- on dans le tétrachlorure de
carbone car des liaisons hydrogène. fortement polarisée. -H est à 3350 cm1, elle est large et intense. Dans la figure 2, la bande-H est à 3650 cm1, elle est fine et peu intense. La figure 1 correspond donc à un spectre où
: . La figure 2en solution dans le tétrachlorure de carbone. c) Elément de cours : Un spectre IR est modifié si certains groupes établissent des liaisons hydrogène. En présence de liaisons hydrogène, le pic
d'absorption est plus large et son nombre d'onde diminue (affaiblissement des liaisons covalentes O-H).
Exemple : la liaison OH absorbe entre 3580 cm1 et 3670 cm1 et prĠsente un pic fin en l'absence de liaison hydrogğne ;
elle absorbe entre 3200 cm1 et 3400 cm1 et présente un pic large en présence de liaisons hydrogène.
Exemple : spectre IR du propan-2-ol en solution aqueuse (présence de liaisons hydrogène).quotesdbs_dbs30.pdfusesText_36[PDF] bateau moteur grande autonomie
[PDF] effet de serre exposé
[PDF] quelle conversion réalise une centrale électrique
[PDF] quel élément la turbine permet-elle de faire tourner
[PDF] la lampe est elle un convertisseur d'énergie
[PDF] pourquoi une source d'energie primaire est elle indispensable a une centrale electrique
[PDF] catalogue peinture satinée pdf
[PDF] catalogue couleur peinture chambre pdf
[PDF] catalogue couleur peinture satinée
[PDF] lharmonie des couleurs pdf
[PDF] jeux danse animation
[PDF] activité danse maternelle
[PDF] module danse cycle 2
[PDF] test thomas-kilmann gratuit
