 TP N° 2 : Préparation dune solution par dissolution ou par dilution.
TP N° 2 : Préparation dune solution par dissolution ou par dilution.
En chimie une solution est un mélange homogène résultant de la dissolution d'un ou plusieurs soluté(s) (espèce chimique dissoute) dans un solvant. Lorsque le
 TP N°01 Le port de la blouse en coton blanche et assez longue est
TP N°01 Le port de la blouse en coton blanche et assez longue est
- Pour chaque TP vous devez rendre en fin de séance un compte-rendu qui sera Préparation des solutions. I. Objectifs. Préparer une solution par ...
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
Les notes correspondantes seront comptabilisées avec celles des comptes rendus et du contrôle final. • L'attitude de l'étudiant lors des séances de TP sera
 1- PRESENTATION Dans le domaine de chimie il y a des méthodes
1- PRESENTATION Dans le domaine de chimie il y a des méthodes
effectué lors du TP2 sur le TP1 (Règle de travail et de sécurité) et TP2 (Préparation des solutions). La note de TP = note du compte-rendu + note de contrôle TP.
 Travaux pratiques de chimie I 1 année technologie
Travaux pratiques de chimie I 1 année technologie
5- Les étudiants doivent remettre un compte rendu pour chaque TP. Une note Préparer les solutions de sels métalliques en introduisant dans des tubes à essaie.
 CONCOURS COMMUN INP CHIMIE GÉNÉRALE 1/ CONSIGNES
CONCOURS COMMUN INP CHIMIE GÉNÉRALE 1/ CONSIGNES
- rédiger un compte-rendu de son TP. Avant le début de l'épreuve l En revanche
 EXEMPLE de COMPTE-RENDU en CHIMIE - C5_TP1
EXEMPLE de COMPTE-RENDU en CHIMIE - C5_TP1
par dilution d'une solution mère (de concentration connue) en espèce chimique à doser : → PREPARER LES SOLUTIONS NECESSAIRES POUR REALISER LA COURBE D' ...
 Travaux pratiques de chimie I 1 année technologie
Travaux pratiques de chimie I 1 année technologie
5- Les étudiants doivent remettre un compte rendu pour chaque TP. Une note TP N 2: Préparation d'une solution standard et détermination de sa densité. 17.
 TP-Préparation dune solution de concentration donnée par dilution.
TP-Préparation dune solution de concentration donnée par dilution.
Vous préciserez les différentes étapes. ° Réalisez votre projet ! ° Rédigez un compte-rendu qui explique votre raisonnement et tout ce que vous avez fait.
 TP N° 2 : Préparation dune solution par dissolution ou par dilution.
TP N° 2 : Préparation dune solution par dissolution ou par dilution.
TP N° 2 : Préparation d'une solution par dissolution En chimie une solution est un mélange homogène résultant de la dissolution ... 2)- Compte-rendu :.
 TP Chimie I
TP Chimie I
TP-N°03. PREPARATION de SOLUTIONS AQUEUSES. Par DISSOLUTION et DILUTION Explication sur les exigences du contenu et la présentation d'un compte-rendu.
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
comptes rendus et du contrôle final. • L'attitude de l'étudiant lors des séances de TP sera prise en compte lors de la notation (ponctualité préparation
 tp chimie1
tp chimie1
Préparation d'une solution aqueuse par dissolution d'un sel dans l'eau. les résultats de vos mesures expérimentales dans la feuille du compte rendu.
 PRESENTATION Dans le domaine de chimie il y a des méthodes et
PRESENTATION Dans le domaine de chimie il y a des méthodes et
- Comment préparer une solution par dissolution d'une espèce chimique et par dilution d'une solution concentrée ? Dr. N. BOUANIMBA. Remarque : Le Compte-rendu
 Travaux pratiques de chimie I 1 année technologie
Travaux pratiques de chimie I 1 année technologie
5- Les étudiants doivent remettre un compte rendu pour chaque TP. TP N 2: Préparation d'une solution standard et détermination de sa densité.
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
Instructions pour la rédaction du compte rendu de TP . TP I : Préparation d'une solution d'acide faible l'acide oxalique ................... 13.
 Travaux pratiques de chimie I 1 LMD Année 2019-2020 D. Benbezza
Travaux pratiques de chimie I 1 LMD Année 2019-2020 D. Benbezza
TP0 : Sécurité et initiation à la manipulation en chimie ………………. 01. TP 1 : Préparation de solution de Chlorure de sodium ……………….08.
 TP Chimie 2 Préparation de solutions aqueuses • Par dissolution d
TP Chimie 2 Préparation de solutions aqueuses • Par dissolution d
? Objectif : Préparer un volume V = 1000 mL de solution aqueuse de sulfate de cuivre (II) de concentration molaire c = 0
 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
TP1 : Préparation de solutions et dosage acide base … Afin de montrer à l'étudiant ce que doit contenir un compte rendu nous avons développé.
 COMMENT REDIGER UN COMPTE RENDU DE TP EN CHIMIE GENERALE
COMMENT REDIGER UN COMPTE RENDU DE TP EN CHIMIE GENERALE
En chimie une solution est un mélange homogène résultant de la dissolution d'un ou plusieurs soluté(s) (espèce chimique dissoute) dans un solvant Lorsque le solvant est l’eau la solution porte le nom de « solution aqueuse » Lorsque le solvant ne peut plus accueillir davantage de soluté la solution est dite saturée
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS - univ-chlefdz
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS - univ-chlefdz
Un compte-rendu doit contenir une introduction une partie expérimentale une partie résultat et une partie exploitation et conclusion (ce qui ne veut pas dire qu'un tel découpage est forcément adapté à chaque TP)
ANNÉE UNIVERSITAIRE 19/20 UNIVERSITÉ -BATNA2 (MOSTEFA BENBOULAID)
F ACULTÉ DE TECHNOLOGIE. DÉP.SC-ST (1ÈRE ANNÉE)TP CHIMIE1
1TP n°1
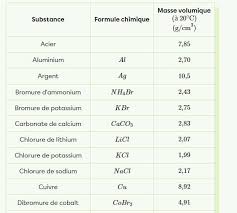
ΔϳϟΎΗϟΔϳϟϭϣϟϝΗϛϟϝϣόΗγNa = 23,0 g/mol ; Cl = 35,5 g/mol
ϡϗέϲϘϳΑρΗϟϝϣόϟΩλΎϘϣ1 Objectifs du TP n° 1
1- ϝϭϠΣϣϟϑϳέόΗ
1- Définition de la solution
Une solution est obtenue par dissolution d'une espèce chimique (solide, liquide ou gazeuse) dans un liquide appelé solvant : l'espèce
chimique dissoute est appelée soluté.Solution = soluté + solvant
Dans une
solution, le solvant est l'espèce chimique majoritaire et le soluté l'espèce minoritaire.Il y a une limite à la solubilité d'une espèce chimique dans un solvant, si l'on dépasse cette limite on obtient une solution saturée.
Si le solvant est l'eau, la
solution est appelée solution aqueuse.La solution est caractérisée par son homogénéité (pas de corps en suspension, ni de précipités) Savoir comment préparer une solution aqueuse :
En dissolvant une espèce chimique (solide) dans l'eauPar dilution à partir d'une solution mère.
Étude graphique de la relation entre la densité et le pourcentage en masse.ANNÉE UNIVERSITAIRE 19/20 UNIVERSITÉ -BATNA2 (MOSTEFA BENBOULAID)
F ACULTÉ DE TECHNOLOGIE. DÉP.SC-ST (1ÈRE ANNÉE)TP CHIMIE1
22- ΰϴϛήΘϟϒϳήόΗC
C(NaOH) = 4 g/L = 0,1 mol/L. MNaOH = NNaOH = 0,1 mol/L , [Na [OH ] = 0,1 mol/L, [H3O ] = 10 1 3 mol/L2- Définition de la concentration C :
On appelle concentration C d'une solution le rapport de la quantité du soluté sur le volume de la solution. Ainsi :
La concentration massique C
m (en g/L) est déterminée par le rapport de la masse du soluté sur le volume de la solution.
La concentration molaire C
M (en mol/L) est définie par le rapport du nombre de moles du soluté sur le volume de la solution. Notions spéciales (molarité, normalité, molalité)Molarité C (mol/L): c'est la concentration molaire du soluté i.e. nombre de mole du soluté par litre de solution.
Normalité N (eq.g/L): nombre d'équivalent gramme du soluté contenu dans un litre de solution.
Molalité b : nombre de mole du soluté par Kg de solvant.Titre (en %): c'est le pourcentage massique, c'est-à-dire, la masse du soluté (en g) contenue dans 100 g de solution.
Mode opératoire
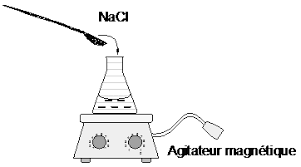
Première manipulation : Préparation d'une solution 1 - Prélever 60 ml d'eau distillée 2 - Les verser dans une fiole Erlenmeyer 3- A l'aide d'une spatule, ajouter progressivement le sel tout en agitant et s'assurer de sa dissolution,
jusqu'à apparition et persistance de sel insoluble très visible (de l'ordre d'une spatule).N = valence x C
΅ϓΎϛΗϟvalence
ANNÉE UNIVERSITAIRE 19/20 UNIVERSITÉ -BATNA2 (MOSTEFA BENBOULAID)
F ACULTÉ DE TECHNOLOGIE. DÉP.SC-ST (1ÈRE ANNÉE)TP CHIMIE1
3 4- Pour séparer le précipité, de la saumure ainsi obtenue, verser doucement la solution, en la
transvasant dans l'éprouvette graduée (préalablement pesée), en interposant un entonnoir muni de
papier filtre imbibé d'eau-Filtrer-Le filtrat obtenu, constitue la solution saturée. Prendre le volume
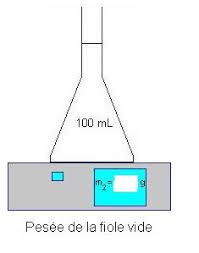
de la saumure. 5Procéde
r à la pesée de l'éprouvette graduée, contenant la saumure, à l'aide de la balance électronique, et
déduire la masse de la solution. (Remplir le tableau n°1).1 2 3a 3b 45
C'est la solution n° 0 (solution saturée).
Reporter les résultats de vos mesures expérimentales dans la feuille du compte rendu.Deuxième manipulation :
Préparation d'une solution
On utilisera la solution saturée, préparée précédemment afin de préparer une solution
diluée. 6 - Verser la solution saturée dans une fiole jaugée sèche de capacité de 100 mL. 7 - Compléter avec de l'eau distillée (par intermittence, b oucher et retourner plusieurs fois en agitant afin d'homogénéiser la solution). 8 - Ajuster le niveau de liquide au trait de jauge à la goutte près, à l'aide de la pissette. 9 - Boucher et retourner plusieurs fois en agitant à nouveau : la solution diluée est prête.C'est la solution diluée n°1
6 7
ANNÉE UNIVERSITAIRE 19/20 UNIVERSITÉ -BATNA2 (MOSTEFA BENBOULAID)
F ACULTÉ DE TECHNOLOGIE. DÉP.SC-ST (1ÈRE ANNÉE)TP CHIMIE1
4Étude
(par ̵ Préparer, par dilution, à partir de la solution S mère précédente (solution n°1), à chaque fois, 100 mL de différentes solutions salines diluées.Pour cela prélever, un volume V
mère (comme indiqué dans le tableau suivant) de la solution mère Smère (solution n°1). Introduire le prélèvement dans une fiole jaugée de capacité volumique V fille = 100 mL. Compléter avec de l'eau distillée jusqu'au trait de jauge (en agitant par intermittence afin d'homogénéiser la solution).Peser la solution obtenue.
Répéter la même opération pour tous les prélèvements.N° de la solution 0 1 2 3 4 5 6 7 8
Vmère (ml) sol.n°1 x x 50 25 13 6 3 2 1
Vfinal(ml) sol.fille x x 100 100 100 100 100 100 100On obtient ainsi, une série de solutions de sels diluées (à différent degrés de dilutions)
Compléter le tableau prévu à cet effet dans la feuille du compte rendu.έϳοΣΗˬϝϣόϟΫϫϥϣοΗϳ100 ϝϳϟΎΣϣϟϑϠΗΧϣϥϣϝϣfillesS ίϳϛέΗΑfilleC ϖΑΎγϟϝϭϠΣϣϟϥϣΎϗϼρϧˬΩϳΩϣΗϟΎΑmèreS .
filleV) ml 100( .ANNÉE UNIVERSITAIRE 19/20 UNIVERSITÉ -BATNA2 (MOSTEFA BENBOULAID)
F ACULTÉ DE TECHNOLOGIE. DÉP.SC-ST (1ÈRE ANNÉE)TP CHIMIE1
5 Instructions pour remplir le tableau du compte rendu Colonne C : n : Nombre de mole du soluté = Cmère*Vmère Colonne E: masse déduite la solution = masse totale (fille) - masse fiole vide.Colonne F : masse volumique de la solution (kg/m
3 Colonne G : densité de la solution (g/ml) : ݀=Colonne H : pourcentage en masse
Colonne I : Titre ou force de la solution (concentration massique en g de soluté par litre de solution).
T=݉
Colonne J: molarité ou concentration molaire en mol de soluté/L de solution.C=݊
Colonne K: molalité en mol de soluté par Kg de solvant. m=݊ avec ݊ (de la solution précédente)ANNÉE UNIVERSITAIRE 19/20 UNIVERSITÉ -BATNA2 (MOSTEFA BENBOULAID)
F ACULTÉ DE TECHNOLOGIE. DÉP.SC-ST (1ÈRE ANNÉE)TP CHIMIE1
6Le numéro du groupe et le nom et prénom de l"étudiant doit figurer dans la feuille du compte rendu et dans le
nom du fichier de compte rendu. Exemple : l"étudiant Si Abdallah mohamed groupe 26A Le nom du fichier de réponse sera comme suivi : groupe_26 _TP1_C1_Siabdallah_mohamed.pdf
ou groupe_26 _TP1_C1_Siabdallah_mohamed.docx
Le fichier de réponse est à envoyer à l"adresse que votre enseignante chargée du TP vous aura donner.
ϞΜϣϢϗέ2
l'étudiante BouAbdallah amira groupe 02B groupe_ 02B_TP1_C1_ BouAbdallah amira.pdf
ou groupe_ 02B_TP1_C1_ BouAbdallah amira.docx
quotesdbs_dbs10.pdfusesText_16[PDF] compte rendu tp hacheur serie
[PDF] compte rendu tp interference
[PDF] compte rendu tp lentilles minces
[PDF] compte rendu tp optique prisme
[PDF] compte rendu tp ph métrie
[PDF] compte rendu tp redressement et filtrage
[PDF] compte rendu tp redressement simple alternance
[PDF] compte rendu tp refraction de la lumiere
[PDF] compte rendu tp saponification
[PDF] compte rendu type de réunion
[PDF] compte usager bibliothèque paris
[PDF] comptes spéciaux du trésor maroc
[PDF] compteur electrique steg tunisie
[PDF] compteur electronique monophasé domestique me345