 DIPLÔME NATIONAL DU BREVET SESSION 2021 SCIENCES
DIPLÔME NATIONAL DU BREVET SESSION 2021 SCIENCES
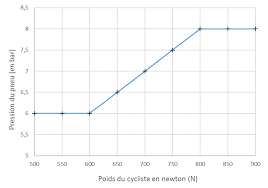
CODE SUJET : 21GENSCG11. Diplôme National du Brevet. Page 2/8. SESSION 2021. Epreuve : Sciences. PHYSIQUE-CHIMIE - Durée 30 minutes. Triathlon. Le triathlon est
 Sujet-Brevet-2017-SVT-physique-chimie-Polynésie.pdf
Sujet-Brevet-2017-SVT-physique-chimie-Polynésie.pdf
DIPLÔME NATIONAL DU BREVET. SESSION 2017. DEUXIÈME ÉPREUVE. 2e partie. PHYSIQUE-CHIMIE ET SCIENCES DE LA VIE Ce sujet comporte 5 pages numérotées de la 1/5 à ...
 BREVET BLANC n°1 de PHYSIQUE-CHIMIE
BREVET BLANC n°1 de PHYSIQUE-CHIMIE
BREVET BLANC n°1 de PHYSIQUE-CHIMIE. Ce sujet comporte 3 pages numérotées l'usage de la calculatrice est autorisé. LE CAFE. Note sur 20 : Page 2. 2. Document 1
 DIPLÔME NATIONAL DU BREVET SESSION 2022 SCIENCES
DIPLÔME NATIONAL DU BREVET SESSION 2022 SCIENCES
18 fév. 2021 L'utilisation du dictionnaire est interdite. Page 2. 22GENSCAN1. DNB – Épreuve de Sciences – Série générale. Page 2 sur 6. PHYSIQUE-CHIMIE – ...
 Untitled
Untitled
DIPLÔME NATIONAL du BREVET. Session 2016. PHYSIQUE - CHIMIE. Série générale. DURÉE : 45 min COEFFICIENT : 1. Ce sujet comporte 10 pages numérotées de 1/10 à 10/
 DIPLÔME NATIONAL DU BREVET SESSION 2017 PREMIÈRE
DIPLÔME NATIONAL DU BREVET SESSION 2017 PREMIÈRE
Ce sujet comporte 6 pages numérotées de la 1/5 à la page 5/5. Pour chaque PHYSIQUE-CHIMIE ET SCIENCES DE LA VIE. ET DE LA TERRE. Série générale. Durée de ...
 Untitled
Untitled
INFOS-BREVET L'épreuve de Physique-Chimie - SVT - Techno expliquée Ces points sont répartis de la façon suivante : -. 45 points pour les exercices de Physique ...
 SUJET DE BREVET
SUJET DE BREVET
PHYSIQUE-CHIMIE - Durée 30 minutes. Les démarches engagées et les essais même non aboutis
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB. 1/ Chimie : organisation Exercice : Sachant qu'un 1 kWh coûte environ 012 €
 BREVET BLANC 1 : EPREUVE SCIENCES PHYSIQUE CHIMIE
BREVET BLANC 1 : EPREUVE SCIENCES PHYSIQUE CHIMIE
EXERCICE 1 : Mesure du pH (sur 125 pts). Une solution aqueuse est un liquide contenant de l'eau est une substance dissoute. Elle peut être caractérisée par
 BREVET BLANC n°1 de PHYSIQUE-CHIMIE
BREVET BLANC n°1 de PHYSIQUE-CHIMIE
Ce sujet comporte 3 pages numérotées l'usage de la calculatrice est autorisé. LE CAFE. Note sur 20 : Page 2. 2. Document 1
 Untitled
Untitled
BREVET. &CORRIGÉS. SUJETS. Physique-Chimie. SVT. Technologie En juin 2017 l'examen du Brevet sera constitué de : ... 17 Exercice de Physique-Chimie.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB Exercice : Sachant qu'un 1 kWh coûte environ 012 €
 Brevet blanc no 2 : mathématiques physique-chimie et SVT
Brevet blanc no 2 : mathématiques physique-chimie et SVT
Prouver le résultat trouvé à la question 4. Page 2. Brevet blanc n° 2 SUJET 2. 41. EXERCICE
 Sujet-Brevet-2017-SVT-physique-chimie-Polynésie.pdf
Sujet-Brevet-2017-SVT-physique-chimie-Polynésie.pdf
DIPLÔME NATIONAL DU BREVET. SESSION 2017. DEUXIÈME ÉPREUVE. 2e partie. PHYSIQUE-CHIMIE ET SCIENCES DE LA VIE. ET DE LA TERRE. Série générale.
 BREVET BLANC 1 : EPREUVE SCIENCES PHYSIQUE CHIMIE
BREVET BLANC 1 : EPREUVE SCIENCES PHYSIQUE CHIMIE
EXERCICE 1 : Mesure du pH (sur 125 pts). Une solution aqueuse est un liquide contenant de l'eau est une substance dissoute. Elle peut être caractérisée par
 DIPLÔME NATIONAL DU BREVET SESSION 2021 SCIENCES
DIPLÔME NATIONAL DU BREVET SESSION 2021 SCIENCES
Diplôme National du Brevet. Page 2/8. SESSION 2021. Epreuve : Sciences. PHYSIQUE-CHIMIE - Durée 30 minutes. Triathlon. Le triathlon est une discipline
 DIPLÔME NATIONAL DU BREVET SESSION 2017 PREMIÈRE
DIPLÔME NATIONAL DU BREVET SESSION 2017 PREMIÈRE
DIPLÔME NATIONAL DU BREVET. SESSION 2017. Dès que le sujet vous est remis PHYSIQUE-CHIMIE ET SCIENCES DE LA VIE. ET DE LA TERRE. Série générale.
 DIPLÔME NATIONAL DU BREVET SESSION 2018 SCIENCES
DIPLÔME NATIONAL DU BREVET SESSION 2018 SCIENCES
L'utilisation du dictionnaire est interdite. Page 2. CODE SUJET : 18GENSCAN1. Page 2 sur 8. PHYSIQUE-CHIMIE
 DIPLÔME NATIONAL DU BREVET SESSION 2017 PREMIÈRE
DIPLÔME NATIONAL DU BREVET SESSION 2017 PREMIÈRE
DIPLÔME NATIONAL DU BREVET. SESSION 2017. Dès que le sujet vous est remis assurez-vous THÉMATIQUE COMMUNE DU SUJET DE MATHÉMATIQUES
 [PDF] BREVET BLANC n°1 de PHYSIQUE-CHIMIE
[PDF] BREVET BLANC n°1 de PHYSIQUE-CHIMIE
1 Numéro d'anonymat : BREVET BLANC n°1 de PHYSIQUE-CHIMIE Ce sujet comporte 3 pages numérotées l'usage de la calculatrice est autorisé
 [PDF] DNB Epreuve de Physique-Chimie (30 min)
[PDF] DNB Epreuve de Physique-Chimie (30 min)
1/5 Répartition des points : • 15 points pour le sujet • 2 points pour la présentation de la copie et DNB Epreuve de Physique-Chimie (30 min)
 [PDF] Brevet blanc no 2 : mathématiques physique-chimie et SVT
[PDF] Brevet blanc no 2 : mathématiques physique-chimie et SVT
Brevet blanc no 2 : mathématiques physique-chimie et SVT 1re partie • Mathématiques (2 heures) EXERCICE 1 • DÉCORTIQUER LE PROGRAMME 8 POINTS
 [PDF] Sujet-Brevet-2017-SVT-physique-chimie-Polynésiepdf
[PDF] Sujet-Brevet-2017-SVT-physique-chimie-Polynésiepdf
DIPLÔME NATIONAL DU BREVET SESSION 2017 DEUXIÈME ÉPREUVE 2e partie PHYSIQUE-CHIMIE ET SCIENCES DE LA VIE ET DE LA TERRE Série générale
 [PDF] BREVET BLANC 1 : EPREUVE SCIENCES PHYSIQUE CHIMIE
[PDF] BREVET BLANC 1 : EPREUVE SCIENCES PHYSIQUE CHIMIE
EXERCICE 1 : Mesure du pH (sur 125 pts) Une solution aqueuse est un liquide contenant de l'eau est une substance dissoute Elle peut être caractérisée par
 [PDF] Annales - 2017 - Collège Alexander Fleming
[PDF] Annales - 2017 - Collège Alexander Fleming
1RE ÉPREUVE COMPLÈTE DU NOUVEAU BREVET Sujet zéro Maths - Physique-Chimie - Technologie Partie 1 Mathématiques 1 à 7 Exercices Partie 2 Physique-Chimie
 3ème -Sujets entraînements brevet physique-chimie - Wixcom
3ème -Sujets entraînements brevet physique-chimie - Wixcom
3ème - Sujets entraînements brevet ; Sujet zéro brevet Métropole 2018 ; Sujet brevet blanc 12/2016 ; Sujet brevet blanc 12/2017 ; Sujet brevet blanc 12/2018
 [PDF] Sujets BREVET – PHYSIQUE CHIMIE
[PDF] Sujets BREVET – PHYSIQUE CHIMIE
1- Donner la composition de la molécule de citrate de clomifène 2- L'élément chlore a pour formule 35 17 Cl Donner la composition de l'atome de chlore
 Sujet et corrigé Sciences – Brevet des collèges - Studyrama
Sujet et corrigé Sciences – Brevet des collèges - Studyrama
1 juil 2022 · Découvrez le corrigé de l'évaluation de Physique-chimie et SVT du Brevet 2021 Extrait du corrigé de Physique Chimie : Question 1
 [PDF] physique-chimie - série collège
[PDF] physique-chimie - série collège
Exercice 1 : Quel est le point commun des différentes centrales électriques ? Voici les schémas indiquant les éléments de deux sortes de centrales électriques
1/ Chimie : organisation et transformation de la matière
a) Atomes, molécules et ions bougent des électrons. Une molécule est constituée de plusieurs atomes.Modèle de
Nom Carbone Hydrogène Oxygène Azote
Symbole C H O N
Quasiment toute la masse est contenue dans le noyau.La taille du noyau -15 m -10 m un noyau est
environ 100 lacunaire : entre les électrons et le noyau, il y a du vide. Un atome est électriquement neutre : il y a donc autant de protons (chargés +) que Les atomes (et noyaux) sont représentés par un symbole : Les 118 atomes différents sont classés dans le tableau périodique des éléments par numéro atomique Z croissant : 18 colonnes, 7 lignes.Atome Nombre de
protons (Z)Nombre
Nombre de
neutronsCarbone
126C 6 6 12 - 6 = 6
Sodium
2311Na 11 11 23 11 = 12
atomeMolécule
C2H6O A X Z protons nucléons (protons + neutrons)La molécule contient 2 atomes de
Electrons : chargés ʹ
Protons : chargés +
Neutrons : charge 0
atome de Bore : Z = 5 (5 protons) ; 5 électrons ; 6 neutronsUn . Il y a
donc des : Ions positifs appélés CATIONS PERDU des électrons. Ex : Fe2+, Fe3+, Al3+ Ions positifs appélés ANIONS : Atom des électrons. Ex : Cl-, F-, SO42- Per- nb de charges " + » nb de charges " - » aluminium (III) Al3+ perte de 3 e- 13 10 fer(III) Fe3+ perte de 3 e- 26 23 fer (II) Fe2+ perte de 2 e- 26 24 chlorure Cl- - 17 18 b) Identification des ionsUne solution est toujours électriquement neutre : il y a autant de charges positives que de charges
négatives. Une solution ionique : (ion + + ions -)Exemples : sulfate de cuivre II : (Cu2+ + SO42) Chlorure de fer III (Fe3+ + 3 Cl-)
de couleurs.Ion Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn2+Aluminium
Al3+Réactif
utilisé nitrate (Ag+ +NO3)Soude ou hydroxyde de sodium (Na+ + HO-)
Précipité
obtenu BleuVert kaki
marron blanc blancExemples :
Les réactions chimiques qui ont lieu
entre le réactif et la solution sont :Cu2+ + 2 HO- Cu(OH)2
Ag+ + Cl- AgCl
Zn2+ + 2 HO- Zn(OH)2
Un précipité est un solide
Perte de 2 électrons
Atome de magnésium Mg
électriquement NEUTRE
12 électrons ʹ
12 protons +
12 neutrons 0
Ion magnésium Mg2+
10 électrons ʹ
12 protons +
12 neutrons 0
Gagne 1 électron
Atome de fluor F
électriquement NEUTRE
9 électrons ʹ
9 protons +
10 neutrons 0
Atome de fluor F-
électriquement NEUTRE
10 électrons ʹ
9 protons +
10 neutrons 0
Blanc qui noircità la lumière
Il y a des ions Cl-
Il y a des ions Cu2+
Solution de chlorure de cuivre II Cu2+ + 2 Cl-)
Il y a des ions Cl-
Il y a des ions Zn2+
Solution de chlorure de zinc Zn2+ + 2 Cl-)
c) pH : solutions acides et basiquesUne solution est acide
hydrogène H+ Une solution est basique si son pH est compris entre 7,01 et 14. La basicité est due à ion hydroxyde HO-Une solution très acide (pH proche de 0) et une solution très basique (pH proche de 14) sont dangereuses :
On mesure le pH avec :
Du papier pH
Un indicateur coloré acido-basique comme le jus de chou rouge, qui change de couleur en fonction du pH.
Un pH-mètre
Remarque :
d) Réaction entre un acide et une base hydrique (H + + Cl- de sodium (Na + + HO-), une réaction chimique a lieu et dégage beaucoup de chaleur.H+ + HO- H2O
e) Réaction entre un acide et un métal Un métal est un bon conducteur thermique et électrique. Il est recyclable. Produits corrosifsProduitsécotoxiquesProduits irritants2 H+ + Fe = H2 + Fe2+
Dihydrogène explosif : quand on approche une allumette : détonation" POP »2 H+ + Zn = H2 + Fe2+
6 H+ + 2 Al = 3 H2 + 2 Al3+
: RIEN Les ions qui ne réagissent pas sont dits spectateurs : on ne les écrit Lors de la réaction entre un acide et un métal, Les ions hydrogène H+ pour donner du dihydrogène gazeux H2 - Il y a conservation de la masse du signe " = ») - Il y a conservation des charges électriques (il y a autant de + et de de chaque côté). f) Autres transformations chimiques : A chaque fois, il faut veiller à la conservation des atomes de chaque côté du " = ».Combustion du carbone : C + O2 = CO2
Combustion du méthane : CH4 + 2 O2 = CO2 + 2 H2O Combustion du propane : C3H8 + 5 O2 = 3 CO2 + 4 H2O Combustion : C2H6O+ 3 O2 = 2 CO2 + 3 H2O me de banane : C5H12 O + C2H4O2 = C7H14O2 + H2O g) Masse volumique (pas au programme du DNB 2017)Exemple :
Un matériau appelé Hassium est un des plus dense sur Terre.. Un morceau de volume V= 1200 cm3 = 1,2 L a une
ǒ3 et kg/m3
ǒ40,8 g/cm3 = 40 800 kg/m3
h) Différents états de la matière mǒ x V
m = ǒ x Vǒ = m
V V = m en kg ou g en m3 ou cm3 en kg/m3 ou g/cm3Etat Solide Liquide gazeux
du modèle molécule Compact et ordonné Compact et désordonné Dispersé et très désordonnéMolécules Liées, quasi immobiles
et rapprochéesUn peu liées, mobiles et
très rapprochéesNon liées, éloignées, en
mouvement rapideVolume propre, une
forme propre Volume propre i) Atmosphère terrestre mélange de plusieurs gaz : sa composition est78% de diazote N2 : on arrondira à 80 % soit 4/5.
21% de dioxygène O2: on arrondira à 20% soit 1/5.
: le dioxyde de carbone CO2 le dihydrogène H2 Le dioxygène O2 est un gaz indispensable à la respiration et aux - (1 litre deau pèse 1 kg) j) Différence entre transformation physique, transformation chimique, mélange - Une transformation physique est la passage de la matière . Il y a juste un Atomes et molécules ne changent pas. Ex : vaporisation, solidification,- Une transformation chimique est le passage d'une espèce chimique à une nouvelle espèce chimique.
Les espèce chimiques de départ, appelées REACTIFS, se transforment en nouvelles espèces chimiques
appelées PRODUITS. Le phénomène permettant cette transformation chimique est appelé réaction
chimique. Exemples : décomposition, synthèses, oxydations, précipitations, certaines dissolutions. - Un mélange est juste une mise en commun de deux corps ensemble. Ex : huile + vinaigre. k) Différence entre transformation physique, transformation chimique, mélangeTests caractéristiques
Gaz Test
Dihydrogène
H2Détonation à
allumetteDioxyde de carbone
CO2Eau de chaux qui se
troubleEteint une flamme de
bougieDichlore Cl2 Gaz de couleur verte
qui pueDioxygène O2 Ravive une flamme ou
une braise (liquide ou gaz)Eau H2O
Sulfate de cuivre
anhydre qui devient bleu2/ Energie
est un concept abstrait qui quantifie . transfère et se transforme.Unité officielle (SI) : le Joule (J).
a) renouvelables : Soleil, eau, chaleur de la Terre (géothermie), vent, biomasse non- renouvelables son o Sources fossiles : pétrole, gaz, charbon. o Source nucléaire : Uranium. : potentielle de position , cinétique, électrique, lumineuse , chimique, thermique, mécanique, nucléaire, musculairePétrole, gaz, charbon Energie chimique
Uranium Energie nucléaire
Vent Energie cinétique (ou éolienne)
Soleil Energie lumineuse ( ou solaire)
Chaleur de la Terre Energie thermique (ou
géothermique)Biomasse Energie chimique
Eau Energie cinétique ( ou
hydraulique) b) Ex : pile qui alimente une lampe Ex : dynamo qui alimente une lampe ie chimique enénergie électrique
c)Il existe plusieurs façons de t :
LeLe transfert thermique par :
Conduction : sans transport de matière, du corps chaud vers le corps froid. Convection : avec transport de matière, entre des fluides chauds et froids. Rayonnement : par des ondes électromagnétiquesénergie électrique
d)Les : On fait tourner une turbine (avec de
alternateur.Un alternateur aimant + une bobine.
Un alternateur est un convertisseur
énergie électrique
nucléaire et 19,1 % (eau, vent, bois, déchets, soleil) provient de sources able pour fabriquer de la vapeurUn alternateur produit une tension
alternative (alternativement + et -). variable (qui change tout le temps). En conséquence, la tension délivrée par EDF qui arrive dans nos maisons a la forme suivante. - Alternative : car elle est alternativement + et - Périodique : car elle se répète identiquement dans le temps. - Variable : car elle change tout le temps - Sinusoïdale arrondiePériode T :
Fréquence f = 1/T
Umax maximale.
Pour la tension du secteur (prise de courant) :
- Fréquence f = 50 Hz - Période T = 20 ms - Tension maximale Umax - tension efficace mesurée avec un voltmètre en alternatif UeffAimant = Rotor
bobine statorAlternateur
Tension du secteur
Echelle : 1 carreau horizontal vaut 0,01 s
1 carreau vertical vaut 100 V
e) Energie cinétique, énergie potentielle de position, énergie mécanique.Energie cinétique Ec :
Ec = ½ x m x v²
Energie potentielle de position Ep :
Ep = m x g x h
Energie mécanique Em :
Em est la somme énergie cinétique Ec énergie de position EP : potentielle de position diminue et se convertit en énergie cinétique (qui augmente). pertes f) Sécurité routière DA = DR + DF convertie en énergie thermique et déformation.Les dégâts engendrés lors choc sont
Si v x 2 dégâts x 4
DF du
La distance de freinage est multipliée par 4 lorsque la vitesse est multipliée par 2 La distance de freinage est multipliée par 9 lorsque la vitesse est multipliée par 3 DR ne dépend que du chauffeur et de la vitesse. g) Puissance électrique La puissance nominale E échangée (reçue ou donnée) pendant une durée t = 1 seconde. un minimum de temps. ... de l'état de fatigue du conducteur. ... du système de freinage du véhicule ... de l'absorption d'alcool, de drogues, médicaments ......de la température. la distraction ou de la concentration ... de l'état des pneumatiques. ... de la vitesse du véhicule.En Joule (J)
En kilogramme (kg)
en m/sEn Joule (J) En kilogramme (kg)
Pesanteur en N/kg
E p mg x hEp = mgh
m = Ep ÷ (gh) h = Ep ÷ (mg) Ec0,5 m x v²
Ec = ½ m v²
m = Ec ÷ 0,5m v =Hauteur en m
Em = Ec + Ep
En courant continu :
En courant alternatif : la relation reste valable pour les appareils résistifs ou chauffants
(lampes, résistances, plaques de cuisson, grille-l faut juste prendre les valeurs efficaces des tensions Ueff et intensité Ieff. h) Energie électrique reil de puissance nominale P est : Si P est en watt(W) et t est en seconde (s) alors E est en Joule (J)Si P est en watt(W) et t est en heure (h) alors E est en wattheure (Wh) 1Wh = 3600 J
Si P est en kilowatt(W) et t est en heure (h) alors E est en kilowattheure (kWh) 1kWh = 3 600 000 J
Exercice : Sa 10 min de sèche-cheveux de puissance 1200 W?E = P x t = 1,2 x (10/60) = 0,2 kWh
Ou autre méthode
E = P x t = 1200 x 10 x 60 = 720 000 J
Dont le prix à payer est : 0,12 x 0,2 =
i)La tension U edipôle ohmique (résistance)
P = U x I
PU x I
xP = U x I
U= P ÷ I
I = P ÷ U
Peff = Ueff x Ieff
Puissance en W tension en V intensité en A
E = EP x t
E = P x t
U= E ÷ t
quotesdbs_dbs9.pdfusesText_15[PDF] exercices brevet probabilités
[PDF] exercices brevet pythagore
[PDF] exercices brevet sciences physiques
[PDF] exercices brevet scratch
[PDF] exercices brevet scratch pdf
[PDF] exercices brevet sur les fonctions
[PDF] exercices brevet sur les puissances
[PDF] exercices brevet svt 2018
[PDF] exercices brevet technologie
[PDF] exercices brevet thales
[PDF] exercices brevet thales et pythagore
[PDF] exercices brevet transformations
[PDF] exercices brevet transformations du plan
[PDF] exercices brevet triangles semblables
