 Fiche élève : le phénotype Document : les OGM transgénèse et
Fiche élève : le phénotype Document : les OGM transgénèse et
Document : les OGM transgénèse et souris verte. Source : cycle 4 SVT
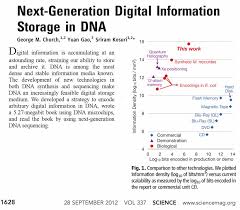 TP6 : Le support de linformation génétique
TP6 : Le support de linformation génétique
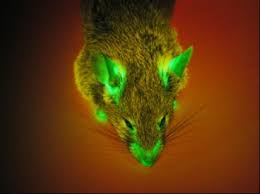
Lucie n'est pas une souris comme les autres : chaque cellule de son organisme fabrique une protéine fluorescente verte ( GFP : green fluorescent protein en
 DM : La souris verte : transgénèse La transgénèse est une
DM : La souris verte : transgénèse La transgénèse est une
« Lucie n'est pas une souris comme les autres. : chaque cellule de son organisme fabrique une protéine fluorescente verte (GFP : green fluorescent protein en
 Diapositive 1
Diapositive 1
La souris (Mus musculus) est l'animal expérimental le plus utilisé (482%). Viennent ensuite les poissons
 Modèles experimentaux et recherche thérapeutique - La Lettre de l
Modèles experimentaux et recherche thérapeutique - La Lettre de l
16 juin 2020 GFP (vert). d. oSSier être ... dans les années 80 avec la technique de transgenèse permettant d'ajouter un gène extérieur dans une souris.
 TRANSGENESE 1
TRANSGENESE 1
« Lucie n'est pas une souris comme les autres : chaque cellule de son organisme fabrique une protéine fluorescente verte ( GFP : green fluorescent protein en
 Apport de la transgénèse murine dans létude des mucines
Apport de la transgénèse murine dans létude des mucines
23 mars 2020 souris avec des souris transgénique Zp3-Cre (C57BL/6-Tg (Zp3-cre) ... est vert et la contre-coloration nucléaire est bleue. La quantification ...
 Application de la FIV à la production de souris génétiquement
Application de la FIV à la production de souris génétiquement
La transgénèse in vivo chez la souris est un des domaines majeurs d'utilisation de CRISPR/Cas9 pour l'identification de cibles thérapeutiques et la
 Modifications génétiques animales et végétales: méthodes de
Modifications génétiques animales et végétales: méthodes de
simplifier la transgénèse. Des clones de moutons ont été ainsi obtenus à Souris transgénique avec un gène remplacé ou un gène étranger. Souris non- ...
 La green fluorescent protein : application à la dynamique
La green fluorescent protein : application à la dynamique
ont obtenu des souris transgéniques vertes [32] dont tous les organes sont fluorescents. La GFP peut également servir comme marqueur pour suivre le devenir
 DM : La transgénèse SUJET 2 Rappels: Un gène est un segment d
DM : La transgénèse SUJET 2 Rappels: Un gène est un segment d
Doc a : Une souris verte qui brillait dans l'herbe … Des biologistes de l'université d'Osaka ont produit des souris vertes luminescentes par manipulation
 ÉVALUATION DANS LESPRIT DUNE PARTIE 2 EXERCICE 2 DUN
ÉVALUATION DANS LESPRIT DUNE PARTIE 2 EXERCICE 2 DUN
Le journal « le Monde » a présenté un article dont le titre est surprenant « des souris vertes et fluorescentes sont nées dans un laboratoire de recherche
 Application de la FIV à la production de souris génétiquement
Application de la FIV à la production de souris génétiquement
La transgénèse in vivo chez la souris est un des domaines majeurs d'utilisation de CRISPR/Cas9 pour l'identification de cibles thérapeutiques et la
 La green fluorescent protein : application à la dynamique
La green fluorescent protein : application à la dynamique
souris transgéniques vertes [32] dont tous les organes sont fluorescents. La GFP peut également servir comme marqueur pour suivre le.
 3e SVT Chapitre 4 DEVOIR MAISON : Une souris verte qui brillait
3e SVT Chapitre 4 DEVOIR MAISON : Une souris verte qui brillait
Roméo (5 ans) est en train de chanter une souris verte. La transgénèse est une technique permettant chez les êtres vivants des transferts de gènes.
 Diapositive 1
Diapositive 1
1) Expérience de transgénèse. Une souris verte qui… Le document ci-contre schématise quelques-unes des étapes permettant d'insérer un gène.
 Thème 1- Chapitre 4 Activité 1 : La molécule dADN : une molécule
Thème 1- Chapitre 4 Activité 1 : La molécule dADN : une molécule
grâce à l'étude des divers documents fournis basés sur l'exemple de « la souris verte ». Schéma simplifié de la transgénèse permettant l'obtention de.
 BDE Valrose
BDE Valrose
Bilan d'une expérience de transgenèse chez la souris : Souris vertes avec le gène GFP qui sert de gène rapporteur (On va prendre le promoteur du gène
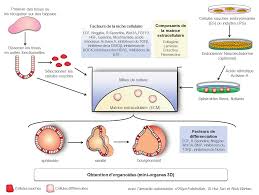
 IV) Les techniques utilisées en Biologie du développement
IV) Les techniques utilisées en Biologie du développement
Exemple : coupe d'un pancreas d'un embryon de souris vert :Ab anti- insuline (+ anti –IgG-lapin-FITC) ... par transgenèse (addition d'un gène).
 Modifications génétiques animales et végétales: méthodes de
Modifications génétiques animales et végétales: méthodes de
mieux utiliser la transgénèse pour souris. L'addition de gène réalisée pour la première fois en 1980-1982
Cependant, les techniques dispo-
nibles permettant d'étudier la cellule vivante sont encore rares. Le déve- loppement d'une méthode simplequi permet la visualisation d'événe- ments cellulaires dans leur environ- nement naturel constitue donc une avancée importante en biologie cellu- laire: cette méthode repose sur la green fluorescent protein(GFP), pro- téine fluorescente extraite de la méduse Aequorea victoria. Le clonage du gène de la GFP dans un premier temps [1] et l'étude de son expres- 45La green fluorescent protein: application
à la dynamique
intracellulaire des récepteurs stéroïdiensLa green fluorescent protein(GFP) est une protéine extraite de la méduse Aequorea victoria. Cette protéine a la particu- larité d'émettre de la fluorescence sous UV sans l'ajout de substrat ou de co-facteurs. Le clonage de son gène et l'étude de son expression dans des bactéries ou dans des organismes plus complexes tel que C. elegansont enrichi les perspectives de son application dans la recherche biomédi- cale. Le gène de la GFP est aujourd' hui utilisé comme gène rapporteur, comme marqueur cellulaire ou encore comme marqueur moléculaire. Le gène codant pour la GFP a par exemple été fusionné aux gènes codant pour des récep- teurs stéroïdiens afin de connaître la dynamique intracellu- laire de ces récepteurs. A ce jour, ont été rapportées les protéines de fusion avec le récepteur des glucocorticoïdes (GFP-GR), le récepteur des minéralocorticoïdes (GFP-MR) et le récepteur des androgènes (GFP-AR). La fluorescence émise par la GFP permet de localiser les protéines dans les compartiments cellulaires et d'en définir ainsi les déplace- ments lors de stimulations diverses, rendant accessible la visualisation d'événements cellulaires dynamiques.ADRESSESV. Georget: étudiante en thèse. J.C. Nicolas:directeur de recherche à l'Inserm. Inserm U.439,
Pathologie moléculaire des récepteursnucléaires, 70, rue de Navacelles, 34090Montpellier, France. C. Sultan : professeur demédecine à l'université de Montpellier I. InsermU.439, Pathologie moléculaire des récep-teurs nucléaires, 70, rue de Navacelles,34090 Montpellier, France. Unité BEDR,hôpital Lapeyronie, 34295 MontpellierCedex 5, France. Unité d'endocrinologiepédiatrique, H
ôpital A.-de-Villeneuve,34295 Montpellier Cedex 5, France.SYNTHÈSE médecine/sciences 1999 ; 15 : 45-55m/s n°1, vol.15, janvier 99Virginie Georget
Jean-Claude Nicolas
Charles Sultan
34243$1 045-055 2/05/02 17:34 Page 45
sion dans des organismes tels que la bactérie Escherischia coliou le néma- tode Caenorhabditis elegans, dans un second temps, [2] ont ouvert de nombreuses perspectives dans l'utili- sation de cette protéine en biologie cellulaire et en génétique molécu- laire. Le système GFP est aujourd'hui utilisé comme marqueur cellulaire pour identifier puis trier une popula- tion cellulaire transformée [3], comme gène rapporteur pour mesu- rer l'expression d'un gène dans des cellules vivantes [2], ou encore comme marqueur moléculaire pour visualiser, dans une cellule vivante, la dynamique d'une protéine fusionnéeà la GFP [4]. Dans cet article, nous
développerons plus particulièrement ce dernier aspect dans l'étude de la dynamique intracellulaire des récep- teurs stéroïdiens. Green fluorescentprotein: structure,fonctionnementParmi les nombreux organismes bio-
luminescents, la méduseAequorea vic- toriapeut émettre une lumière verte de ses photocytes jusqu'aux bords de son ombrelle [5]. Cette fluorescence est engendrée par l'activation séquentielle de deux protéines : l'aequorine, une protéine dépen- dante du calcium et la green fluores- cent protein(GFP) (figure 1). En pré- sence d'oxygène, l'aequorine est couplée à la coelentérazine. La fixa- tion de calcium provoque un change- ment conformationnel de l'aequo- rine qui induit une oxygénation de la coelentérazine. Cette réaction d'oxy- génation s'accompagne d'une émis- sion de lumière bleue. Dans la méduse, un transfert d'énergie entre l'aequorine et la GFP conduit à l'émission d'une lumière verte [6].In vitro, la fluorescence de la GFP
peut être obtenue par excitation en lumière bleue ou en UV.La GFP est une protéine de 238acides
aminés avec une masse molaire de 27à 30kDa en gel polyacrylamide déna-
turant (SDS-PAGE) [7]. Cette pro- téine est très stable et résistante à de nombreuses conditions physico-chi- miques dénaturantes. In vitro, la GFP conserve sa fluorescence à des tem- pératures aussi élevées que 65°C et dans une gamme de pH de 5,5 à 12 avec, toutefois, une diminutiond'intensité pour des pH inférieurs à7. La fluorescence de la GFP résiste
dans des solutions qui contiennent jusqu'à 6M d'hydrochlorure de gua- nidium, 8M d'urée, 1% de SDS ou dans des solvants organiques dilués.La GFP reste aussi fluorescente après
fixation des cellules par du glutaral- déhyde ou du paraformaldéhyde.Même si la majeure partie de la pro-
téine (acides aminés 7 à 229) est nécessaire à l'acquisition de la fluo- rescence de la GFP [8], son chromo- phore n'est constitué que de trois acides aminés en position Ser65-Tyr66-Gly67 [9]. In vitro, la GFP est
donc fluorescente sans ajout de sub- strat ou de co-facteurs [2]. Sa cristal- lisation révèle que la protéine est constituée de 11 feuillets β, d'une hélice αqui contient le chromo- phore et de boucles entre les feuillets [10, 11]. Les 11 feuillets βforment une cage dans laquelle est empri- sonné le chromophore, les bouclesformant le plancher de la cage (figure2).Cette forme surprenante de la
GFP est appelée forme "β-can». La
formation du chromophore au sein de la cage se produit par une modifi- cation post-traductionnelle autocata- lytique des acides aminés 65-67. Ces trois résidus sont dans un premier temps cyclisés puis oxydés pour for- mer le chromophore p-hydroxyben- zylidene-imidazolidinone (figure 3) [7, 12, 13]. C'est seulement après l'oxydation que la GFP est fluores- cente. Cette oxydation est également suivie d'un cycle de protonation- déprotonation. La formation de ce chromophore actif se produit en 2 à4 heures environ. La GFP native pré-
sente deux pics d'absorption, un pic majeur à 395nm et un pic d'une moindre intensité autour de 477nm, et un pic d'émission à 509 nm. Ces deux pics d'absorption semblent être associés à deux formes isomères du chromophore qui peuvent être sous 46m/s n°1, vol.15, janvier 99
Lumière bleue
Lumière verte
Coelentérazine
Coelentéramide
Transfert
d'énergieCa 2+ GFPApoaequorineAequorine
Figure 1.Mécanisme d'activation de
la GFP dans la méduse Aequorea vic- toria.En présence d'oxygène, l'aequo- rine est une protéine dépendante du calcium couplée à la coelentérazine.La fixation de calcium provoque un
changement conformationnel de l'aequorine qui induit une oxygéna- tion de la coelentérazine. Cette réac- tion d'oxydation s'accompagne d'uneémission de lumière bleue. Il s'établit
alors un transfert d'énergie entre l'aequorine et la GFP. Ce transfert d'énergie conduit à l'émission d'une lumière verte de la GFP.Figure 2.Structure cristallogra-
phique de la GFP. La GFP est consti- tuée de 11 feuilletsβet d'une hélice
α. Les feuillets βsont disposés en
parallèle et forment une cage dans laquelle est enfermée l'héliceαqui
contient le chromophore. Les boucles entre les feuilletsβforment
le plancher de la cage. Cette forme surprenante de la GFP est appeléeβcan». (Cette image a été repro-
duite avec l'aimable autorisation deM. T.D. Romo, Université de Rice.)
34243$1 045-055 2/05/02 17:34 Page 46
forme stable et sous forme excitée.Après irradiation à 395nm, la forme
stable absorbe à 477 nm. Cette pro- priété est d'ailleurs à la base d'une application de la GFP. Elle consiste à irradier par un laser UV (395nm) laGFP, ce qui augmente la forme qui
absorbe à 477nm et la fluorescence de la GFP lorsqu'elle est excitée à cette longueur d'onde d'où son nom de sur-fluorescence [14]. Ces deux isomères correspondent à des formes protonées et déprotonées [7] qui sont maintenant mieux comprises depuis la cristallisation de la GFP sau- vage [11] et qui sont dues à des inter- actions spécifiques entre les acides aminés du chromophore et les acides aminés des feuillets βpositionnés sur la face interne de la cage [15]. A ce jour, de nombreuses variantes de laGFP existent, chacune apportant de nouvelles propriétés de fluorescence.La GFP-S65T est mutée dans le chro-
mophore en position 65 et substitue une thréonine à la sérine [16]. CetteGFP présente des caractéristiques de
fluorescence modifiées (Tableau I).En effet, la mutation simplifie le
spectre à un seul pic d'absorption à488nm [16], ce qui permet de détec-
ter cette GFP avec des filtres clas- siques de fluorescéine isothiocyanate (FITC). De plus, cette substitution qui induit une fluorescence six fois plus forte que celle de la GFP sau- vage est plus résistante au photoblan- chiment. Certaines mutations telles que la S65T sont connues pour aug- menter la vitesse de formation du chromophore et notamment la cycli- sation, ce qui réduit le temps de latence entre la synthèse et la fluores- cence de la GFP [16]. Pour la plupart des GFP, la formation optimale du fluorophore dépend du pH et de la température. Par exemple, la GFP native est plus fluorescente à 28°C qu'à 37°C [17]. Trois GFP mutées, l'α-GFP mutée en positionF100S/M154T/V164A [18], l'EGFP
(enhanced-GFP)mutée en F64L/S65T [19, 20] et la GFP mutéeS65T/S147P [21] ont la capacité
d'acquérir la conformation correcteà toute température physiologique
[21, 22] (Tableau I).Ces dernières, beaucoup plus fluorescentes que laGFP sauvage, sont les candidates
idéales pour une étude en cellule vivante. Néanmoins, l'intensité de fluorescence des GFP S65T et de l'EGFP diminue très rapidement à des pH inférieurs à 7, contrairementà la GFP sauvage et l'α-GFP qui sont
résistantes à une large gamme de pH [22]. Cette propriété est maintenant utilisée pour mesurer des variations de pH au sein de différents comparti- ments d'une seule cellule [23]. En revanche, ces GFP ne sont pas adap- tées pour l'étude de phénomènes qui se déroulent dans des compartiments acides tels que les lysosomes ou les endosomes. La stabilité de la GFP représente un avantage dans des applications de marquage molécu- laire mais elle peut aussi être un inconvénient quand le gène de laGFP est utilisé comme gène rappor-
teur. Cette stabilité ne permet pas d'étudier des phénomènes de syn- thèse rapide et transitoire. C'estpourquoi, de nouvelles constructions de la GFP ont été récemment déve- loppées: il s'agit de la fusion à la par- tie carboxy-terminale de la GFP de petits peptides qui seraient suscep- tibles de rendre la GFP plus sensible aux protéases et donc de réduire son temps de demi-vie [24]. De plus, une nouvelle GFP déstabilisée estquotesdbs_dbs46.pdfusesText_46[PDF] la transition démographique (cause et conséquence)
[PDF] La Transition démographique (explication)
[PDF] La Transition Démographique en France et en Angleterre
[PDF] La transition énergétique
[PDF] la translation DM
[PDF] La translation et les vecteurs
[PDF] la translation qui transforme a en b transforme c en d
[PDF] LA transmission de l albinisme
[PDF] la transmission de l'information génétique
[PDF] La transmission de l'information génétique de génération en génération
[PDF] La transmission de l'information héréditaire
[PDF] la transmission de l'information génétique 3ème controle
[PDF] La transmission de la couleur des yeux de génération en génération
[PDF] La transmission de la mucoviscidose
