 Réaction de quelques métaux avec Les solutions acides et les
Réaction de quelques métaux avec Les solutions acides et les
l'acide chlorhydrique réagit avec le Fer l'Aluminium et le Zinc mais il est sans avec le Zinc et Aluminium
 ) réaction dune solution acide avec les autres métaux
) réaction dune solution acide avec les autres métaux
Seuls les métaux non-nobles(fer zinc
 Réactions de quelques métaux avec les solutions acides et les
Réactions de quelques métaux avec les solutions acides et les
Conclusion: l'acide chlorhydrique réagit avec le fer l'aluminium et le zinc mais ne réagit avec le cuivre. • Les produits de la réaction sont le dihydrogène et
 C6 Réaction entre le fer et lacide chlorhydrique
C6 Réaction entre le fer et lacide chlorhydrique
L'acide chlorhydrique est une solution aqueuse acide. D'autres métaux ne réagissent pas avec l'acide chlorhydrique comme le cuivre
 ? Zn2+
? Zn2+
zinc se transforme en ions Zn2+. La réaction inverse n'est pas possible. Dans une équation d'oxydoréduction l'oxydant d'un couple réagit avec le ...
 TRANSF 4 : Réaction avec les acides
TRANSF 4 : Réaction avec les acides
Pourquoi l'eau s'élève-t-elle dans les éprouvettes au fur et à mesure que le fer L'acide chlorhydrique ne réagit pas avec le cuivre l'or
 Réaction entre lacide chlorhydrique et le fer _Doc. professeur
Réaction entre lacide chlorhydrique et le fer _Doc. professeur
Par contre le cuivre
 Untitled
Untitled
b) Pourquoi la corrosion du fer se poursuit-elle en profondeur ? Exercices. l'acide chlorhydrique ne réagit pas avec le cuivre.
 Action des acides sur le plomb et le cuivre
Action des acides sur le plomb et le cuivre
refroidie d'acide chlorhydrique ayant réagi avec du plomb à chaud concentrés pour ne pas agir seulement comme des acides. C'est le cas de l'acide ...
 MT22410
MT22410
droxyde de sodium (soude) avec quelques propriétés C'est pourquoi ... L'acide chlorhydrique ne réagit pas avec tous les métaux en particulier avec le ...
 Chapitre 5 : Réaction de quelques métaux avec les
Chapitre 5 : Réaction de quelques métaux avec les
L’acide chlorhydrique ne réagit pas avec le cuivre II) ACTION DE LA SOUDE SUR LES METAUX : La soude de nom chimique hydroxyde de sodium et formule ionique (Na+ + HO-) est une solution basique on l’obtient par la dissolution de la soude NaOH dans l’eau pure La soude ne réagit pas avec le fer et cuivre La soude réagit avec le zinc et
 Chapitre 5 : Réaction de quelques métaux avec les solutions
Chapitre 5 : Réaction de quelques métaux avec les solutions
Avec le cuivre il ne se passe rien: l'acide chlorhydrique ne réagit pas avec le cuivre Avec les autres métaux il y a effervescence qui traduit un dégagement gazeux L'acide chlorhydrique réagit avec le zinc le fer et l'aluminium L'approche d'une allumette enflammée provoque une détonation sauf avec le tube contenant le cuivre et l
Comment l'acide chlorhydrique réagit-il avec le cuivre?
Avec le cuivre, il ne se passe rien: l'acide chlorhydrique ne réagit pas avec le cuivre. Avec les autres métaux, il y a effervescence qui traduit un dégagement gazeux. L'acide chlorhydrique réagit avec le zinc, le fer et l'aluminium.
Pourquoi l'acide chlorhydrique ne réagit pas avec le cuivre ?
L' acide chlorhydrique ne réagit donc pas avec le cuivre . On observera tout de même une petite réaction correspondant à la dissolution de la couche de passivation. Le cuivre est simplement décapé par HCl Est-ce que l'acide attaque le cuivre ?
Pourquoi le cuivre n’est pas attaqué par l’acide chlorhydrique ?
Le cuivre n’est pas attaqué par l’acide chlorhydrique Il se dégage alors des vapeurs rousses caractéristiques de l’oxydation du monoxyde d’azote (incolore) en dioxyde d’azote (roux) au contact de l’air, tandis que la solution se colore en vert.
Comment nettoyer le cuivre avec de l’acide chlorhydrique ?
Nettoyage du cuivre avec de l’acide chlorhydrique L’acide chlorhydrique peut être utilisé pour nettoyer le cuivre en raison de sa structure moléculaire solide et de sa résistance relative à l’oxydo-réduction. L’acide est capable de réagir avec le matériau oxydé à la surface du cuivre sans s’affaiblir à la suite de la réaction.
Prof : Amine khouya
υ Aminekhouya@gmail.com
Chapitre 5 : Réaction de quelques métaux avec les solutions acides et solution basiquesQuels matériaux utilisons-nous pour emballer les liquides ? les matériaux réagissent-ils avec les solutions
aqueuses acides ou basiques ? Comment décaper les métaux ? I. Attaque des métaux par une solution d'acide chlorhydrique :Définition :
L'acidité d'une solution est liée à la présence d'ion hydrogène, plus il y a d'ions H+ plus la solution est acide.
Exemples :
Solution d'acide chlorhydrique : (H+ + Cl-)
Solution d'acide sulfurique : (H+ + SO4-)
Solution d'acide nitrique : (H+ + NO3-)
L'acide chlorhydrique.
Une solution d'acide chlorhydrique contient de nombreux ions hydrogène H+ .Plus la concentration en
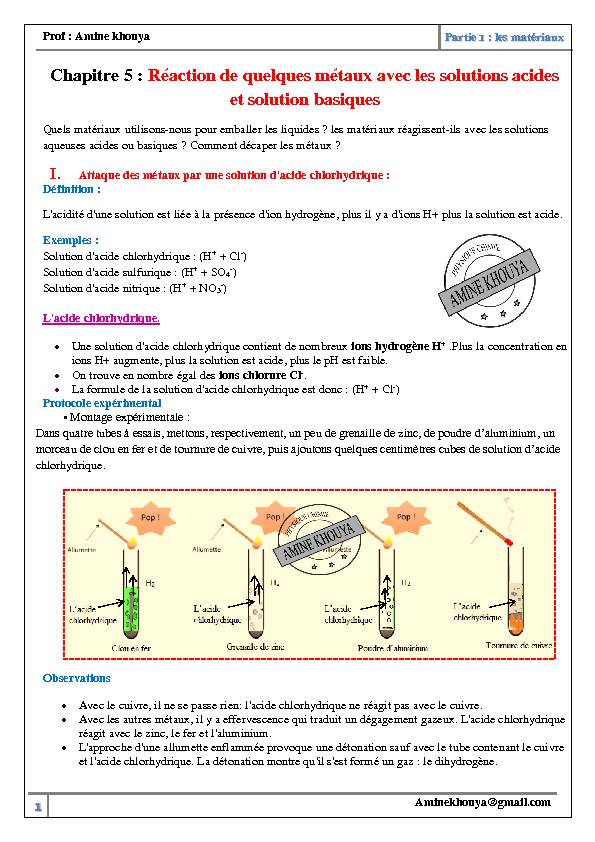
ions H+ augmente, plus la solution est acide, plus le pH est faible. On trouve en nombre égal des ions chlorure Cl-. La formule de la solution d'acide chlorhydrique est donc : (H+ + Cl-)Protocole expérimental
chlorhydrique.Observations
Avec le cuivre, il ne se passe rien: l'acide chlorhydrique ne réagit pas avec le cuivre.Avec les autres métaux, il y a effervescence qui traduit un dégagement gazeux. L'acide chlorhydrique
réagit avec le zinc, le fer et l'aluminium.L'approche d'une allumette enflammée provoque une détonation sauf avec le tube contenant le cuivre
et l'acide chlorhydrique. La détonation montre qu'il s'est formé un gaz : le dihydrogène.Prof : Amine khouya
φ Aminekhouya@gmail.com
Equations-bilans des réactions :
1) Avec le fer :
- Réactifs : fer et acide chlorhydrique- Produits : dihydrogène (allumette), ions chlorure (test au nitrate d'argent) et ions fer II (test à la soude).
Réactifs Produits
fer+ acide chlorhydrique chlorure de fer II + dihydrogèneFe + (H+ + Cl-) (Fe2+ + 2Cl-) + H2
Fe + 2 (H+ + Cl-) (Fe2+ + 2Cl-) + H2
Fe + 2H+ + 2Cl- Fe2+ + 2Cl- + H2
Les ions chlorure n'interviennent pas dans la réaction même s'ils sont indispensables pour que la
solution soit électriquement neutre. Ce sont les ions "spectateurs". On peut donc simplifier l'écriture de l'équation en ne les mentionnant pas.Fe + 2 H+ Fe2+ + H2
2) Avec le zinc :
- Réactifs : zinc et acide chlorhydrique- Produits : dihydrogène (allumette), ions chlorure (test au nitrate d'argent) et ions zinc (test à la soude).
Réactifs Produits
Zinc + acide chlorhydrique chlorure de zinc + dihydrogène Zn + (H+ + Cl-) (Zn2+ + 2 Cl-) + H2 Zn + 2 (H+ + Cl-) (Zn2+ + 2 Cl-) + H2 Zn + 2 H+ + 2 Cl- Zn2+ + 2 Cl- + H2Les ions chlorure n'interviennent pas dans la réaction même s'ils sont indispensables pour que la
solution soit électriquement neutre. Ce sont les ions "spectateurs". On peut donc simplifier l'écriture de l'équation en ne les mentionnant pas.Zn + 2 H+ Zn2+ + H2
3) Avec l'aluminium :
- Réactifs : aluminium et acide chlorhydrique- Produits : dihydrogène (allumette), ions chlorure (test au nitrate d'argent) et ions aluminium (test à la
soude).Prof : Amine khouya
χ Aminekhouya@gmail.com
Réactifs Produits
aluminium+ acide chlorhydrique chlorure d'aluminium + dihydrogène Al + (H+ + Cl-) (Al3+ + 3Cl-) + H2l'équation n'est pas "ajustée"; le nombre de chlore doit être le même des deux côtés de
l'équation. Soit le nombre 3; on multiplie par 3 dans les réactifs : x 3Al+3(H+ + Cl-) (Al3+ + 3Cl-) + H2
l'équation n'est pas "ajustée"; le nombre d'hydrogène doit être le même des deux côtés de
l'équation. soit le nombre 6; on multiplie par 6 dans les réactifs et par 3 dans les produitsAl+6(H+ + Cl-) (Al3+ + 3Cl-) + 3H2
'équation n'est pas encore "ajustée"; le nombre de chlore doit être le même des deux côtés de
l'équation. soit le nombre 6; on multiplie par 2 dans les produits.Al+6(H+ + Cl-) 2(Al3+ + 3Cl-) + 3H2
l'équation n'est pas encore "ajustée"; le nombre d'aluminium doit être le même des deux côtés
de l'équation. soit le nombre 2; on multiplie par 2 dans les réactifs.2 Al + 6 (H+ + Cl-) 2 (Al3+ + 3Cl-) + 3 H2
2 Al + 6H+ + 6Cl- 2Al3+ + 6Cl- + 3H2
Les ions chlorure n'interviennent pas dans la réaction même s'ils sont indispensables pour que la
solution soit électriquement neutre. Ce sont les ions "spectateurs". On peut donc simplifier l'écriture de l'équation en ne les mentionnant pas.2 Al + 6 H+ 2 Al3+ + 3 H2
3) Avec le cuivre :
Remarque :
Tous les métaux et alliages ne sont pas attaqués par les tous les acides.L'or (Au), l'argent (Ag) le cuivre (Cu)... ne réagissent pas avec l'acide chlorhydrique par contre
peuvent réagir avec d'autres solutions ainsi, le cuivre réagit avec l'acide nitrique.II. Généralisation aux autres métaux :
M + n (H+ + Cl-) (Mn+ + n Cl-) + H2Prof : Amine khouya
ψ Aminekhouya@gmail.com
III. Attaque des métaux par une solution d'hydroxyde de sodium :Définition :
La basicité d'une solution est liée à la présence d'ion hydrogène, plus il y a d'ions H+ plus la solution est
acide.Exemples :
Hydroxyde de sodium (la soude) : (Na+ + HO-)
La soude.
Une solution de soude porte également le nom d'hydroxyde de sodium. Elle contient donc des ions sodium (Na+) et des ions hydroxydes (HO-) responsables de son caractère basique (pH = 13).Protocole expérimental :
Dans quatre tubes à essais, mettons, respectivement, une pincée de grenaille de zinc, de poudre
un peu de la limaille de fer ( fer en poudre ) et une pincée de tournure de cuivre, puis ajoutons quelques
centimètres cubes de solution dhydroxyde de sodium (la soude) diluée.Observations
Avec le cuivre, il ne se passe rien: hydroxyde de sodium ne réagit pas avec le cuivre. Avec le fer, il ne se passe rien: hydroxyde de sodium ne réagit pas avec le fer Avec les autres métaux, il y a effervescence qui traduit un dégagement gazeux. hydroxyde de sodium réagit avec le zinc, l'aluminium.L'approche d'une allumette enflammée provoque une détonation sauf avec le tube contenant le cuivre
et le tube contenant le fer. La détonation montre qu'il s'est formé un gaz : le dihydrogène.
Equations-bilans des réactions :
Avec le zinc :
Réactifs Produits
Zinc + hydroxyde de sodium zincate de sodium + dihydrogèneAvec l'aluminium :
Réactifs Produits
Aluminium + hydroxyde de sodium aluminate de sodium + dihydrogèneProf : Amine khouya
ω Aminekhouya@gmail.com
Si vous avez des commentaires, des questions ou des remarques générales, pas à me contacter. aminekhouya@gmail.comquotesdbs_dbs2.pdfusesText_2[PDF] un mot plusieurs sens cm2
[PDF] liste mot double sens
[PDF] mots polysémiques
[PDF] mot a double sens definition
[PDF] comment appelle t on un mot qui a plusieurs sens
[PDF] séquence les différents sens d'un mot ce1
[PDF] combustion endothermique
[PDF] réaction exothermique delta h
[PDF] réaction athermique définition
[PDF] réaction athermique exemple
[PDF] lexique administratif français pdf
[PDF] enthalpie de réaction exercice corrigé
[PDF] entropie standard de réaction
[PDF] mots mélés adulte pdf
